【衡道丨干货】2025 中国肿瘤整合诊治指南(CACA) ——前列腺癌
时间:2025-03-09 12:09:04 热度:37.1℃ 作者:网络
2025 CACA指南——前列腺癌
前列腺癌流行病学
前列腺癌(Prostate Cancer,PC)是指发生在前列腺的上皮性恶性肿瘤。按WHO 2018年GLOBOCAN统计,在世界范围内,PC发病率在男性所有恶性肿瘤中位居第二。我国PC发病率远低于欧美国家,但近年来呈现上升趋势,且增长比欧美发达国家更为迅速。据估计,在2015年我国PC新发病例有7.20万例,死亡病例约3.07万例。而到2022年,我国PC新发病例和死亡病例分别增长到13.42万例和4.75万例。PC的早期诊断和规范化治疗在我国依然任重道远。
PC在老年男性中发病率极高,50岁前该病发病率处于较低水平,随年龄增长发病率逐渐升高,80%的病例发生在65岁以上男性。我国PC患者的分期构成与西方发达国家存在巨大差别。以美国为例,在其确诊的新发PC中,接近91%为临床局限型PC,这些患者的一线治疗为根治性手术或根治性放疗,在接受标准治疗后预后较好,5年OS接近100%。而我国新发病例确诊时仅30%为临床局限型,余者均为局部晚期或转移患者,这些患者无法接受局部的根治性治疗,预后较差。
前列腺癌的筛查
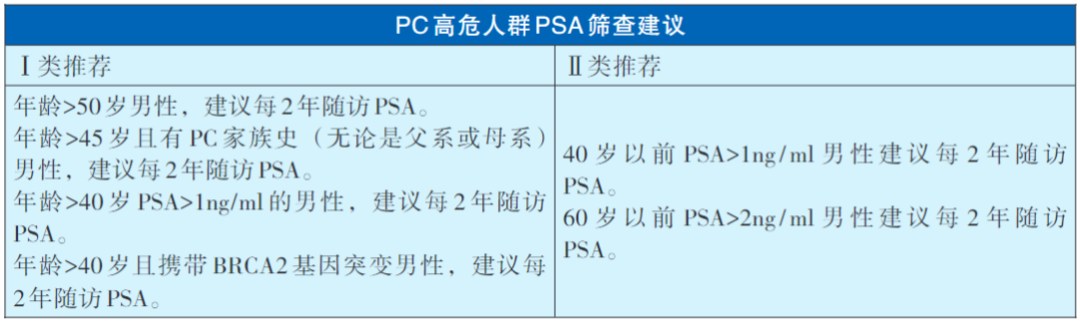
PC筛查的高危人群
PC筛查的高危对象主要包括:年龄>50岁的男性,年龄>45岁且有PC家族史的男性,40岁时的基线PSA>1ng/ml的男性以及年龄>40岁且携带BRCA2基因突变的男性。在此处仍需要强调,随着近年基因检测的普及以及人们对于遗传性PC的认知,相关恶性肿瘤家族史及已知的遗传突变(BRCA1/2等)愈发得到人们的重视。国内有学者指出,在中国患者人群中携带DNA损伤修复基因胚系突变的比例为9.8%,其中BRCA2占比达到6.3%。在这些基因中BRCA2、ATM、MSH2及PALB2胚系突变与PC发病风险显著相关。此外,对于40岁以前PSA>1ng/ml男性以及60岁以前PSA>2ng/m男性同样可考虑定期检查PSA。
PC筛查的主要手段
筛查的主要方法是定期的PSA检测。一般男性筛查期间建议每2年随访1次PSA检测,对于无危险因素的男性,PSA随访时间间隔可延长至8年。需要对患者详细阐明PC筛查的风险和获益之后才能开展PSA检测,检测前避免射精,避免尿道、膀胱及直肠内医源性操作。筛查前也应询问是否存在前列腺增生、前列腺炎等相关前列腺病史,若存在细菌性前列腺炎,宜先处理炎症再行前列腺PSA筛查。直肠指检也可用于PC筛查,其是目前大部分健康体检的常规项目,也是直肠癌的筛查项目之一,操作时注意兼顾前列腺。
前列腺穿刺活检
前列腺穿刺活检是确诊PC的关键手段,其准确性和有效性对于早期PC的诊断至关重要。经直肠前列腺超声(TRUS)在前列腺穿刺中有助于医生测定前列腺体积并进行穿刺活检的定位。TRUS引导下前列腺系统性穿刺活检(结合靶向穿刺)是目前诊断PC最可靠的检查方法。
前列腺穿刺活检的指征
前列腺穿刺活检的指征包括:DRE发现前列腺结节(任何PSA值)、MRI或TRUS等检查发现异常(任何PSA值)、PSA>4ng/ml。
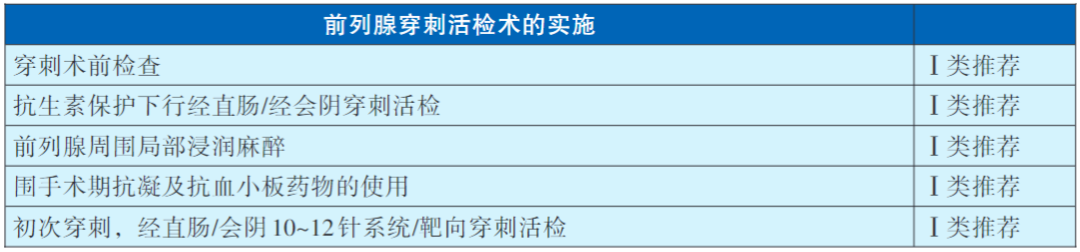
穿刺活检术的实施
TRUS引导的前列腺穿刺活检可分为经直肠穿刺和经会阴穿刺,两者各有优缺点。经直肠穿刺操作便捷,不需麻醉,但术后出血、感染等并发症发生率相对较高。经会阴穿刺则费时较长且需局部麻醉,但术后往往不易发生直肠出血和感染性并发症。在经直肠穿刺前,建议预防性口服或静脉应用抗生素,其中喹诺酮类药物为首选。经会阴穿刺活检推荐超声引导下的前列腺外周神经阻滞,而经直肠穿刺活检可行直肠内灌注局部麻醉。对有心脑血管病风险、支架植入病史,长期口服抗凝或抗血小板药物的患者,围术期要整合评估出血风险及心脑血管疾病风险,慎重决定相关药物使用。
目前建议基线活检时对前列腺体积较小者(小于30ml)至少行8点系统活检,当前列腺体积较大时建议行10~12点系统活检。再次活检时饱和穿刺活检(穿刺针数>20针)可提高PC检出率。
靶向穿刺
近期研究证实MRI引导下融合靶向穿刺活检能提高临床有意义PC检出率(提高12%),减少无意义低危PC检出率(减少13%),因此鼓励在初次穿刺活检前施行MRI检查以及MRI引导的靶向前列腺穿刺活检。MRI-TRUS融合靶向穿刺活检是前列腺穿刺活检新技术,是指将多参数MRI(mpMRI)与经直肠超声图像(TRUS)关联融合,针对可疑病灶靶向穿刺活检。MRI-TRUS融合靶向穿刺活检分为认知融合(cognitive fusion biopsy)、软件融合和MR直接引导穿刺三种类型。认知融合靶向穿刺活检是指事先进行mpMRI扫描,术者根据MRI图像寻找出可疑病灶或感兴趣区,然后在常规超声引导下对TRUS图像上对应的可疑病灶或感兴趣区域行穿刺活检。软件融合是指将事先进行的mpMRI扫描,并将MRI图像导入相关软件,勾画靶区和前列腺轮廓,匹配并锁定TRUS与MRI中的对应图像,使MRI提示的可疑靶区图像和前列腺图像能实时随超声探头的移动而变化,并行针对性穿刺。MRI直接引导穿刺活检需使用特定的穿刺针,并要在穿刺活检过程中多次进行实时MRI扫描来明确穿刺针与可疑病灶的位置信息。目前研究表明认知融合和软件融合靶向穿刺活检在穿刺阳性率上没有显著差别。但前者更需要有经验的穿刺者实施操作。在前列腺穿刺活检的实际操作中,可以采用靶向穿刺结合系统穿刺的方法以进一步提高穿刺活检准确率。
重复穿刺指征
初次穿刺阴性后,重复穿刺活检的指征包括:首次穿刺活检病理发现非典型性增生或高级别上皮内瘤变、复查PSA>10μg/L、复查PSA 4~10μg/L且fPSA、PSAD值、DRE或影像学表现异常,以及在特定条件下进行靶向穿刺或定期复查PSA。
前列腺癌的病理学评价
病理类型
根据最新的世界卫生组织(WHO)的组织学分类,前列腺原发性恶性肿瘤主要可以分为多种类型,常见的类型包括但不限于以下几种:
1.腺癌
这是前列腺恶性肿瘤中最常见的类型,占绝大多数(95%以上)。腺癌可进一步细分为多种亚型,如腺泡腺癌、导管腺癌等。其中,腺泡腺癌是PC的主要组成部分。
2.导管内癌(IDC-P)
这是一种特殊的PC类型,表现为肿瘤细胞在天然导管和腺泡内的膨胀性增殖,主要为实性或致密筛状生长,累及超过50%的管腔。IDC-P在局限性、局部晚期、转移性PC以及激素抵抗性PC中均有所发现,且随着病情的进展有逐渐增加的趋势。
3.神经内分泌肿瘤
前列腺神经内分泌肿瘤包括高分化神经内分泌肿瘤、小细胞神经内分泌癌、大细胞神经内分泌癌和混合性神经内分泌癌等亚型。其中,小细胞未分化癌是一种较早出现转移和播散的类型,对化疗相对敏感
4.其他罕见类型
如横纹肌肉瘤、平滑肌肉瘤、恶性神经鞘(膜)瘤、恶性间质瘤等,这些类型在前列腺恶性肿瘤中较为罕见。
PC神经内分泌分化和治疗相关性前列腺神经内分泌癌
在治疗的过程中,部分PC会发生神经内分泌分化,表现出类似于神经内分泌细胞的特征,更具侵袭性和难治性。这种转化可能与基因突变导致的致癌通路激活有关,例如某些转录因子的激活或肿瘤抑制基因的失活。需要注意的是,神经内分泌分化和治疗相关性前列腺神经内分泌癌仍有一定区别,需要通过病理活检进行最终的病理诊断加以区分。
PC向神经内分泌癌的转变继而形成治疗相关性前列腺神经内分泌癌是PC进展的一种重要形式,尤其在去势抵抗性PC中更为常见。近年来,科学界对PC向神经内分泌癌转变的机制进行了深入研究。例如,中国科学院分子细胞科学卓越创新中心的研究团队发现,转录因子FOXA2在调控前列腺腺癌向神经内分泌癌谱系转变过程中发挥关键作用。他们进一步揭示了FOXA2通过直接调控KIT信号通路,在神经内分泌PC中特异性激活该通路,从而促进了肿瘤的进展。治疗相关性前列腺神经内分泌癌通常对传统的内分泌治疗不敏感,且预后较差。因此,开发针对这种转变过程的新型治疗策略具有重要意义。
总的来说,PC神经内分泌分化及其向神经内分泌癌的转变是PC研究中的热点和难点问题。随着科学研究的不断深入,相信未来我们将能够更好地理解这些转变的机制,并开发出更加有效的治疗策略来应对这一挑战。
Gleason评分系统
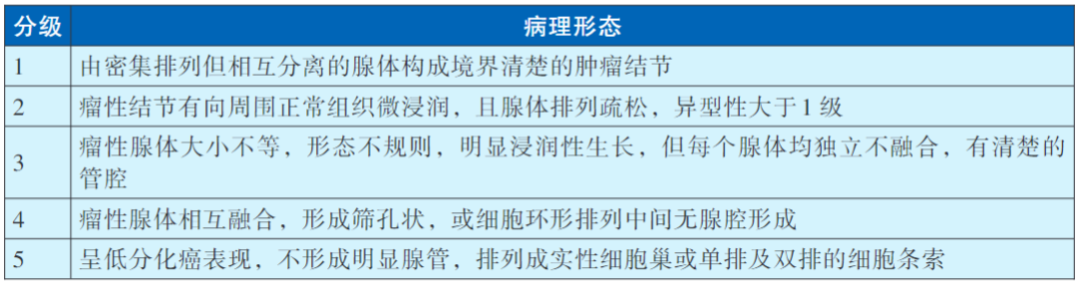
前列腺腺癌的预后评估中,分化程度是一个至关重要的指标,它直接关系到肿瘤的发展速度、侵袭性以及患者可能的生存期。为了更精确地量化这一分化程度,目前广泛采用Gleason评分系统作为前列腺腺癌的病理分级标准。该系统通过低中倍显微镜对肿瘤腺体的组织结构进行细致评估,从而实现对肿瘤分化水平的客观衡量。值得注意的是,细胞核改变等需在高倍镜下观察的表现并不纳入Gleason评分体系之中,确保了评分的专注性和准确性。
在具体操作上,前列腺腺癌组织被明确划分为主要分级区和次要分级区两大部分。每一区域均按照5级评分制度进行独立评估,各级别反映了肿瘤组织结构的不同变化程度和分化状态。随后,将这两个区域各自的Gleason分值进行相加,所得总和即为该癌组织的最终分级常数,直观体现了肿瘤的总体分化水平。
Gleason评分具体评价方法:
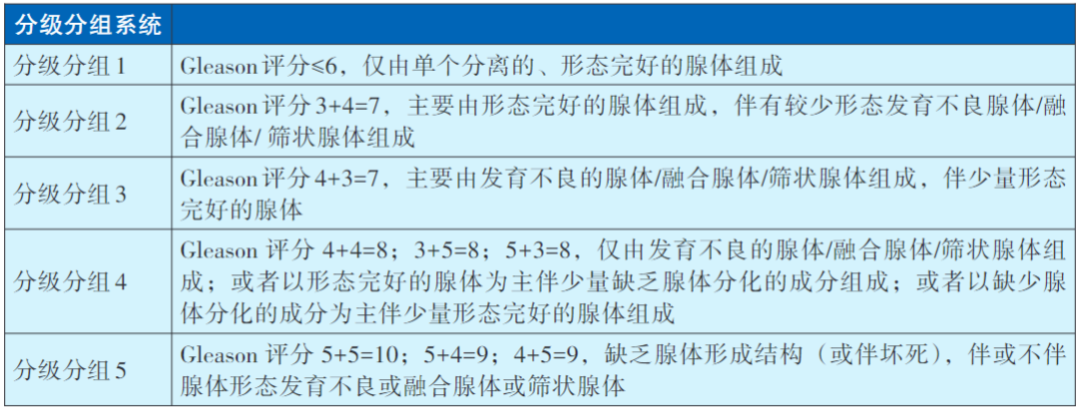
PC分级分组(Grading Groups)系统
2014和2019年国际泌尿病理协会(ISUP)提出一种新的分级系统,称为PC分级分组系统,根据Gleason总评分和疾病危险度将PC分为5个不同组别,用于评估PC患者的预后情况。该分级系统基于Gleason评分系统,通过病理组织的组织学特征对PC进行分级,具有重要的临床意义。
ISUP分级与Gleason评分的对应关系:ISUP分级是根据Gleason评分的总分、主要评分和次要评分来进行分组的。具体来说,Gleason评分≦6对应ISUP 1级;3+4对应ISUP 2级;4+3对应ISUP 3级;4+4、3+5、5+3均对应ISUP 4级;而Gleason评分为9~10则对应ISUP 5级。
PCISUP具有预后和指导治疗决策的意义。ISUP分级越高,代表PC的恶性程度越高,患者的预后一般越差。因此,ISUP分级为医生提供了评估患者预后情况的重要依据,有助于制定更加个性化的治疗方案。此外,不同ISUP分级的PC患者在治疗上存在差异。例如,对于ISUP 1级和2级的患者,由于其恶性程度相对较低,可能更倾向于选择保守治疗或局部治疗;而对于ISUP 3级及以上的患者,由于其恶性程度较高,可能需要更积极的治疗措施,如根治性前列腺切除术、放疗或内分泌治疗等。
ISUP评分具体评价方法:
2024 CSCO前列腺癌诊疗指南
前列腺癌的病理学诊断
Gleason评分系统

前列腺癌的病理分级推荐使用Gleason评分系统。该评分系统把前列腺癌组织分为主要分级区和次要分级区,每区按5级评分,主要分级区和次要分级区的Gleason分级值相加得到总评分即为其分化程度。
前列腺癌分级分组(Grading Groups)系统

a、2014年国际泌尿病理协会(ISUP)共识会议上提出的一种新的分级系统,称为前列腺癌分级分组系统,根据Gleason总评分和疾病危险度将前列腺癌分为5个不同的组别(ISUP 1~5级)。在前列腺癌活检病理报告中,应明确标示前列腺癌的类型和亚型,以及是否存在筛状结构。
b、由更少量发育不良的腺体/融合腺体/筛状腺体组成。
c、对于大于95%发育不良的腺体/融合腺体/筛状腺体,或活检针或RP标本缺乏腺体形成结构,发育良好的腺体组成小于5%不作为分级的因素考虑。
前列腺癌基因检测和液体活检
随着第二代测序(next-generation sequencing,NGS)技术在前列腺癌等肿瘤诊疗中得到越来越广泛的应用,NGS的检测内容、检测技术,优化患者的个体化诊疗方案,并为建立以生物标志物为引导的临床治疗路径提供了更多依据。不同病情和治疗阶段的前列腺癌患者的基因突变特征各异,基于前列腺癌临床实践以及药物研发现状,推荐基于提供遗传咨询和制订治疗决策为目的的基因突变检测。具体参见《中国前列腺癌患者基因检测专家共识(2020版)》。
制订治疗决策

a、推荐转移性前列腺癌患者进行肿瘤样本基因检测,局限期前列腺癌患者可以考虑基因检测。国内研究表明50.0%的局部晚期/转移性IDC-P前列腺癌患者存在致病性体系突变,包括BRCA2、ATM、CDK12、CHEK2和PALB2等基因。
b、Ⅲ期临床研究PROfound证实具有同源重组修复基因突变的患者,能够从奥拉帕利单药治疗中获益。在转移性去势抵抗性前列腺癌患者中,同源重组修复基因突变发生频率为27.9%。PROfound研究中纳入的基因突变类型包括ATM,BRCA1,BRCA2,BARD1,BRIP1,CDK12,CHEK1,CHEK2,FANCL,PALB2,RAD51B,RAD51C,RAD51D,RAD54L。
c、导致DNA修复缺陷的相关基因的胚系变异和体细胞变异,均是铂类药物和PARP抑制剂的增敏性潜在生物标志物,如错配修复基因MSH2、MSH6、PMS2、MHL1、MRE11A,其他DNA修复基因如ATR、NBN、RAD51、FAM175A、EPCAM、HDAC2等。
d、其他对于前列腺癌治疗选择及预后有指导意义基因,如AR-V7、TP53、RB1、PTEN等。对于既往接受一线醋酸阿比特龙或恩扎卢胺治疗并进展的mCRPC患者在准备进行二线治疗前行AR-V7的检测,可以用于帮助指导后续治疗方案的选择。接受二线及以上治疗的AR-V7阳性mCRPC患者可能从紫杉类化疗中获益。TP53基因突变是前列腺癌中的常见突变,在中国激素敏感前列腺癌中突变比例是22.3%,同时常合并其他基因突变;TP53是重要的患者预后相关的生物标志物,突变提示患者对阿比特龙或恩扎卢胺治疗不敏感。IPATENTIAL150研究显示,免疫组化法提示PTEN蛋白缺失的mCRPC患者可以从AKT抑制剂治疗中获益。RB1是前列腺癌患者预后重要的分子标志物,RB1缺失与去势抵抗及神经内分泌化相关。
e、胚系指仅需对受试者血液(白细胞或正常口腔黏膜上皮)等样本进行受检范围的基因变异检测;肿瘤+胚系是指需要对肿瘤样本(组织或ctDNA)进行检测,同时还需要对血液样本(白细胞或正常口腔黏膜上皮)进行胚系基因变异检测。
f、转移性去势抵抗前列腺癌(mCRPC)肿瘤组织和血浆ctDNA样本检测一致性80%以上。PROfound研究及TRITON2/3研究回顾性分析表明mCRPC患者组织和血浆配对样本的检测一致性为82%~91%。两项针对中国mCRPC患者的分析也表明组织和血浆配对样本检测的阳性一致性为90%左右。mCRPC患者在组织不可及或组织样本检测失败时,可采用血浆ctDNA样本检测。mHSPC阶段患者建议进行组织样本检测。
g、循环肿瘤细胞(circulating tumor cell,CTC)是指自发或因诊疗操作由原发灶或转移灶脱落进入外周血液循环的肿瘤细胞。90%癌症相关死亡都是由于远端转移引起,而肿瘤细胞向外周血扩散(血行转移)是疾病进展的重要环节,是发生远端转移的前提。一项国内研究表明,针对PSA 4-10ng/ml灰区患者,相较于单独血清PSA检测,基于蒸发诱导还原氧化石墨烯(rGO)涂层的循环肿瘤细胞(CTC)芯片联合血清PSA检测,可以将前列腺癌诊断敏感性从58.3%提升至91.7%。
提供遗传咨询
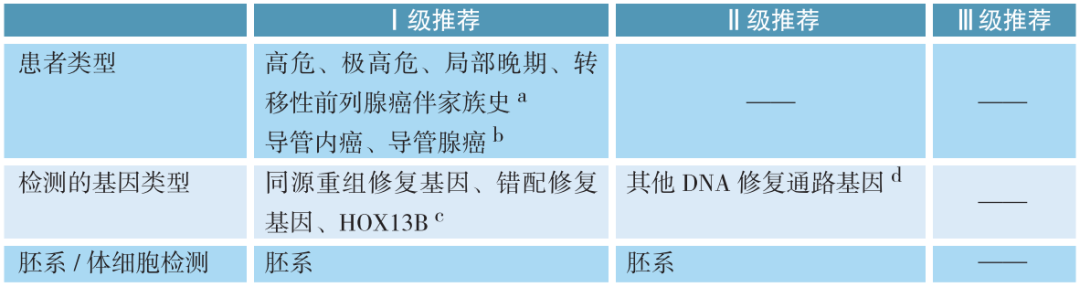
a、该处家族史是指在同系家属中具有多名包括胆管癌、乳腺癌、胰腺癌、前列腺癌、卵巢癌、结直肠癌、子宫内膜癌、胃癌、肾癌、黑色素瘤、小肠癌以及尿路上皮癌患者,特别是其确诊年龄≤50岁;已知家族成员携带上述基因致病突变。尽管东西方人群前列腺癌风险差距较大,但在中国患者中可观察到与西方患者相似的胚系DNA修复基因突变频率,中国人群中转移性、局限性、高危局限性疾病患者的DDR突变分别为12%、10%和8.1%。单核苷酸多态性与前列腺癌发病风险相关,全基因组研究显示东亚与欧洲人群存在较大差异。
b、相关证据提示前列腺导管内癌和导管腺癌与遗传突变风险的升高相关。
c、同源重组修复基因如BRCA2、BRCA1、ATM、PALB2、CHEK2等,错配修复基因如MLH1、
MSH2、MSH6、PMS2等以及HOX13B,这些基因的突变显著增加前列腺癌的发病风险。其中,BRCA2基因胚系变异携带者前列腺癌患病风险比为2.5~4.6,55岁以前发病风险比为8~23;BRCA1胚系变异携带者65岁及以上患前列腺癌风险比为1.8~3.8;ATM胚系变异携带者转移性前列腺癌患病风险比为6.3,MSH2胚系变异携带者前列腺癌的患病风险比为15.8,PALB2胚系变异携带者的前列腺癌患病风险比为5.1,CHEK2胚系变异携带者患前列腺癌风险比为3.3;错配修复基因突变会导致林奇综合征,前列腺癌患病风险比为3.7,其中MSH2突变携带者比其他基因突变携带者更易发生前列腺癌;HOX13B突变携带者前列腺癌发病风险为3.4~7.9。
d、其他DNA修复基因如CDK12、RAD51D、ATR、NBN、MRE11A、RAD51C、BRIP1、FAM175A、EPCAM等,这些基因胚系变异导致前列腺癌发生风险提升。
参考文献及书籍:
1.《2025 中国肿瘤整合诊治指南(CACA)——前列腺癌》
2.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)前列腺癌诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.


