TRPV3在皮肤病理生理中的作用及其作为治疗靶点的潜力
时间:2025-03-11 12:11:48 热度:37.1℃ 作者:网络
瞬时受体电位香草酸受体3(transient receptor potential vanilloid-3,TRPV3)是一种Ca2+非选择性阳离子通道,广泛表达于皮肤角质形成细胞和外周神经元中,对感觉感知和皮肤稳态的维持具有重要作用。并与多种皮肤疾病的发生和发展密切相关,包括皮肤屏障的形成、毛发的生长、伤口愈合以及皮肤疼痛和瘙痒的产生等。
概述
TRPV3对温度、化学刺激和机械刺激具有敏感性,能够调节细胞内钙离子浓度,从而参与细胞信号传导和功能调控。TRPV3在皮肤中高表达,尤其是角质形成细胞、毛囊周围的细胞和外周神经元细胞,而且在鼻粘膜、胃肠道、大脑等组织器官也有表达。
TRPV3主要与皮肤的感觉有关,包括温度感觉、疼痛感觉和瘙痒等,该通道还参与维持健康皮肤屏障以及伤口愈合,头发生长和胚胎发育等。近年来,TRPV3在皮肤疾病中的作用引起了广泛关注,研究发现其在炎症、瘙痒、皮肤屏障功能障碍等病理状态中具有重要作用,并且TRPV3的异常表达或功能失调与多种皮肤疾病的发生和发展密切相关。
TRPV3基本结构及对皮肤生理中的作用
TRPV3的基本结构及通道特性
TRPV3是人类瞬时受体电位离子通道(transient receptor potential,TRP)家族中香草酸蛋白(TRPV)家族的一员,是非选择性阳离子通道,包括TRPV1-6的6个同源阳离子通道。TRPV蛋白家族中TRPV1是哺乳动物TRPV通道的创始成员,研究最为深入。大量研究已揭示了TRPV1在瘙痒、疼痛、炎症和伤口愈合中的作用。最近TRPV3因其与TRPV1相似的作用而受到越来越多的关注。TRPV3是一个由四个亚基组成,每个亚基N端的锚定重复结构域包含六个跨膜螺旋(S1-S6),其中S5和S6之间的区域形成了离子选择性过滤器,通过这个区域钙离子和其他阳离子可以进入细胞内,作为同源四聚体,与TRPV1有 43%的序列相似性。
TRPV3的结构特性及其在病理学中的功能,主要体现在其作为非选择性阳离子通道的独特构造与功能特征上。TRPV3基因位于人类第17号染色体的p13区域,邻近于TRPV1基因,编码790个氨基酸的TRPV3蛋白,通道的激活涉及特定氨基酸残基的构象变化,这一变化不仅影响离子的通过率,还可能调节通道的开放状态。TRPV3通道能够被温度(超过33℃)及多种植物香味物质激活,介导钙、钠、钾、铯和铵离子的转运,其中对钙离子的通透性显著高于其他阳离子。
TRPV3在皮肤生理中的作用
TRPV3在皮肤生理中发挥重要作用,它参与温度感知、痛觉传导、皮肤屏障功能、伤口的愈合、毛发生长及炎症反应等。TRPV3在多种组织中表达,包括皮肤、大脑、脊髓、背根神经节和睾丸,尤其在皮肤的角质形成细胞和毛囊外根鞘中显著表达。环境温度的升高,激活TRPV3的开放,导致离子通量增加,从而触发神经信号传递,引起热感受。研究发现,TRPV3通过调节生长因子信号传导,影响角质细胞的增殖和分化,来维持正常的皮肤屏障。而且TRPV3的激活可以导致神经末梢释放神经递质,从而影响神经信号的传递和感知,并调节疼痛的感知。最近越来越多的研究关注于TRPV3在皮肤再生和修复机制中的作用。
TRPV3在皮肤病理中的作用
TRPV3在温度感知与痛觉中的作用
TRPV3是一种热敏感的离子通道,能够在31℃至39℃的温度范围内有效激活,从而参与温度感知的复杂机制。尽管TRPV3在温觉中的作用仍有争议,但研究表明,TRPV3在温暖温度感知中发挥一定作用。TRPV3在皮肤角质形成细胞中的表达通过三磷酸腺苷(ATP)信号传递机制,激活嘌呤能受体(P2X3/P2X4)通道,将温度信息传递给感觉神经元来感知环境温度。在研究中发现,缺乏P2X3的小鼠中能观察到异常温度依赖性行为,而感觉神经元缺乏P2X4的小鼠也会表现出热敏感性降低的表现。
此外,前列腺素E2(PGE2)和一氧化氮(NO)等物质的释放也可能通过激活TRPV3间接调控温觉行为。NO是一种重要的信号分子,可以影响神经元的兴奋性和热感觉,特别是通过其与TRP通道的相互作用。PGE2和NO在炎症刺激下释放,进一步调节TRPV3通道的活性,影响热感觉行为。例如,在炎症反应中PGE2和NO大量释放,从而使TRPV3增敏,从而增强对热刺激的敏感性。TRPV3过度激活可能导致慢性疼痛和炎症反应的加剧,这为我们提供了理解疼痛机制的新视角。TRPV3功能突变的疾病中,其过度激活导致疼痛性足底角化病,暗示其参与疼痛感知。
一项研究发现,功能获得突变(G573S)的TRPV3基因小鼠在冷刺激和机械性疼痛感知上明显减弱,但对热 刺激和机械性瘙痒反应无显著变化。这些发现揭示了TRPV3在不同类型感觉传导中的特异性作用,在温度感知和痛觉传导中的复杂角色提供了重要的科学依据。我们在未来的研究中继续探索TRPV3及其相关通道在疼痛感知和温度调节中的作用,以寻找更有效的治疗策略。
TRPV3与皮肤炎症反应
TRPV3在皮肤炎症反应中扮演着至关重要的角色。TRPV3的激活能够通过增加细胞内钙离子浓度,诱导炎症介质的释放,如肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)和白介素-8(IL-8)等,从而加剧皮肤炎症的程度,相反选择性的敲低TRPV3则能够有效的抵消这些细胞因子的上调和释放。
特应性皮炎(Atopic Dermatitis,AD)患者的皮肤角质形成细胞中TRPV3的表达水平显著增加,尤其在非病变区域,这表明TRPV3在AD早期病理中发挥重要作用。TRPV3的激活促进炎症介质释放,进一步破坏皮肤屏障,加重AD症状。研究发现,通过香芹酚(carvacrol)和2-氨基乙氧基二苯基硼酸盐(2-Aminoethoxydiphenyl borate,2-APB)等激活剂激活TRPV3通道对细胞的活性、增殖及炎症反应产生了显著影响。TRPV3的激活促炎细胞因子的产生,从而加剧炎症反应。研究发现,白细胞介素-31(IL-31)是AD发病机制中的关键细胞因子,主要由辅助性T细胞2(Th2)产生。
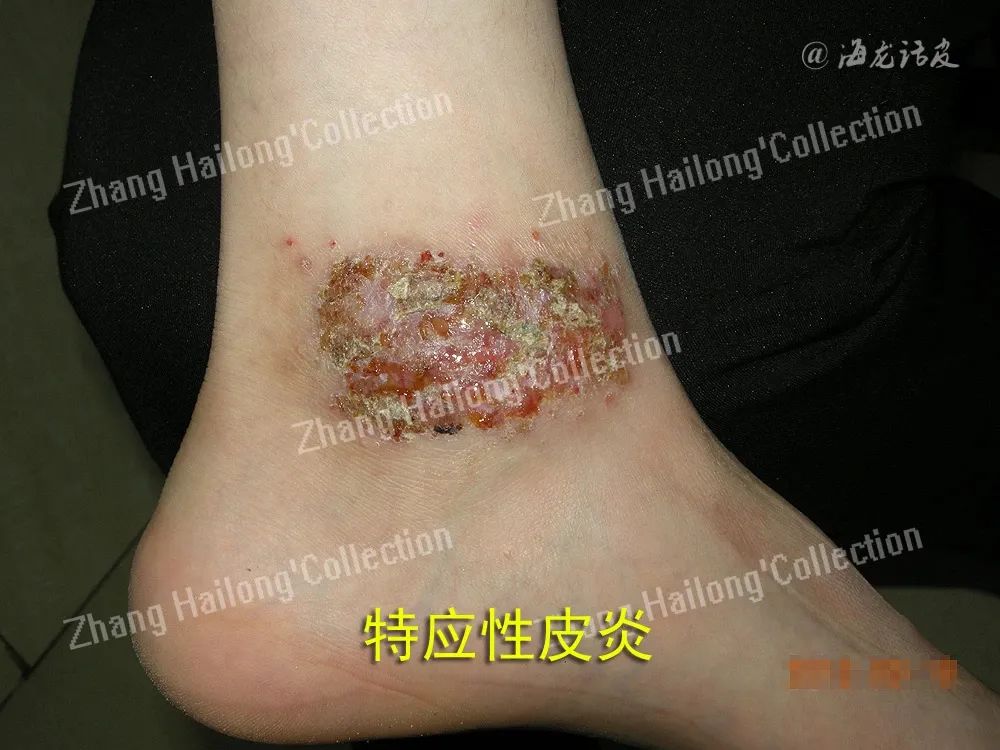
此外,IL-31可以刺激IgE的产生,而IgE在包括AD在内的过敏性疾病的发病机制中起着至关重要的作用。IgE水平升高与过敏致敏性增加有关,并可导致炎症细胞进一步向皮肤募集,使炎症循环持续。TRPV3、IL-31和IgE之间的相互作用突出了调节皮肤炎症的信号通路的复杂网络。
例如,TRPV3激活可导致细胞内钙水平升高,而增强角质形成细胞和其他免疫细胞分泌IL-31。这反过来又可以促进B细胞产生IgE,进一步促成过敏性炎症环境。近期的研究发现,TRPV3的抑制剂如α-芒果苷和蛇床子素(osthole),能够有效减少由TRPV3介导的细胞炎症因子的释放,从而缓解皮肤炎症。α-芒果苷不仅抑制了TRPV3通道的活性,还显著降低了角质形成细胞中TNF-α和IL-6的分泌,这为皮肤炎症的治疗提供了新的思路。这些研究结果阐明了TRPV3在皮肤炎症过程中的关键作用,并为开发针对TRPV3的抗炎治疗策略提供了重要的分子机制基础。
TRPV3在皮肤瘙痒中的作用
瘙痒是一种常见的皮肤感觉,与皮肤屏障受损和炎症有关。严重的瘙痒是多种皮肤和系统性疾病(如AD和过敏性皮肤病)的关键症状,显著影响患者的生活质量。瘙痒通过组胺能(急性)和非组胺能(慢性)途径传递。组胺能途径依赖于肥大细胞、嗜碱细胞和角质形成细胞释放组胺,而非组胺能途径则由各种免疫细胞和神经元释放的瘙痒原激活。角质形成细胞在这两条途径中发挥作用,并维持表皮屏障以抵御瘙痒原和炎症。
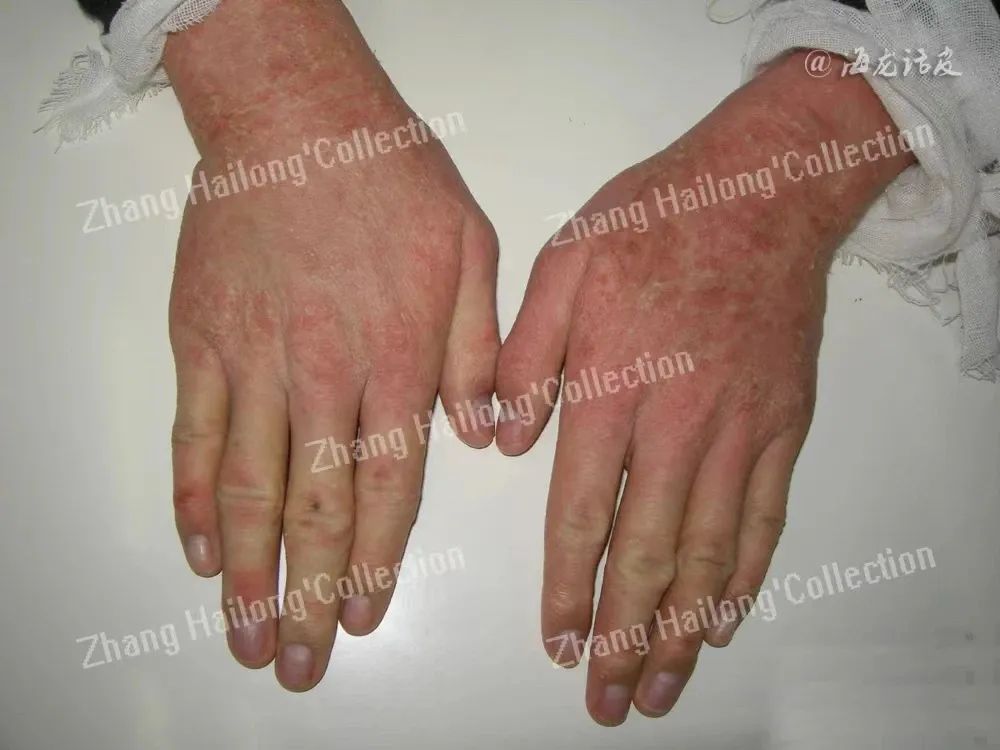
TRPV3基因突变可导致皮炎和抓痒,这与热敏感性增强和热诱导瘙痒原释放有关。研究报道,白介素31(IL-31)促进B型利尿肽(BNP)合成,诱导TRPV3激活并促进瘙痒传递。BNP诱导的TRPV3 激活丝氨酸蛋白酶抑制剂E1(Serpin E1),而且在AD病变皮肤中Serpin E1上调。研究发现,局部注射Serpin E1可引发小鼠瘙痒行为,而Serpin E1抑制剂可有效地减轻慢性瘙痒小鼠的抓挠。Serpin E1与多种炎症性疾病有关,在皮炎的情况下可调节细胞外基质重塑和炎症反应,参与调节免疫反应和组织修复作用。
综上所述,Serpin E1作为特异性皮炎的生物标志物是今后临床治疗靶点。此外,在烧伤瘢痕的患者中87%的患者伴有瘙痒症状,而这些伴有瘙痒的烧伤瘢痕表皮中检测到TRPV3表达明显增强。另一项研究表明,在烧伤瘢痕上使用激活剂(如carvacrol,2-APB等)可以引发明显的瘙痒。TRPV3在瘙痒信号转导中作用不可或缺,其激活导致强烈瘙痒,抑制活性可减轻症状,为临床治疗提供新途径。
TRPV3与毛发生长
大量证据表明,TRPV3在毛囊外根鞘细胞中的表达水平显著,参与自然毛发的发育和毛发生长周期的调节。TRPV3基因缺失或过度激活均会损害毛发的发育。前者导致毛发不规则和毛囊角化囊肿,后者则导致无毛表型,适当激活的TRPV3对维持毛发形态至关重要。植物衍生物质(如丁香酚、百里香酚和香芹酚等)可激活TRPV3,导致毛囊外根鞘细胞的凋亡,显著抑制了毛干伸长。TRPV3的激活还会促进毛囊的早期退化,而特定的TRPV3抑制剂能够逆转激动剂引起的细胞死亡,并促进毛发生长的恢复。

TRPV3功能障碍与人类的先天性奥姆斯特综合征(Olmsted syndrome)相关,它以严重的皮肤病变和脱发为特征。TRPV3的功能亢进突变是导致 Olmsted syndrome的主要原因之一,已有研究 表明TRPV3基因的错义突变(p.Gly568Val),导致TRPV3选择性过滤器的结构变化,使得通道的通透性增加,从而引发皮肤的病理变化。
此外,TRPV3通过调节表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)信号通路参与毛发的形态发生,TGF-α/EGFR信号轴对毛囊和毛干发育至关重要。TRPV3基因敲除小鼠具有间距胡须和波浪状毛发的表型,这与TGF-α和EGFR基因突变丧失功能的小鼠表型非常接近。因此,TRPV3不仅在正常毛发生长中发挥着重要作用,还可能成为治疗脱发及其他相关皮肤疾病的新靶点。
TRPV3在皮肤干燥与屏障功能中的影响
TRPV3在皮肤干燥及其屏障功能中的作用是备受关注的研究领域。TRPV3主要在角质形成细胞中表达,这些细胞是皮肤屏障的核心组成部分。研究表明,TRPV3通过调节角质形成细胞的增殖、分化及迁移,显著影响皮肤屏障的形成与维持。此外,TRPV3在皮肤屏障的修复过程中同样发挥重要作用,尤其是在皮肤受到紫外线(UVB)辐射损伤时, 抑制TRPV3的活性而减轻皮肤的炎症及损伤。这些研究结果表明,TRPV3在皮肤屏障功能的维持与修复中具有重要意义,其调控可能成为治疗皮肤屏障功能障碍的潜在靶点。
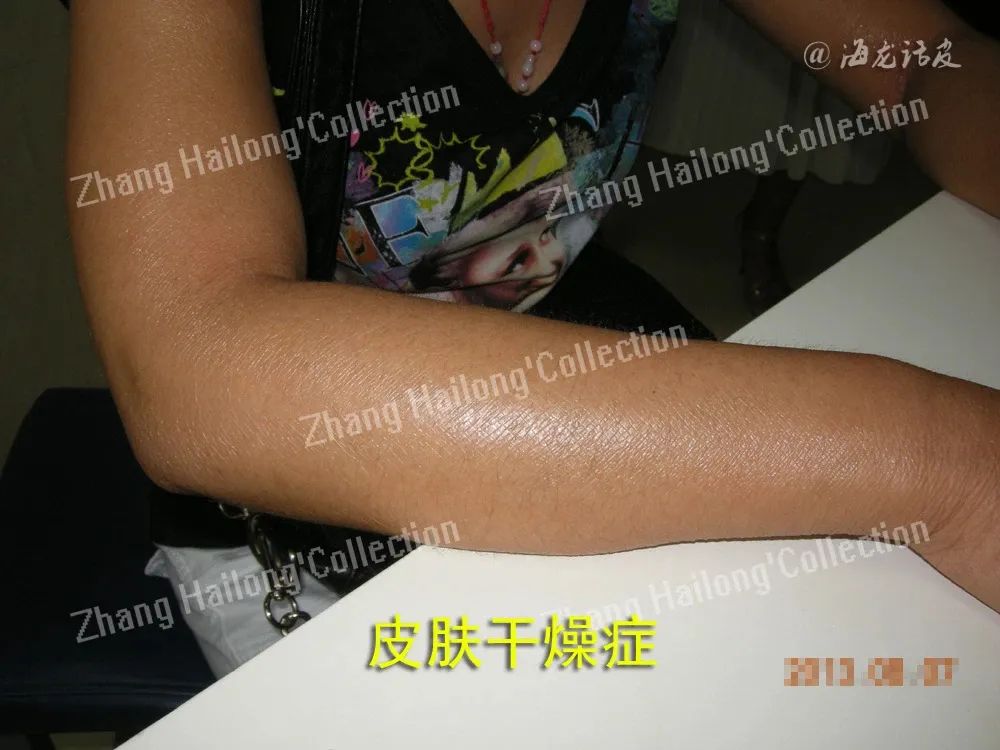
皮肤干燥症(Xerosis)是一种常见的皮肤病,表现为干燥、粗糙和瘙痒。研究表明,TRPV3在该病中的表达和功能显著变化,过度激活与皮肤干燥症密切相关。尤其在老年皮肤中,TRPV3的表达和活性降低,影响温度感知和局部血管热调节。此外,TRPV3的异常表达与角质形成细胞功能障碍有关,调节TRPV3活性可能改善皮肤干燥症症状,恢复皮肤屏障和水合作用。因此,TRPV3在皮肤干燥症的治疗中提供了新的思路。
TRPV3与伤口愈合及皮肤纤维化
目前TRPV3的研究主要集中在瘙痒、热痛和毛发生长中的作用,但越来越多的证据显示其在皮肤再生中的重要性。TRPV3通过EGFR信号通路促进表皮再生,以激活EGFR促进细胞增殖和迁移。TRPV3激活促进了EGFR磷酸化水平,二者相互作用于皮肤再生。TRPV3与TGF-α/EGFR之间形成正反馈回路,导致TRPV3激活和Ca2+流入,进一步诱导EGFR磷酸化和TGF-α释放。PI3K/AKT通路是TRPV3诱导EGFR激活的下游信号,促进细胞增殖。
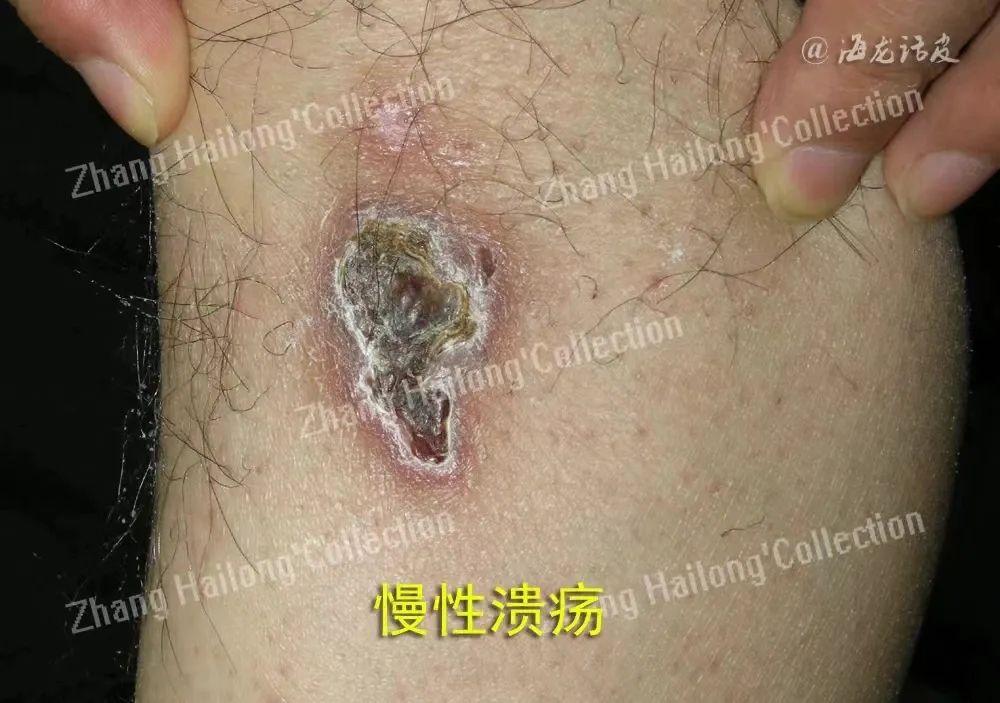
此外,TRPV3可能通过调节NO合成加速皮肤再生,NO在伤口愈合中发挥积极作用,促进细胞增殖和分化。TRPV3激活可独立诱导NO产生,成为皮肤再生的新治疗靶点。TRPV3作为皮肤再生的新治疗靶点具有多种优势,尤其在伤口愈合中表现突出。适当激活TRPV3可促进角质形成细胞的增殖、分化和迁移,抑制细胞凋亡,加速再上皮化。同时,TRPV3参与真皮细胞外基质的沉积,改善受损皮肤的完整性。
研究显示,TRPV3通道的激活与皮肤纤维化密切相关,尤其在伤口愈合中,纤维母细胞的活化和胶原蛋白生成是关键环节。TRPV3通过促进TSLP通路和Smad2/3信号通路,增强初级皮肤纤维母细胞中的胶原蛋白生成,涉及细胞内钙离子的流入,激活活化T细胞核内因子(Nuclear Factors of Activated T cells,NFAT)和磷酸化的Smad2/3,调控细胞外基质合成。
此外,TRPV3还通过促进血管生成和重塑改善伤口愈合,显示其在调节瘢痕形成方面的潜力。TRPV3在皮肤创伤愈合中既促进胶原合成,又可能导致病理性纤维化。因此,针对TRPV3通道的调控可能为治疗与伤口愈合相关的皮肤纤维化提供新的策略。综上所述,TRPV3在皮肤愈合与纤维化中的作用值得进一步研究,以揭示其潜在的治疗靶点和机制。
TRPV3作为皮肤疾病的潜在治疗靶点
近年来,TRPV3在皮肤疾病治疗中的潜力逐渐被发掘,尤其在AD和慢性瘙痒中作用显著,因此针对TRPV3的药物开发成为研究热点。多种天然和合成化合物能有效抑制TRPV3活性,缓解瘙痒症状。例如,连翘酯苷B(Forsythoside B)选择性抑制TRPV3,显著减少瘙痒反应;黄芩素减轻特应性皮炎小鼠模型中的皮肤炎症和瘙痒;异氯原酸异构体也能选择性抑制TRPV3,缓解皮炎和慢性瘙痒。此外,植物来源的化合物和局部麻醉剂如达克罗宁(Dyclonine)、利多卡因(Lidocaine)等药物在药理相关浓度下对TRPV3表现出抑制作用。TRPV3激动剂carvacrol在小鼠中抑制毛发生长,而抑制剂则能逆转这一效应。
尽管目前针对TRPV3的药物开发取得了一定进展,但仍有许多问题需要进一步研究。比如TRPV3在多个组织中表达,长期使用TRPV3激动剂或抑制剂可能会影响皮肤屏障功能和其他正常生理功能。TRPV3在不同皮肤疾病中的具体作用机制尚不完全清楚,因此需要更多的基础研究来揭示其在皮肤病理过程中的功能机制。通过提高其特异性和亲和力,减少潜在的副作用,并进一步研究有效的药物递送系统,以确保药物能够到达目标细胞并发挥靶向治疗的作用。
总结
TRPV3在皮肤疾病中发挥重要作用,参与温度和痛觉感知,并调控多种信号传导路径。这为理解皮肤疾病机制提供新视角。尽管研究显示TRPV3在各种皮肤疾病中的重要性,但其作为治疗靶点仍面临挑战,药物开发及用药方法需进一步验证,且其在不同病理状态中的机制和副作用需深入研究。总体而言,TRPV3的研究拓展了对皮肤病理机制的理解,并为新型治疗策略提供支持,未来的研究应更加注重TRPV3的具体作用机制及其在不同疾病状态下的表现,从而在临床上实现更为精准和有效的治疗。
参考文献:
1.金晶玉,周彦宏,王双庆,金哲虎.TRPV3在皮肤病理生理中的作用及其作为治疗靶点的潜力[J/OL].中国皮肤性病学杂志.1001-7089.202409132.
2.Wang YJ, Tan LX, Jiao KJ, et al.Scutellarein attenuates atopic dermatitis by selectively inhibiting transient receptor potential vanilloid 3 channels[J]. Br J Pharmacol, 2022, 179(20): 4792-4808.
3.Liu Q, Wang J, Wei X, et al. Therapeutic inhibition of keratinocyte TRPV3 sensory channel by local anesthetic dyclonine[J]. Elife, 2021, 10: e68128. 4.Neuberger A, Nadezhdin KD, Sobolevsky AI. Structural mechanism of TRPV3 channel inhibition by the anesthetic dyclonine[J]. Nat Commun, 2022, 13(1): 2795.
5.其他文献(略)。


