靶向PD-1/PD-L1小分子药物:改写肿瘤免疫治疗格局的新希望
时间:2025-03-30 12:08:55 热度:37.1℃ 作者:网络
-01-
引言
自2014年首个PD-1单抗Opdivo获批以来,PD-1/PD-L1抗体药物已成为肿瘤治疗的里程碑。然而,抗体药物存在价格高昂(年均治疗费用超1.4万美元)、免疫相关不良反应(如疲劳、皮疹、器官炎症等)、给药方式受限(需静脉注射)等痛点。在此背景下,靶向PD-1/PD-L1的小分子抑制剂凭借其独特的药理学优势,正成为科研与产业界竞逐的新蓝海。
-02-
一、靶向PD-1/PD-L1小分子的设计
PD-1/PD-L1受体-配体相互作用是蛋白质-蛋白质相互作用(PPI)的经典例子;因此,为这些相互作用设计抑制剂是极具挑战性的。这主要是因为(a)相互作用的大范围接触面积(1500–3000Å),(b)存在平坦的界面,没有深而明确的结合口袋,适合以高亲和力结合配体,(c)缺乏内源性小分子配体作为参考标准。
在分析PD-1:PD-L1和PD-1:PD-L2复合物的晶体结构的进展方面,人们发现了几个潜在热点区域。基于PD-1:PD-L1晶体结构在PD-L1上鉴定的三个主要热区包括(1)由Tyr56、Glu58、Arg113、Met115和Tyr123的侧链组成的疏水口袋;(2) 由Met115、Ala121和Tyr123组成的疏水位点附近的第二口袋;和(3)由Asp122、Tyr123、Lys124和Arg125的主链和侧链组成的延伸槽。这些区域被认为是使用常规小分子结合PD-L1的理想区域。
目前,主要有两类不同的靶向PD-L1的小分子抑制剂,即(a)基于联苯支架的化合物;以及(b)在功能测定中鉴定的模仿受体-配体界面的氨基酸启发的小分子。
联苯衍生物
BMS的科学家基于PD-1:PD-L1相互作用的机制,开发了一系列联苯衍生物。
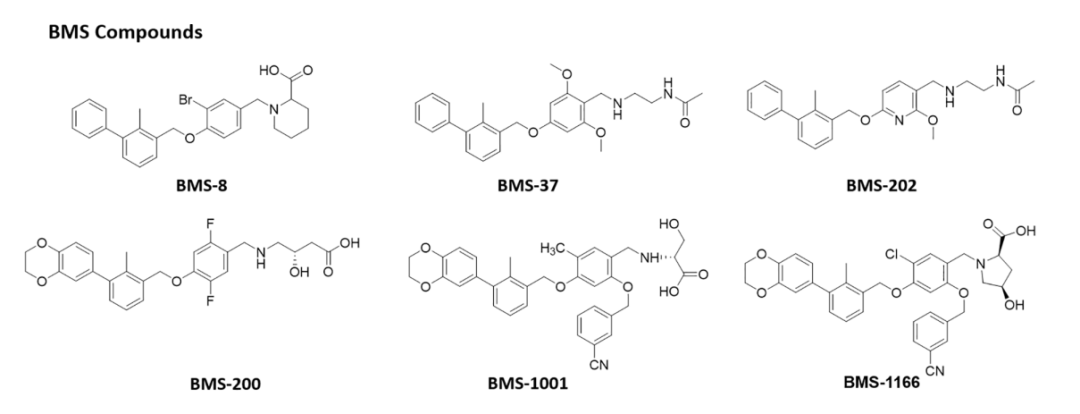
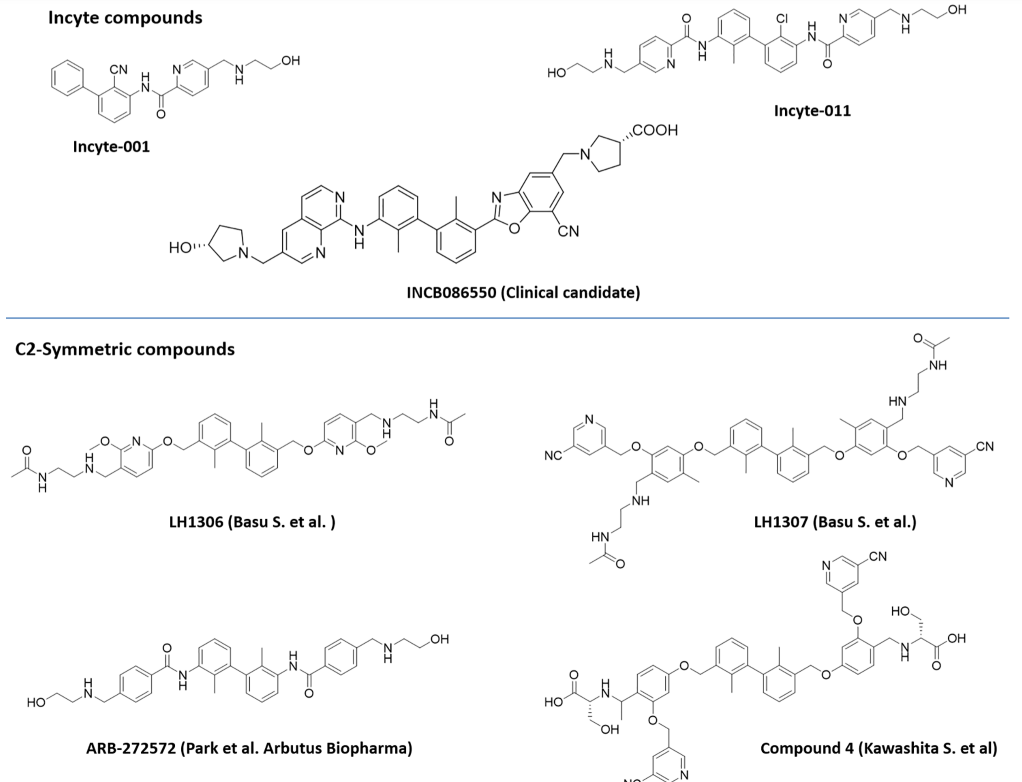
此外,过去6年来,包括Incyte Corporation、Arising International Inc.、Chemocentryx Inc.、Polaris Pharmaceuticals和Guangzhou Maxinovel Pharmaceeticals Co.在内的多家公司已经发现了一系列基于联苯核心的小分子PD-L1抑制剂。在新的改性联苯支架中,具有C2对称性或含有极性基团的假对称性的化合物比不对称结构获得了很多关注。
多肽
检查点蛋白是膜蛋白,其中大多数来自B7家族。B7家族的大多数成员及其配体属于免疫球蛋白超家族(IgSF)。IgSF蛋白的受体-配体相互作用通过环、链或环和链介导。基于这些相互作用界面的多肽设计是PPI抑制剂设计的一种行之有效的策略。
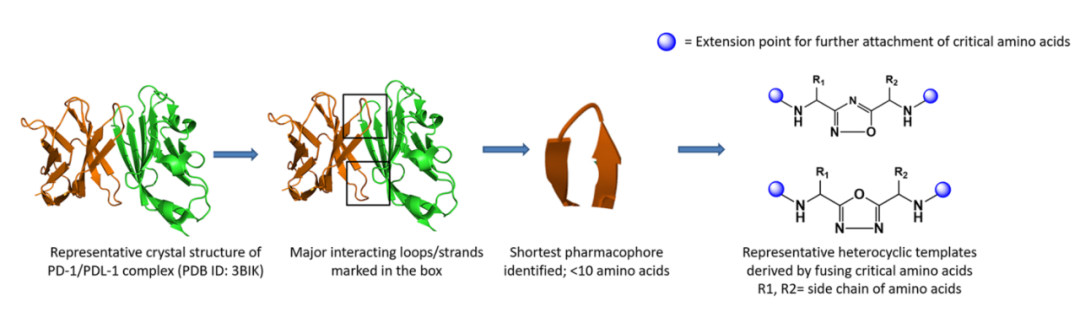
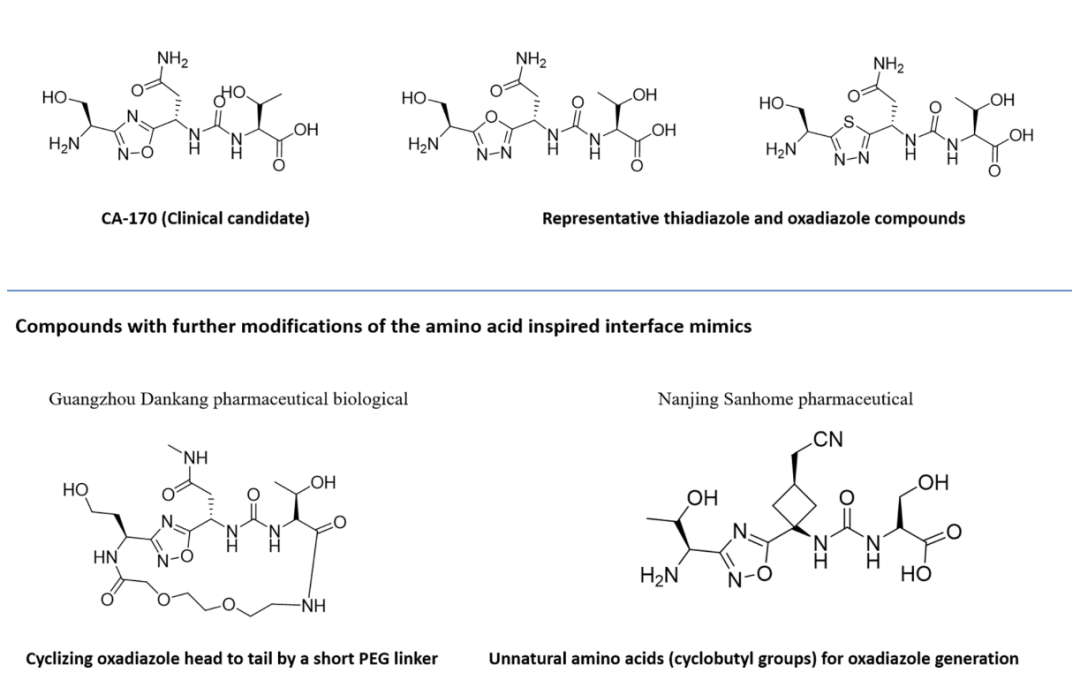
利用上述设计原理,已经开发出了了几种拟肽分子。
-03-
二、靶向PD-1/PD-L1小分子的作用机制
尽管多数分子设计来自于能够与PD-1:PD-L1复合物中的一个结合并阻止相互作用,但新出现的数据表明,一些化合物拮抗PD-1信号传导具有额外的复杂性。
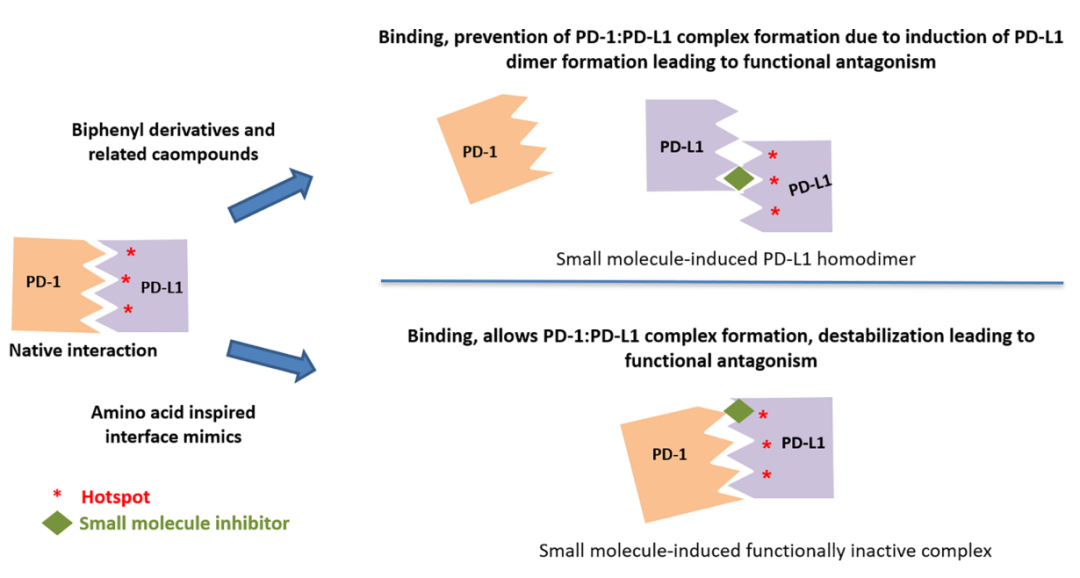
诱导PD-L1二聚并抑制PD-1:PD-L1相互作用
通过晶体结构研究,一些化合物被证明通过诱导PD-L1二聚化来抑制PD-1:PD-L1相互作用。例如BMS的小分子抑制剂倾向于首先与一种PD-L1单体相互作用,然后形成二聚体,以获得稳定性优势。而Incyte和Arbutus还利用了PD-L1二聚体中固有的C2对称性,通过对称化其分子来获得更大的效力。
阻断PD-L1从内质网向高尔基体输出
PD-L1胞外结构域中存在的四个N-糖基化位点(Asn35、Asn192、Asn 200和Asn 219)对配体蛋白的稳定性是必需的,除Asn35外,所有其他糖基化位置对其与受体的相互作用都非常关键。BMS-1166特异性抑制部分PD-L1的糖基化,并通过阻断PD-L1从内质网向高尔基体的输出而使其功能失活。
诱导PD-L1二聚和内化
化合物ARB-272572通过顺式相互作用的同源二聚体诱导细胞表面PD-L1二聚来抑制PD-1/PD-L1轴,这种同源二聚物通过快速内化到胞质中触发细胞表面PD-L1的快速丢失,从而防止与表达PD-1的细胞发生进一步相互作用。
与PD-L1结合而不干扰PD1:PD-L1复合物的形成
与基于联苯的小分子抑制剂相比,CA-170是高度极性的,在细胞环境中观察到的PD-L1信号传导的功能拮抗作用,而其与PD-L1的直接结合却不破坏PD1:PD-L1复合物导致形成有缺陷的三元复合物。CA-170的这种作用模式类似于两种已报道的抗PD-1抗体的作用模式,它们在不干扰PD-1:PD-L1复合物形成的情况下拮抗PD-1信号传导。
-04-
三、靶向PD-1/PD-L1小分子的临床研究进展
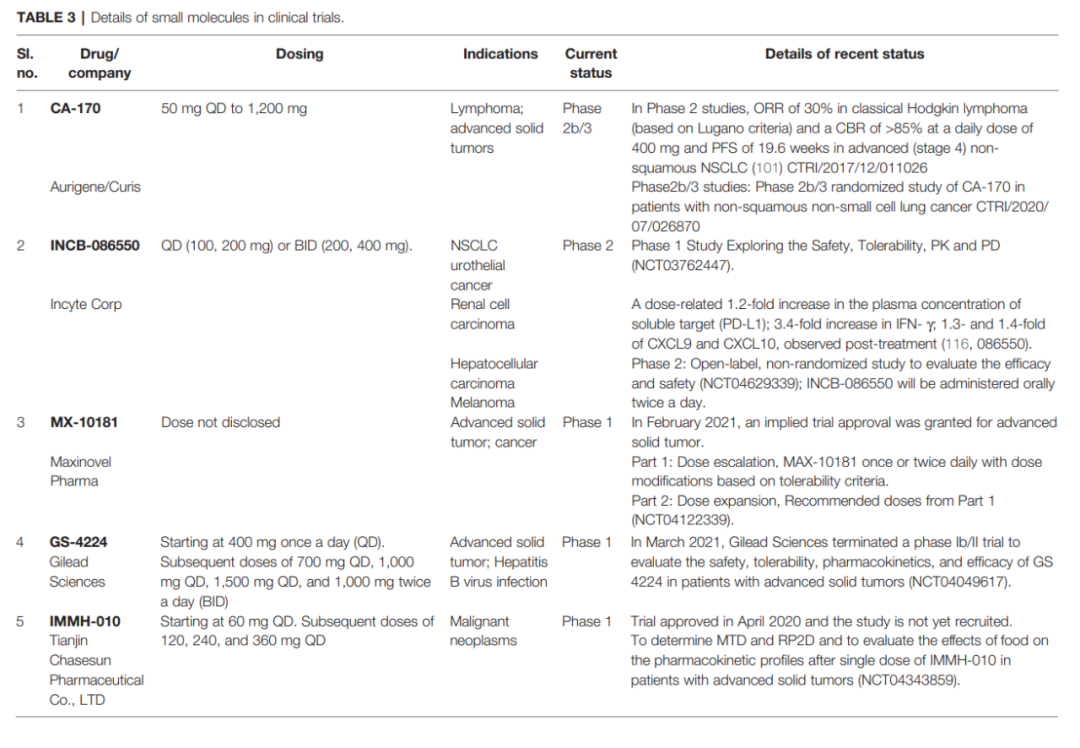
目前全球共有10余款PD-1/PD-L1小分子抑制剂进入临床阶段,代表性药物包括:CA-170(Curis/Aurigene)和INCB086550(Incyte)。
CA-170是首个进入临床试验的口服小分子PD-L1抑制剂,目前处于IIb/III期试验。 临床数据显示,低剂量(400mg QD)表现出比高剂量(800mg QD)更好的临床获益率和无进展生存期(PFS),提示存在剂量-疗效反向关系。此现象可能与免疫激活诱导的细胞凋亡(AICD)相关。 INCB-086550于2018年启动I期试验,其通过诱导PD-L1内化降低其表面表达,在临床前模型中显示单药活性并增加肿瘤T细胞浸润。
下表综合了临床上所有小分子抑制剂的最新发现:
-05-
结语
靶向PD-1/PD-L1的小分子抑制剂的研究正处于快速发展阶段,它们不仅有望解决抗体药物的固有缺陷,更可能通过口服给药、多靶点协同、灵活联合方案等优势,重塑免疫治疗格局。初步的临床数据表明,这些小分子药物在某些适应症中显示出良好的疗效,尤其是在剂量优化和安全性方面显示出积极的信号。随着研究的深入,这些药物有望在未来成为癌症免疫治疗的重要组成部分,为癌症患者带来新的希望。
参考资料:
1.Small Molecule Agents Targeting PD-1 Checkpoint Pathway for Cancer Immunotherapy: Mechanisms of Action and Other Considerations for Their Advanced Development. Front Immunol. 2022 May 2:13:752065.


