Cell Res:清华大学葛亮/张敏/与广州医科大学冯杜合作揭示RAS突变肿瘤过程中特异性自噬的调控机制
时间:2025-03-30 12:08:53 热度:37.1℃ 作者:网络
具有RAS突变的癌细胞表现出增强的自噬,这对它们的增殖和存活至关重要,使其成为治疗干预的潜在靶点。然而,RAS诱导的自噬和生理自噬之间的调节差异仍然知之甚少,这使得癌症特异性抗自噬治疗的开发复杂化。
2025年3月7日,清华大学生命科学学院葛亮课题组、药学院张敏课题组与广州医科大学冯杜课题组携手合作在Cell Research上在线发表题为“Oncogenic RAS induces a distinctive form of non-canonical autophagy mediated by the P38-ULK1-PI4KB axis”的研究论文。研究确定了一种由致癌KRAS表达诱导的非经典自噬形式,称为RAS诱导的通过ATG8ylation(RINCAA)诱导的非经典自噬。
与饥饿诱导的自噬相比,RINCAA涉及不同的自噬因子,并包含非自噬成分,导致形成具有由ATG8家族蛋白(例如LC3和GABARAP)标记的多泡/多层结构的非经典自噬体。研究将这些结构命名为RAS诱导的ATG8ylation多泡/多层小体(RIMMBA)。RINCAA的一个显着特征是经典自噬中的III类PI3K被RINCAA中的PI4KB取代。我们确定了一个调节性P38-ULK1-PI4KB-WIPI2信号级联反应控制该过程,其中ULK1触发PI4KB在S256和T263位点的磷酸化,启动PI4P产生、ATG8化和非经典自噬。重要的是,在RAS突变的癌细胞和结直肠癌标本中观察到PI4KB在S256和T263位点的磷酸化升高。在胰腺癌的异种移植和KPC模型中,抑制PI4KB S256和T263磷酸化导致RINCAA活性和肿瘤生长降低,表明靶向ULK1介导的PI4KB磷酸化可能代表RAS突变癌症的一种有前途的治疗策略。

巨噬(以下简称自噬)是细胞内物质的大规模降解,对于在应激条件下维持细胞稳态和存活至关重要。在自噬过程中,受损的细胞器、侵袭性细菌和易聚集蛋白被输送到溶酶体进行降解。自噬与多种疾病的发病机制有关,然而,导致自噬失调的特定分子事件,特别是癌症相关自噬和生理自噬之间的差异尚未阐明。
ras基因家族,编码极其相似的188-189个氨基酸蛋白,是人类癌症中最常见的癌基因。ras基因编码单体GTP酶,该酶在调节哺乳动物细胞增殖、分化和存活的信号转导途径中起分子开关的作用。组成性激活RAS蛋白的突变发生在20%-25%的人类癌症中,其中kras突变发生频率最高,并且发生在多种癌症类型中。kras突变的激活是许多肿瘤发生和进展的关键驱动因素,对肿瘤生长至关重要。然而,由于RAS蛋白表面缺乏药物结合口袋,因此难以靶向高活性的RAS突变体。到目前为止,临床上唯一有效的抑制剂是AMG510和MRTX849,它们专门针对KRAS(G12C)。
除了直接靶向RAS蛋白外,鉴定抑制下游RAS效应蛋白的药物是治疗RAS突变癌症的一种解决方案。已经表明,激活RAS突变与自噬的过度激活有关。因此,RAS突变的肿瘤细胞对自噬抑制剂非常敏感,表明自噬可以作为RAS突变肿瘤的治疗靶点。由于自噬在生理条件下也维持细胞稳态,因此应开发一种专门防止RAS诱导的自噬而不影响生理自噬的自噬抑制剂。尽管如此,RAS突变诱导的自噬和生理自噬之间的调节差异尚不清楚,特别是关于核心自噬因子的不同参与,即自噬相关基因(ATG)和蛋白质。
自噬的核心步骤由ATG和其他自噬相关蛋白的调节。在饥饿诱导的自噬下,(UNC)-51样激酶(ULK)复合物的组成部分,ULK激酶可以磷酸化多种自噬调节因子,其中一个主要靶点是由Beclin-1、ATG14、磷脂酰肌醇3激酶(PIK3)催化亚基3 (PIK3C3/VPS34)、PIK3调节亚基4(PIK3R4/P150)和Beclin-1调节的自噬蛋白1 (Ambra1)中的激活分子组成的III类磷酸肌醇3激酶(PI3K)复合物。PI3K复合物磷酸化吞噬泡的磷脂酰肌醇(PI)脂质,以募集磷脂酰肌醇-3-磷酸(PI3P)相互作用蛋白。WIPI2是PI3P的效应子,通过募集脂质化机制来激活下游事件。脂质化机制催化微管相关蛋白1轻链3(MAP1LC3/LC3/ATG8)与磷脂酰乙醇胺(PE)的偶联,从而构建自噬体。ATG9A为自噬体播下种子,并与ATG2一起作为一种超燃酶,将脂质转移到自噬膜。运输所需的内体分选复合体(ESCRT)复合体封闭吞噬体以完成自噬体的生物发生;多个SNARE复合体与膜系链组分一起促进自噬体与溶酶体的融合。虽然ATGs在生理性自噬中的级联和功能已经被很好地理解,但在病理条件下控制这些自噬因子的调节机制仍然不太清楚,特别是与生理性自噬相比,它们的分子差异。
在这里,研究者采用多种致癌RAS诱导的自噬模型来研究癌症中自噬失调的潜在分子机制。结果显示,KRAS(G12V)诱导了一种以ATG8ylation为特征的非典型自噬,这种自噬独立于几种与饥饿诱导的自噬相关的自噬因子。研究将其称为RAS诱导的通过ATG8ylation(RINCAA)的非经典自噬。观察到具有ATG8同源物阳性的多泡和多层结构的替代自噬体,而不是双膜自噬体。特别关注PI3K独立性,研究发现RAS信号诱导的ULK1激活PI4KB至关重要。值得注意的是,RAS激活的ULK1对肽1在S256和T263位点的磷酸化增强了PI4KB活性,导致PI4P的产生。此外,与饥饿诱导的自噬类似,WIPI2作为下游效应子发挥作用,但充当PI4P效应子,而不是PI3P,启动自噬体生物发生的下游事件。在异种移植和LSL-KrasG12D、p53F/F、Pdx1-Cre小鼠(KPC)胰腺癌模型中,联合抑制S256和T263上MEK1/2和PI4KB磷酸化可有效抑制ras-突变肿瘤细胞系的自噬和增殖,抑制肿瘤生长。这些发现阐明了致癌kras诱导的选择性自噬的机制框架,并揭示了一种新的抗Ras突变癌症的有效靶点。
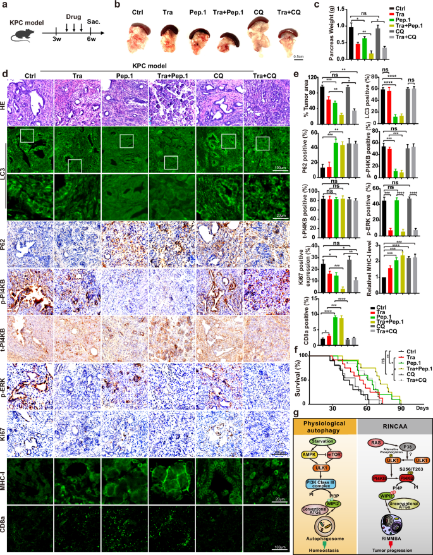
图1 PI4KB-Peptide-1对KPC小鼠胰腺癌模型肿瘤的抑制作用(摘自Cell Research)
参考消息:
https://doi.org/10.1038/s41422-025-01085-9


