施万细胞在瘢痕疙瘩中的研究进展
时间:2025-03-21 12:12:38 热度:37.1℃ 作者:网络
皮肤受伤后,在伤口愈合过程中会触发皮肤的自愈机制,产生瘢痕。当这种伤口愈合过程受到干扰时,可导致瘢痕疙瘩形成。其主要病理特征是成纤维细胞的过度增殖和细胞外基质(ECM)的重构。当前针对瘢痕疙瘩的研究主要聚焦于成纤维细胞及细胞外基质的作用,然而,瘢痕疙瘩的疼痛和瘙痒等临床特征同样不容忽视。
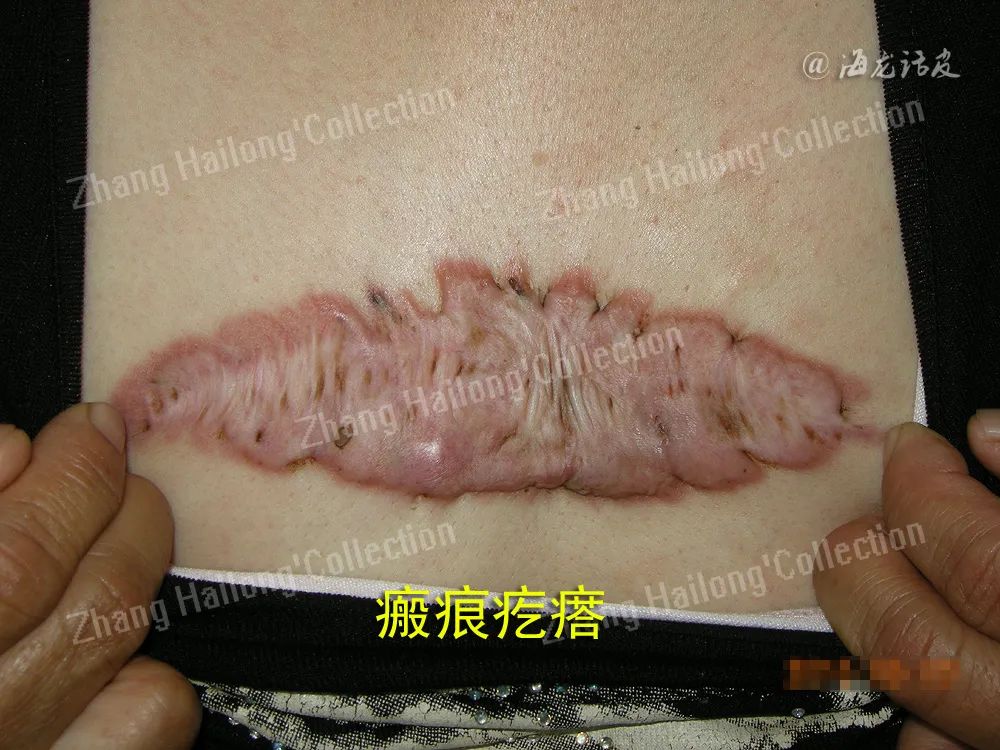
这些症状不仅给患者带来极大痛苦,还显著增加了心理负担。研究表明,这些临床特征与皮肤中丰富的周围神经系统密切相关。皮肤作为人体最大的器官,其复杂的周围神经系统主要由施万细胞(SC)构成。因此,深入研究SC在瘢痕疙瘩中的作用机制,对于全面理解瘢痕疙瘩的病理生理过程具有重要意义。
SC
SC的生物学特性
SC是周围神经系统的主要神经胶质细胞,在维持神经元稳态方面发挥重要作用。SC在周围神经功能的维持中至关重要,并参与多种病理过程,包括神经退行性疾病、神经性疼痛、神经损伤后的修复及癌症等。周围神经损伤后,成熟的SC经历转录重编程,包括去分化为未成熟的细胞状态,并获得修复特异性功能。这些修复SC通过吸引免疫细胞到损伤部位、吞噬髓磷脂碎片、分泌神经营养和神经生成因子及形成再生轨道(Bunger带)来刺激和引导轴突再生,对协调神经再生至关重要。在周围神经系统中,SC分泌神经营养因子,促进受损神经元的存活,维持感觉神经元的完整性。
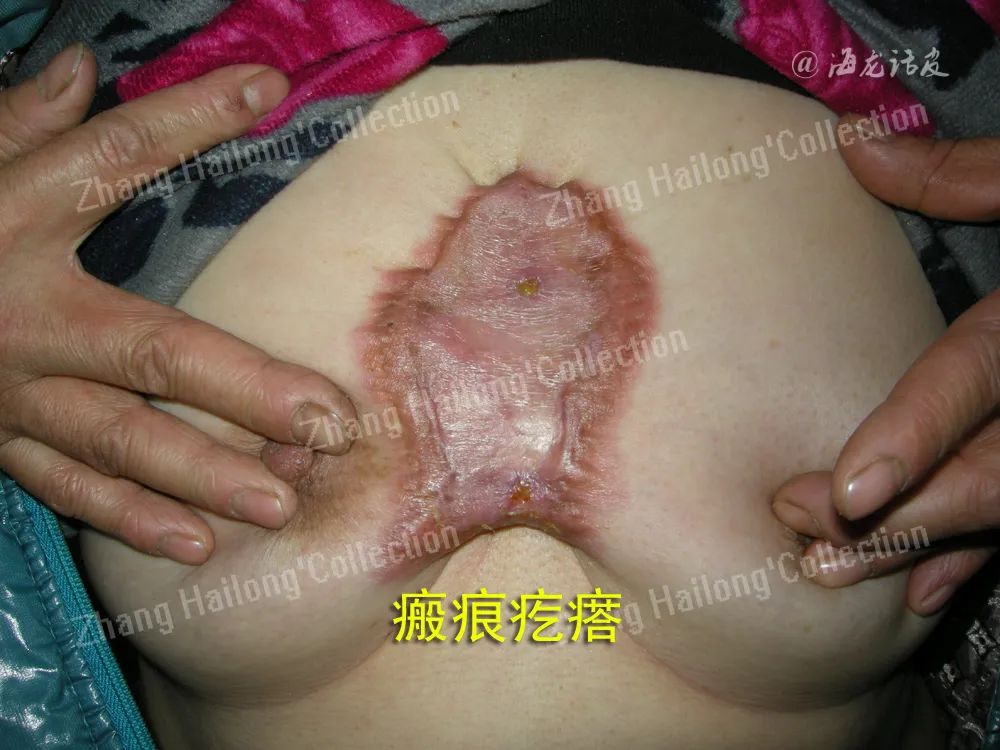
在健康皮肤中,SC通过分化(髓鞘)或未分化(非髓鞘)状态发挥作用。然而,伤口复杂的微环境促使SC转化为具有侵袭特性的间充质样细胞,驱动细胞增殖、轴突再生并促发炎症反应,以促进伤口愈合。研究表明,SC不仅有助于神经再生,还可通过调节肌成纤维细胞分化、上皮细胞增殖及ECM形成来促进伤口愈合。 一项动物实验研究表明,伤口微环境是影响SC行为的关键因素,该因素可以决定其增殖状态、重编程为间充质样细胞和ECM的产生。
作为周围神经系统中的髓鞘形成胶质细胞,SC具有高度可塑性,这一特性在创伤性损伤及周围神经病变后的神经再生过程中发挥着关键作用。神经发生损伤后,SC迅速响应损伤诱导的信号并活化启动修复程序。在这一过程中,SC经历动态的细胞重编程和形态学变化,促进神经再生和功能修复。同时,SC通过表达多种基因调控神经再生,包括促进神经元存活,加速受损轴突的崩解和髓鞘清除,并促进轴突再生,最终实现轴突的重塑,从而推动整个神经再生过程。在生理状态下,SC表现出较高的稳定性及较低的细胞更新速率。但周围神经发生损伤后,SC可迅速增殖并表现出可塑性,转变为修复表型。因此,SC不仅是皮肤伤口愈合过程中的重要参与者,还可能在纤维化过程中发挥关键作用。
SC与瘢痕疙瘩
Deng等应用单细胞RNA测序(scRNAseq)技术比较瘢痕疙瘩与正常瘢痕,发现瘢痕疙瘩组织中产生ECM的间充质成纤维细胞增加。该研究表明,瘢痕疙瘩中含有较多的不同表型的SC。这些瘢痕疙瘩中的SC绝大多数显示出具有与再生神经中的SC相似的细胞状态。瘢痕疙瘩组织与生理性瘢痕组织相比,生理性瘢痕组织中SC数量明显少。这一观察结果表明,在伤口愈合完成后,皮肤修复SC不会留在生理性瘢痕组织中。
Direder等通过scRNAseq光染色对瘢痕疙瘩中的相关细胞的特征进行了分析,发现存在丰富的SC,这些细胞表现出修复样表型和高细胞可塑性。该小组还在与正常瘢痕周围皮肤和瘢痕疙瘩周围皮肤的比较中发现,瘢痕疙瘩附近皮肤的SC数量也明显增加,因此可判定SC与瘢痕疙瘩病理机制相关。瘢痕疙瘩中SC的长期存在可能会形成与周围神经损伤后的修复样SC不同的瘢痕疙瘩特异性基因的表达。由于皮肤损伤先于瘢痕疙瘩形成,瘢痕疙瘩SC的表现可能反映了皮肤修复样SC的异常伤口愈合反应。由于瘢痕疙瘩具有类肿瘤特性,SC浸润到周围组织可能是该疾病的一个重要驱动因素。
SC促进瘢痕疙瘩的形成
SC通过调节巨噬细胞的功能促进瘢痕疙瘩的形成
与健康皮肤相比,瘢痕疙瘩中含有较多数量的巨噬细胞。巨噬细胞通过调节不同愈合阶段的微环境,在皮肤创面愈合过程中起着至关重要的作用,特别是M2-巨噬细胞与纤维化和瘢痕疙瘩形成有关。研究证明修复样SC通过释放较多的趋化因子和细胞因子来吸引巨噬细胞,从而有助于清除髓磷脂碎片等有害物质,重塑ECM以促进神经再生。
有研究已经支持SC与巨噬细胞之间的相互作用,比如巨噬细胞能够调节修复样SC再分化,而SC能够促进巨噬细胞M2极化的诱导。研究表明,瘢痕样SC和巨噬细胞的串扰促进SC增加细胞外基质的产生,同时抑制巨噬细胞对基质的降解。M1巨噬细胞具有促炎和基质降解基质的作 用,而M2巨噬细胞则参与了ECM的组成。上述 表明,SC通过调节巨噬细胞的功能来促进ECM 的沉积,进而促进瘢痕疙瘩的形成,但对瘢痕疙瘩的炎症环境相关性并不明显。
SC通过转化生长因子(TGF)-β信号通路促进瘢痕疙瘩形成
SC在伤口愈合中的功能影响伤口收缩和皮肤再上皮化,并通过TGF-β信号诱导剂成纤维细胞的出现。研究者们在小鼠皮肤伤口模型中发现,SC可以通过TGF-β去分化并调节肌成纤维细胞分化,从而促进皮肤伤口愈合。研究显示,TGF-β在瘢痕疙瘩的发病机制中发挥至关重要的关键作用,主要功能包括诱导免疫细胞向损伤部位聚集、促进血管生成及促使成纤维细胞向肌成纤维细胞分化并分泌大量ECM。TGF-β家族主要包括TGF-β1、TGF-β2和TGF-β3三种亚型,其中TGF-β1是纤维化及炎症反应的核心调控因子。而TGF-β3作为一种关键配体,在伤口愈合过程中通过引导细胞迁移来协调组织修复,并参与瘢痕形成的炎症调节。
Ou等研究发现,去分化SC在早期阶段是TGF-β3的关键来源,并且它们在微环境中模拟TGF-β信号传导。目前,虽然缺乏SC与TGF-β相关通路在形成瘢痕疙瘩中相互作用的直接研究,但是已表明与正常皮肤相比,瘢痕疙瘩中的SC表现出基质相关基因的显著上调,包括TGF-β诱导。鉴于皮肤伤口愈合过程中SC在TGF-β信号通路中的作用,可以合理推测SC通过TGF-β信号通路在瘢痕疙瘩形成中发挥重要作用。
SC通过SEMA3C信号通路促进瘢痕疙瘩形成
耳垂瘢痕疙瘩的单细胞RNA测序表明,SC可以通过信号素(SEMA)3C信号通路和血管内皮生长 因子(VEGF)信号通路影响成纤维细胞、血管内皮 细胞和平滑肌细胞的增殖,也可以通过多效蛋白信号通路被其他细胞群调控。SEMA3C蛋白是3 类信号蛋白家族的成员,可与神经菌毛蛋白(NRP)1、2和神经丛蛋白(PLXN)A2和D1相互作用,并在多个方面发挥重要作用,如神经发生、心脏发育及促进或抑制肿瘤发生发展。SEMA3C还参与调控内皮细胞中的VEGF信号通路,调节细胞的增殖和迁移等生物学过程。周围神经系统能够 修复完全横断的神经,具有很强的再生能力。这需要SC集体迁移后形成细胞索以重新连接切断的神经桥,在此过程中,神经桥内的巨噬细胞通过释放VEGF-A启动新血管的生成,这些新生血管为SC的迁移提供结构支持,并介导再生轴突生长。
Gong等发现,SEMAC3在SC中高度特异性表达,特别是成纤维细胞和血管内皮细胞,还发现了与邻近的正常组织相比,耳垂瘢痕疙瘩中ECM相关群体及SC的细胞比例显著增加,且用scRNAseq技术分析显示,SC和ECM相关亚群之间存在较强的相互作用,由 SEMA3C信号通路介导,主要参与促进成纤 维细胞增殖和迁移。这一小组实验中还发现与耳垂瘢痕疙瘩相比,胸部/背部瘢痕疙瘩中TGF-β受体相互作用增加,说明了SC与ECM相关亚群在不同种类的瘢痕疙瘩中具有不同的信号通路,这也表明瘢痕疙瘩的发病机制具有位点特异性。这些发现有助于深入理解瘢痕疙瘩的发病机制,并为不同种类和位置的瘢痕疙瘩提供更具针对性的治疗策略。
SC通过细胞外信号调节蛋白激酶(ERK)/丝裂原活化蛋白激酶(MAPK)信号通路促进瘢痕疙瘩形成
周围神经损伤后,ERK、MAPK、p38MAPK和c-Jun氨基末端激酶(JNK)等信号通路被迅速激活,并在神经损伤修复及再生过程中发挥关键作用。研究表明,ERK信号通路的激活是诱导SC去分化和转分化的关键机制,在受损的周围神经中,SC的增殖和去分化伴随着ERK信号通路的异常活化。此外,即使在正常周围神经中,ERK信号通路的持续异常激活也会导致神经细胞的脱髓鞘反应及炎症反应。进一步研究表明,ERK信号通路在中枢神经系统和周围神经系统的髓鞘形成及维持过程中具有重要作用。周围神经损伤后,p38MAPK可通过调控SC的伸长及其在轴突周围的排列,促进髓鞘的形成。
同时,c-Jun转录因子的上调可促进SC脱髓鞘,并诱导其向修复表型转分化。此外,JNK信号通路可通过激活c-Jun及上调胶质细胞源性神经营养因子(GDNF)和p75神经营养因子受体(NTR)等因子的表达,调控SC对周围神经的修复功能。神经损伤后,修复表型的SC在神经断端聚集,并与成纤维细胞直接接触,引导SC形成细胞索,进而促进再生轴突穿越损伤区域,形成神经桥。ERK和MAPK信号通路已被证实在瘢痕疙瘩的发生发展中发挥重要作用,而SC在瘢痕疙瘩组织中高度富集,因此,针对SC的干预及其在瘢痕疙瘩中的功能研究,或将为瘢痕疙瘩的治疗提供新的临床策略。
SC通过调节巨噬细胞的功能及激活多条信号通路,促进瘢痕疙瘩的发生与发展。这些激活的信 号通路分子进一步将炎症因子的刺激信号传递至细胞核内,进而调控成纤维细胞的增殖、分化及凋亡等一系列生物学行为。瘢痕疙瘩的形成涉及多种因素,机制复杂,各条信号通路不仅直接参与病变过程,还彼此交互调控。因此,未来研究可进一步探讨SC在多条信号通路中的作用及各通路之间的串扰关系,明确关键的信号交汇点,以深入阐明SC在瘢痕疙瘩形成机制中的作用。
展望
尽管如此,目前关于SC在瘢痕疙瘩发生发展中的研究仍相对较少。鉴于瘢痕疙瘩具有类肿瘤特性,SC浸润至周围组织可能是该疾病的一个重要驱动因素,其具体机制尚待进一步研究。未来,若能针对SC在损伤不同阶段的作用进行深入研究,并据此开发药物,有望为瘢痕疙瘩的治疗提供新的策略。
参考文献:
1.全雪梅,霍平平,赵蕾,金珊,金哲虎.施万细胞在瘢痕疙瘩中的研究进展[J].中国老年学杂志,2025,3(45):1262-1265.
2.高红伟,安荣泽,王兆杰.周围神经损伤修复功能评价方法的研 究进展[J].中国医学创新,2014,11(6):146-8.
3.Griffin MF,des Jardins-Park HE,Mascharak S,et al.Understanding the impact of fibroblast heterogeneityon skin fibrosis[J].Dis Model Mech,2020;13.
4.参考文献(略).


