【衡道丨干货】病理基础——胃肝样腺癌
时间:2025-03-21 12:14:46 热度:37.1℃ 作者:网络
一、肝样腺癌病例
临床病史
男,61岁。
进食哽咽不适2周,上腹部胀痛不适,疼痛间断发作。
活检诊断:(胃体)中-低分化腺癌
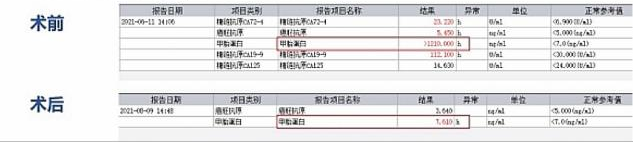
上图中有两个红框标注出来的数据——甲胎蛋白,术前甲胎蛋白含量大于1210,而正常值小于7,可知甲胎蛋白含量非常高;而术后甲胎蛋白含量为7.6,接近正常水平。
术前术后甲胎蛋白的含量差别如此巨大,难道这个肿瘤会导致甲胎蛋白升高吗?
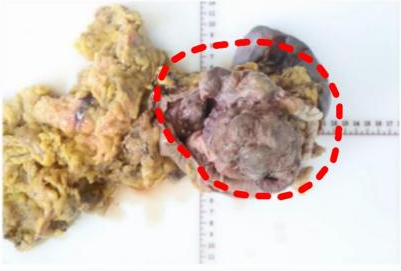
大体所见
贲门胃底可见一巨大隆起性肿物,体积:8.5cmx7.5cmx6.5cm。
既然说这种腺癌类似肝细胞癌(HCC)的形态,那肝细胞癌长什么样子呢?
肝细胞癌,是指肝细胞发生的癌变,占原发肝癌的90%以上。肿瘤细胞常类似肝细胞,体积较大,多角形,嗜酸,核可呈空泡状,位于中央,可有核仁。可形成梁状、腺泡状和实体型结构。间质为丰富的毛细血管窦,CD34染色阳性。
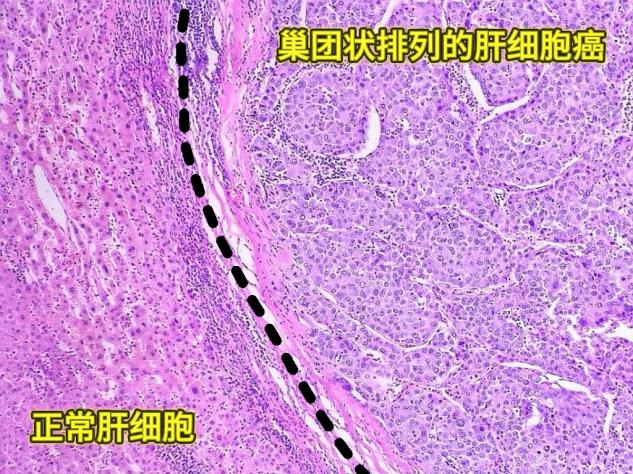
可见正常肝细胞与癌组织有明显分界,肿瘤细胞排列成巢片状,中间有空隙
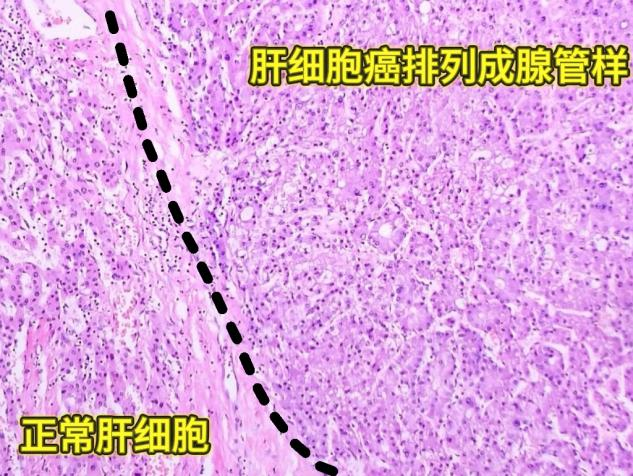
肝细胞排列成实性片状,部分区域形成腺管样结构
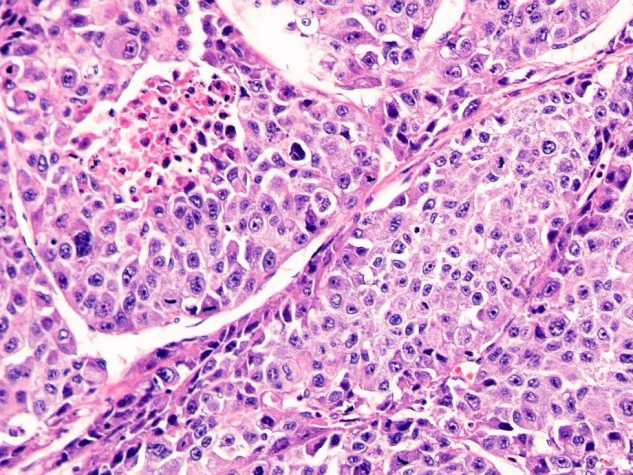
可见肿瘤细胞胞质非常丰富,粉染,细胞核大小相对较一致,低分化时细胞核可有明显异型
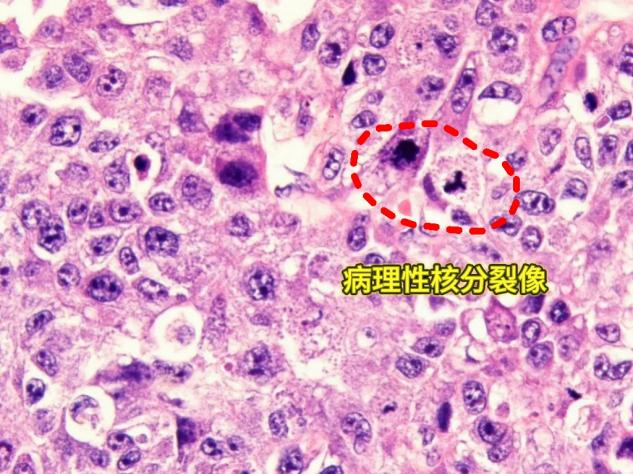
可见病理性核分裂像,核大,核仁明显,部分细胞核呈空泡状
那接下来我们看看病例的切片:
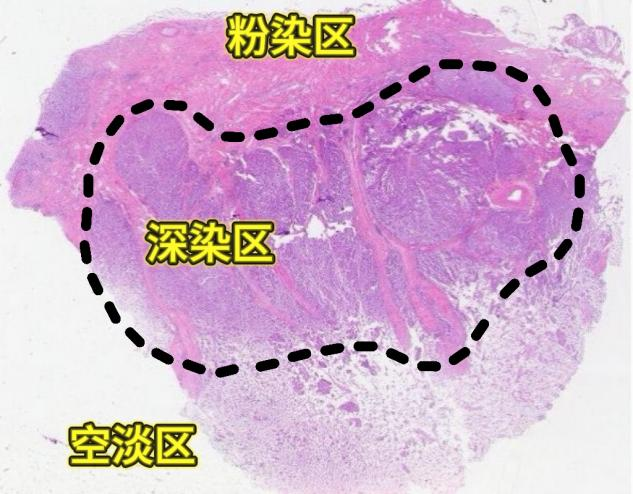
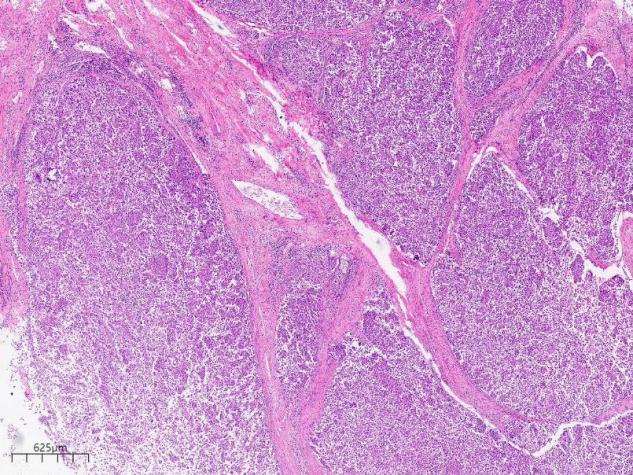
低倍镜下可将其分为三个区,从上到下依次为粉染区、深染区和空淡区
依据病理诊断的经验,一般深染的区域往往是肿瘤区域,而且低倍镜下已经见不到正常的胃的腺体,只有粉染的纤维结缔组织和平滑肌,与深染区肿瘤组织形成的区域。
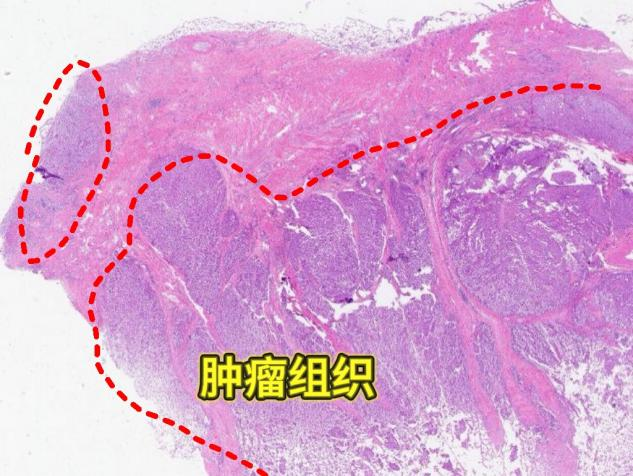
肿瘤组织被条索状粉染的物质分隔成多结节状,放大后可知该粉染物为平滑肌,即肿瘤已向下侵犯至胃壁平滑肌
继续放大看
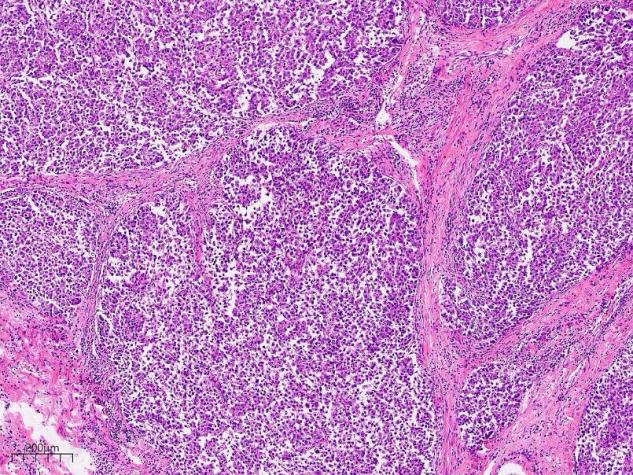
肿瘤细胞胞质偏嗜酸,被平滑肌分隔呈多结节样生长,肿瘤细胞之间有空隙
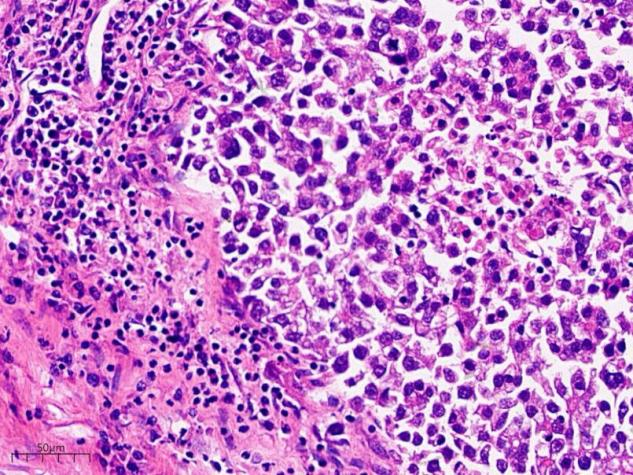
细胞核大小相对一致,边界处有大量淋巴细胞浸润
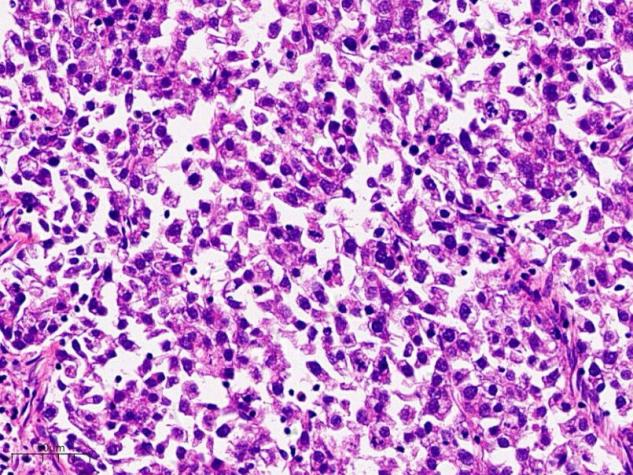
肿瘤细胞胞质丰富,嗜酸,呈不规则多角形,细胞核大小较一致,未见明显核仁
对比下图中的肝细胞癌,和B图还是非常相似的。这种形态的细胞类似肝细胞癌,故称为肝样腺癌。
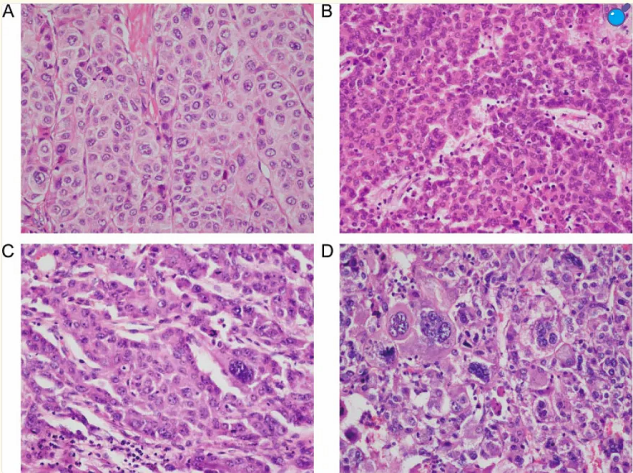
ABCD示高中低分化肝细胞癌
继续看切片
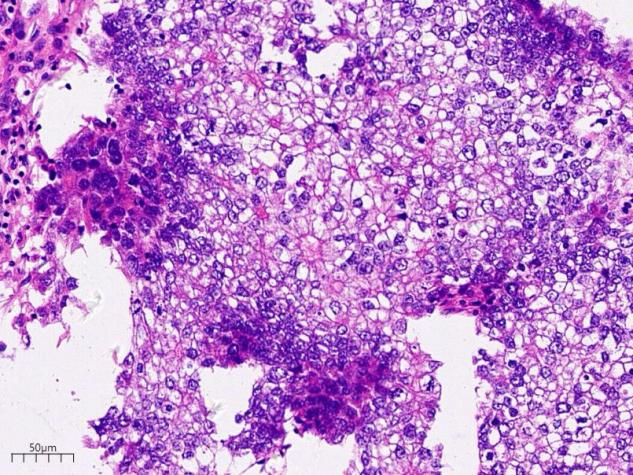
这片区域可见肿瘤细胞空泡状的核更加明显
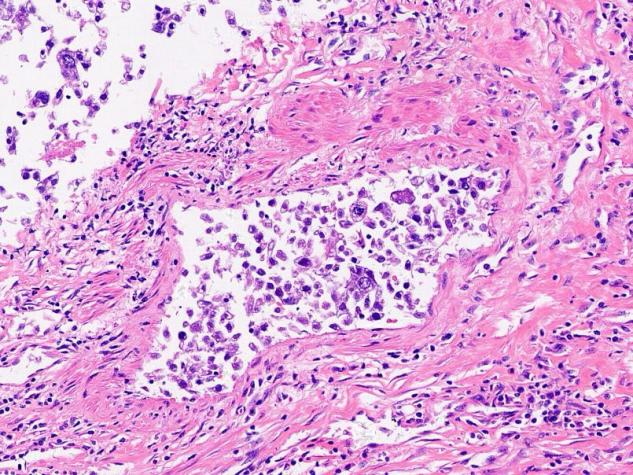
脉管内见癌栓
这是下方空淡区,也为肿瘤细胞
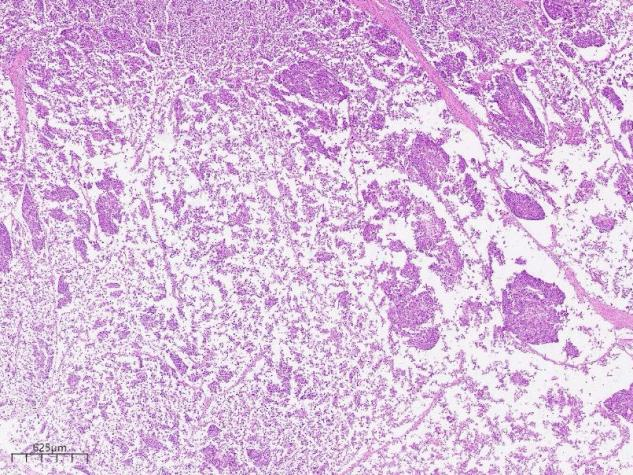
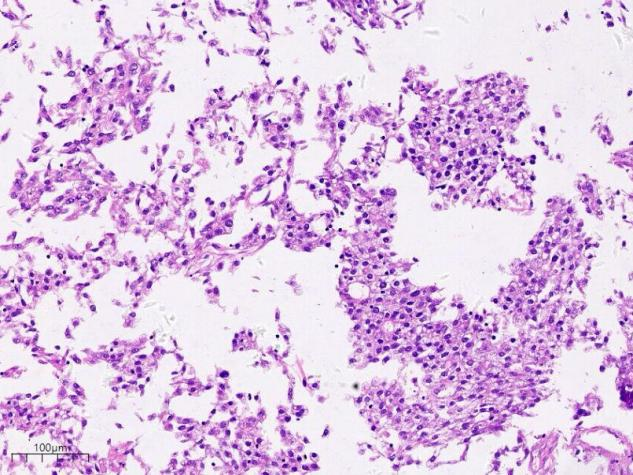
从低倍到高倍看过来,整体来说我们这张切片,肿瘤细胞成分较为单一,为嗜酸,胞质丰富的肝细胞样细胞,细胞核较小,可见空泡样核,肿瘤细胞单个散在,或排列成巢团样分布,未见明显核分裂像,未见明显腺管样癌结构。

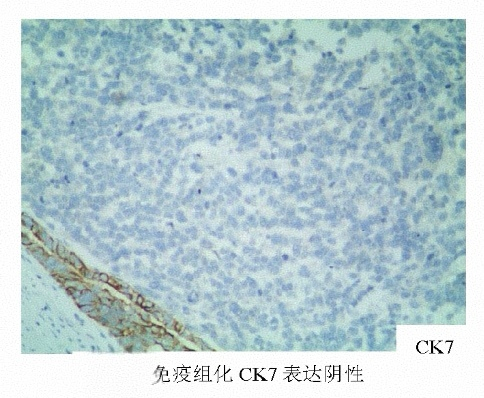
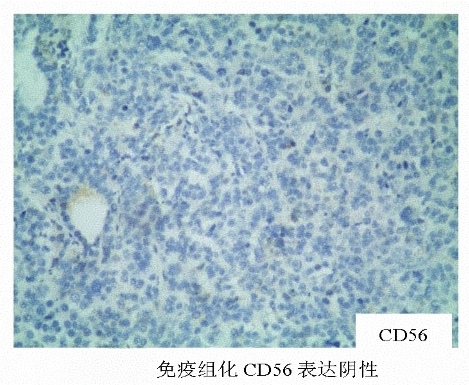
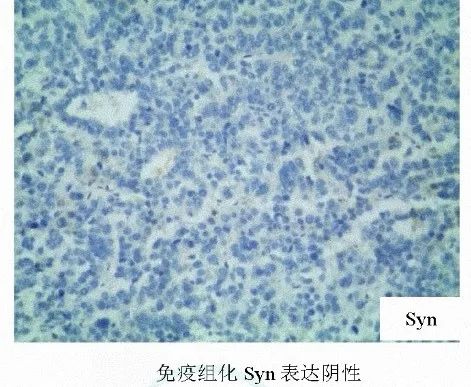
结合免疫组化HepPar-1(+),AFP(+),CK20(-),Syn(-),CK7(-),CEA(-),Ki67(60%+)等,该例病理诊断为单纯型胃肝样腺癌。
二、讨论
胃肝样腺癌(HAS)是一种极为罕见且侵袭程度极高的胃癌组织学亚型,在所有胃癌病例中所占比例仅介于0.3%-1%之间。其命名源于组织学上同时具备胃腺癌和肝细胞癌样的分化特征。1985年日本学者首次报道,2019年世界卫生组织(WHO)消化系统肿瘤分类正式将其列为独立亚型。HAS的诊断核心依据在于病理形态学中肝样分化区的明确存在,而非单纯依赖甲胎蛋白(AFP)的表达,这一诊断标准的明确,为HAS的准确诊断奠定了基础。
HAS的临床特征
1、流行病学特征
HAS多见于中老年男性群体,男女患病比例约为4:1,发病年龄集中在60岁以上的老年人群。在症状表现方面,HAS患者常出现非特异性消化道症状,诸如上腹不适、腹胀、腹痛及黑便等,易与其他常见的消化系统疾病混淆,导致早期诊断困难。同时,HAS好发于胃窦部,多数患者在确诊时已发生了肝及淋巴结的转移,其中肝转移更为常见。
2、血清学特征
在血清学指标方面,约70%-80%的HAS患者血清甲胎蛋白(AFP)会出现显著升高的情况,因此AFP是早期筛查HAS的重要指标之一。AFP作为一种在胚胎发育过程中产生的糖蛋白,在HAS患者体内的异常升高,提示了肿瘤细胞的胚胎源性分化特征。然而部分病例无AFP升高,即使AFP检测结果为阴性,也不能轻易排除HAS的诊断。
3、转移特性
HAS具有极强的侵袭性,肝转移率高达75%,与普通胃癌仅11%的肝转移率形成鲜明对比,淋巴结转移在HAS中也颇为常见,并且淋巴管和血管侵犯比例显著高于普通胃癌,分别达到53.3%与11.7%。远处转移可累及卵巢、腹膜等多个部位,进一步扩大了肿瘤的影响范围,加重了病情的复杂性和治疗的难度。
病理与免疫组化特征
1、组织学表现
HAS肿瘤组织通常由腺癌区与肝样分化区共同构成,腺癌区呈现典型的胃黏膜上皮腺样结构,反映了其起源于胃黏膜上皮细胞的特性。而肝样分化区的癌细胞形态呈多边形,胞质嗜酸性,细胞核可出现空泡变,并且排列成梁索状或巢状,与肝细胞癌(HCC)相似。根据肝样分化区和腺癌成分所占比例不同,将仅存在肝样分化区的定义为单纯型HAS,包含肝样分化区和普通腺癌区的定义为混合型HAS,大部分病例为混合HAS。肿瘤中肝样细胞成分比例越高,肿瘤分泌的AFP则越多。
2、免疫表型
HAS的免疫表型兼具胃癌和肝癌的特点:
1)肝样分化标志物:AFP阳性率达86.7%、GPC3在HAS中常弥漫阳性表达。
2)肝细胞标志物:SALL4呈现弥漫阳性表达,而这一特征与肝细胞癌中SALL4阴性表达形成鲜明对比。且SALL4阳性病例的远处转移率明显低于阴性病例。
3)鉴别标志物:HepPar-1在HAS中多呈阴性表达(而肝细胞癌中为阳性),部分呈阳性表达,且HepPar-1阳性常与肝转移相关。CEA在腺癌区呈现强阳性。
鉴别诊断
1、与原发性肝癌的鉴别
原发性肝癌患者多有乙肝或丙肝病史,在肝脏影像学方面,胃肝样腺癌肝转移灶在增强CT中表现为动脉期强化,类似原发性肝癌(HCC)的表现,增加了鉴别诊断的难度。然而,通过免疫表型可以有效区分两者,HCC免疫表型HepPar1阳性、SALL4阴性,且不含有腺癌成分,而HAS则呈现出与之不同的免疫表型特征,为鉴别诊断提供了重要依据。
2、与普通胃癌的鉴别
普通胃癌患者血清AFP大多处于正常水平,免疫组化检测AFP呈阴性,而CEA阳性率较高。相比之下,HAS患者血清AFP常显著升高,且具有独特的组织学和免疫表型特征,如肝样分化区的存在以及特定标志物的表达模式等。
3、与其他产AFP肿瘤的鉴别
其他肿瘤如卵黄囊瘤、部分肺癌等也可能产生AFP,容易与HAS混淆。卵黄囊瘤常见于儿童和青年,具有独特的组织结构和免疫表型特征;部分肺癌虽然也可能出现AFP升高,但在组织学形态和其他免疫标志物表达上与HAS存在明显差异。
治疗与预后
1、治疗策略
目前,早期HAS患者最佳治疗方法为手术切除联合辅助化疗,然而,由于HAS确诊时多已处于中晚期,手术切除的难度较大,晚期治疗则以化疗为主。鉴于HAS兼具胃癌和肝癌的特点,化疗方案需要兼顾两者的生物学特性。
2、预后因素
HAS患者的预后情况不容乐观,5年生存率仅为9%,与普通胃癌约35%的生存率相比显著偏低。不良预后与多种因素密切相关,其中AFP水平、肿瘤浸润深度、淋巴结转移及肝转移是关键因素。AFP水平升高不仅反映了肿瘤细胞的高增殖活性,还可能与肿瘤的侵袭和转移能力相关;肿瘤浸润深度越深,说明肿瘤细胞对周围组织的侵犯越严重,预后越差;淋巴结转移和肝转移的发生,意味着肿瘤已经突破了局部的解剖屏障,进入淋巴循环和血液循环,大大增加了远处转移的风险。此外,TNM分期晚、血管侵犯也是影响预后的独立危险因素。
因此,实现HAS的早期诊断,并根据患者的个体特征制定个性化的综合治疗方案,是改善患者预后的关键所在。早期诊断可以使患者在病情相对较轻时接受治疗,提高治疗效果;个体化治疗则能够充分考虑患者的基因变异、身体状况等因素,选择最适合患者的治疗方法,最大程度地提高患者的生存率和生活质量。
参考文献
[1] Nagtegaal ID,Odze RD,Klimstra D,et al. The 2019 WHO classification of tumours of the digestive system[J]. Histopathology,2020,76(2):182-188.
[2] Qu BG,Bi WM,Qu BT,et al. PRISMA-compliant ar- ticle:Clinical characteristics and factors influencing prognosis of patients with hepatoid adenocarcinoma of the stomach in China[J]. BMC Med,2016,95(15):3399.
[3] Zhu M,Chen E,Yu S,et al. Genomic profiling and the impact of MUC19 mutation in hepatoid adenocar- cinoma of the stomach[J]. Cancer Commun(Lond), 2022,42(10):1032-1035.
[4] Lin JX,Lin JP,Hong QQ,et al. Nomogram to predict recurrence and guide a pragmatic surveillance strategy after rep of hepatoid adenocarcinoma of the stom- ach:A retrospective multicenter study[J]. Ann Surg On- col,2023,30(5):2942-2953.
[5] Wang N,Kong R,Han W,et al. Aberrant β-catenin activity in hepatoid adenocarcinoma of the stomach[J]. Curr Mol Med,2021,21(8):655-664.
[6] Chandan VS,Shah SS,Torbenson MS,et al. Arginase1 is frequently positive in hepatoid adenocarcinomas [J]. Hum Pathol,2016,55:11-16.


