敏感性皮肤的发病机制及治疗进展
时间:2025-03-21 12:12:41 热度:37.1℃ 作者:网络
敏感性皮肤(sensitive skin,SS)是指皮肤在生理或病理条件下出现高反应状态的一种临床表现,主要发生在面部。其临床表现包括在受到物理、化学、心理等因素刺激时,皮肤容易出现灼热、刺痛、瘙痒和紧绷感等主观症状,可能伴随或不伴随红斑、鳞屑、毛细血管扩张等客观体征。
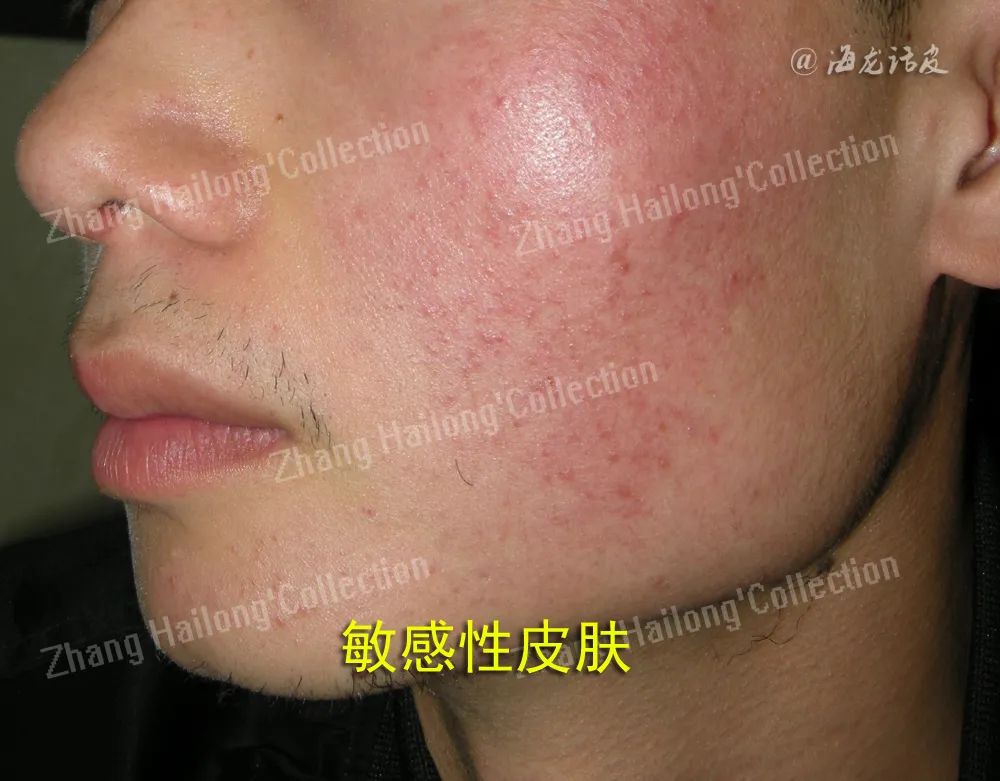
国际瘙痒研究论坛(International Forum on the Study of Itch,IFSI)中提出SS的定义为:当暴露于外部刺激时,皮肤会产生不愉快的感觉( 如灼烧、疼痛、瘙痒、刺痛等),受影响区域的皮肤可正常或发红。而在正常情况下这些刺激不会导致皮肤出现上述症状,同时这些症状不能完全用其他皮肤病变来解释。SS主要发生在面部,也可以发展到整个身体。此外,SS可能作为与面部皮肤疾病如玫瑰痤疮、脂溢性皮炎、特应性皮炎(atopic dermatitis,AD)等相关的一种表现。这些病理性疾病引起的SS是由于原有的疾病使皮肤屏障受损,皮肤处于炎症状态,继而对外界刺激的反应性增加,出现不适的主观症状。
随着工业化的发展和人们精神压力的增加,SS的发生率逐年上升,也因此受到越来越多的关注。据估计,全球范围内,约有71%的成年人认为自己有皮肤敏感的症状,其中中度或重度SS的人群比例达49.6%。女性的发生率(45%)高于男性(33%)。此外,其存在地区差异,中国的流行率为49.5%,美国为38%,南美为35%,欧洲为44%,亚洲为31%。SS的发病机制复杂,目前尚未完全阐明,临床治疗较为困难,因此,对SS的诱因、发生机制和治疗的深入研究十分必要。
诱发因素
SS的形成是多种内在和外在因素共同作用的复杂结果,这些因素并非独立发挥作用,而是相互作用和影响。
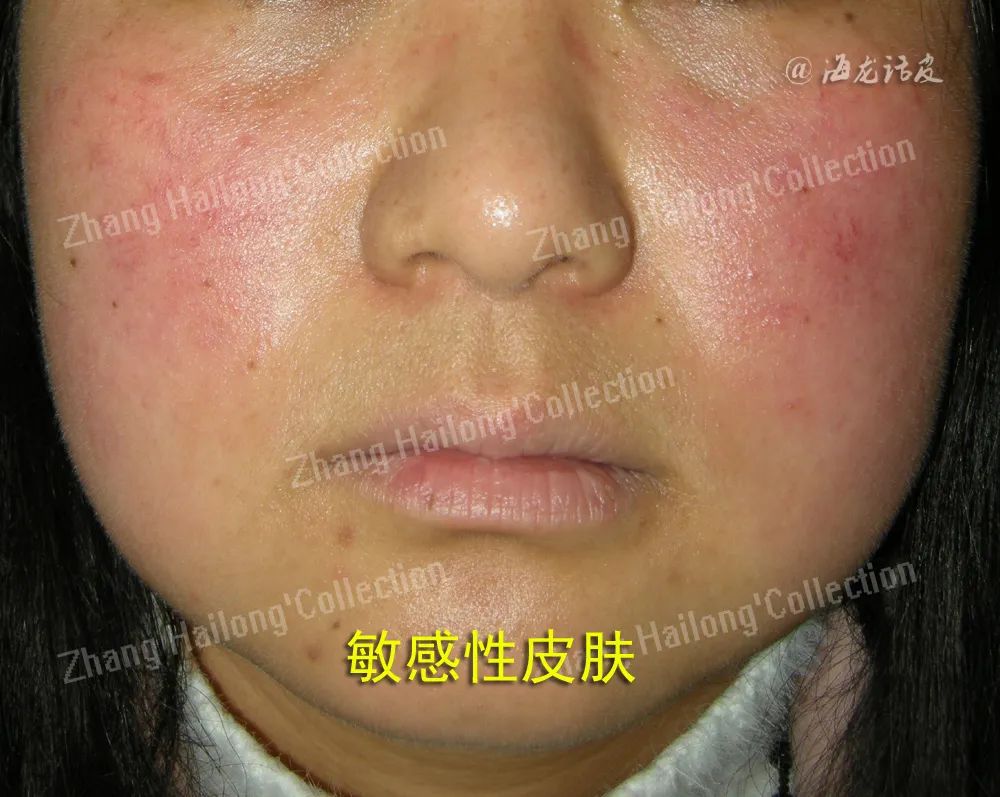
首先,个体的过敏性体质和皮肤病史易导致SS的发生。曾患有AD或玫瑰痤疮等皮肤疾病的人群更容易发展为SS。由于其疾病导致皮肤屏障功能较弱,而遗传因素使得皮肤更易受到外界刺激和过敏原的影响。当皮肤屏障功能受损时,外界的刺激物和过敏原更易渗透至皮肤内部,导致皮肤敏感性增加。
激素波动也是导致皮肤敏感性的一个重要内在因素。尤其在女性的月经周期、妊娠期和更年期,激素水平的波动会影响皮肤的水合作用、油脂分泌和屏障修复能力,增加皮肤对外界刺激的敏感性。此外,情绪和精神压力会通过内分泌系统对皮肤的敏感性产生显著影响。高强度的压力会增加皮质醇的分泌,破坏皮肤屏障,并导致炎症反应,使皮肤更加脆弱。
外在因素同样不容忽视,空气污染、温度变化、强风和紫外线辐射等环境因素对皮肤屏障功能造成直接损害。如紫外线辐射会加速自由基的产生,破坏皮肤细胞,导致皮肤屏障功能下降。此外,空气中的污染物也会刺激皮肤,引发炎症反应,从而加重皮肤的敏感性。
生活方式也是影响皮肤敏感性的重要外部因素,使用含有刺激性成分的化妆品,特别是含有酒精、香料或某些防腐剂的产品,会破坏皮肤的屏障功能。此外,摄入辛辣食物、过量饮酒等不健康的生活方式也会通过影响皮肤的新陈代谢和血液循环,间接导致皮肤敏感性增加。
发病机制
目前认为SS的形成是多种机制相互作用的结果。研究表明,皮肤屏障功能损伤、皮肤微生物群失衡、感觉神经系统功能异常以及免疫和炎症反应异常等机制相互影响,共同加剧了SS的发病过程。
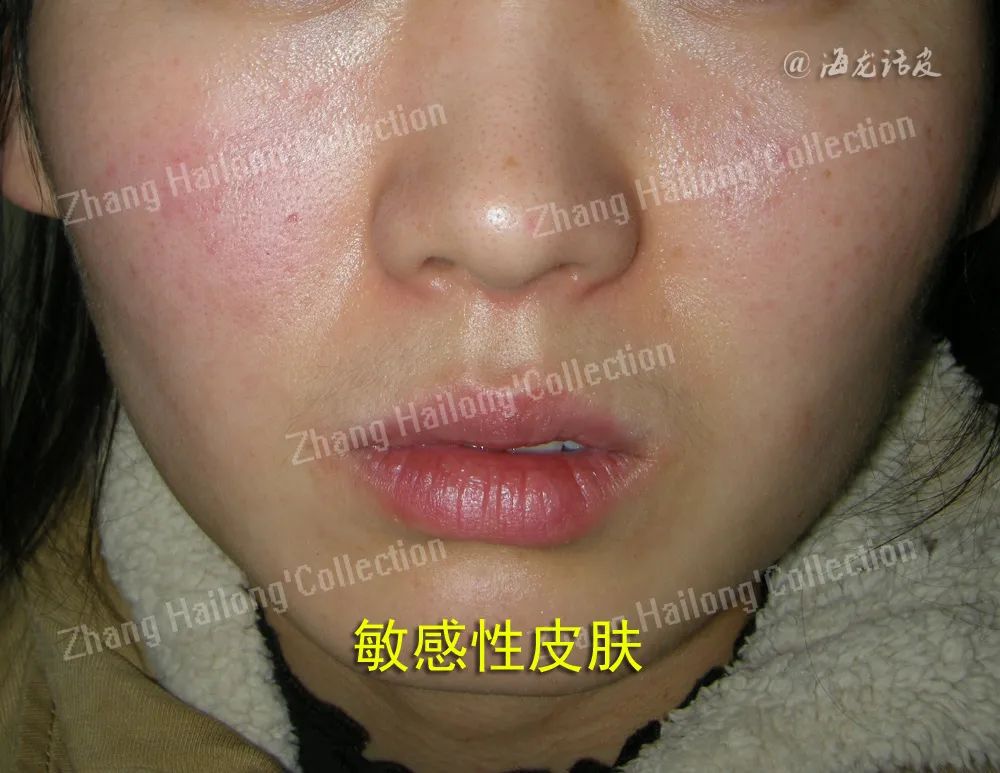
1、皮肤屏障功能受损:
皮肤屏障功能是维持皮肤健康的关键,主要依赖于角质(stratum corneum,SC)和紧密连接(tight junctions,TJs)等结构的完整性。当这些结构受损时,皮肤的保护能力下降,导致外界刺激物和过敏原更容易侵入皮肤,最终引发SS。
SC损伤和皮肤屏障受损:SC是皮肤的外部屏障,由紧密排列的角质形成细胞和脂质组成。其主要功能是防止水分流失并抵御外界的物理、化学及生物因素。维持SC完整性的关键成分包括脂质(如神经酰胺)和抗菌肽(antimicrobial peptides,AMPs)。SS通常表现为SC神经酰胺、中性脂质和鞘磷脂等含量的下降,导致SC的水合作用减少,经皮水分流失(transepidermal water loss,TEWL)增加。
SC中的天然保湿因子(natural moisturizing factors,NMFs)是保持皮肤水合作用的另一至关重要的因素。当皮肤屏障受损时,NMFs的水平下降,导致皮肤失去水分调节能力,增加皮肤的干燥和脆弱性。干燥的皮肤不仅更容易受到外界刺激的影响,还会引发瘙痒、刺痛等不适症状,进一步加剧SS的病情。
TJs功能异常:TJs位于角质形成细胞之间,作为表皮中的第二道物理屏障,控制物质通过细胞间隙的通透性。TJs的主要蛋白质包括紧密连接蛋白(claudin-1,CLDN1)和丝聚蛋白(filaggrin,FLG)等。当TJs功能受损时,皮肤的渗透性增加,外界的刺激物和病原体更容易穿透表皮,导致炎症反应和敏感症状。一项实验发现敲除小鼠CLDN1会导致致命的皮肤屏障缺陷,强调了TJs在维持皮肤屏障完整性中的重要性。在AD患者中,研究发现其非病灶区域的 CLDN1表达减少,导致紧密连接功能异常,该异常不仅影响了皮肤的屏障功能,还会加重SS的症状。
FLG是维持皮肤屏障功能的另一个关键蛋白,它在角质形成细胞内调节脂质合成,并参与角质层结构的形成。当FLG发生突变或缺陷时,角质层中的脂质代谢紊乱,导致皮肤屏障的完整性受损。该损伤增加水分流失,削弱了皮肤对外界刺激的抵抗力。此外,FLG缺陷细胞会释放出小细胞外囊泡,使皮肤其脂质成分发生变化,从而影响T细胞的反应,导致炎症反应加剧,进一步加重皮肤敏感。
2、皮肤微生物菌群失衡:
皮肤的微生物群在维持皮肤健康、屏障功能和免疫调节中起着至关重要的作用。人类皮肤每平方厘米可寄生多达十亿个微生物,包括细菌、真菌、病毒和螨虫。这些微生物通过AMPs、游离脂肪酸(free fatty acids,FFA)等来帮助皮肤抵御外界病原体的入侵或防止其理化状态的改变,确保皮肤微生物屏障的完整性。SS的患者常出现瘙痒、紧绷、发红等症状,近年来越来越多的研究表明,这些症状与微生物群的变化密切相关。
与此同时,外界因素如污染、温度变化和化学物质等加剧了微生物群的失衡。利用16SrRNA基因测序等技术,研究者对SS与正常皮肤的微生物组成进行了分析。结果显示,SS的微生物组与正常皮肤相比,在多样性和组成上存在显著差异。SS中棒状杆菌(Corynebacterium)、库克菌(Kocuria)、微球菌(Micrococcus)和乳球菌(Lactococcus)的丰度增加,而健康皮肤中的葡萄球菌减少。
皮肤微生物群与皮肤微生物屏障:表皮葡萄球菌(Staphylococcus epidermidis,S.epidermidis)等共生菌对于健康皮肤防御致病菌起到关键作用,能够通过分泌抗菌肽来抑制病原菌的生长。然而在SS中这类菌群丰度降低,皮肤的防御机制减弱,从而外界刺激对皮肤的伤害风险增加。这一发现进一步揭示了SS与正常皮肤的微生物群差异。这些菌群的变化与SS的炎症和屏障功能受损密切相关,并可能通过代谢活动释放代谢副产物,如有机酸或酶类,加剧了皮肤屏障的损伤。
研究发现,皮肤微生物群失衡的主要表现为共生菌的多样性减少,病原菌占据主导地位,从而导致皮肤屏障的破坏。该失衡不仅会引发局部炎症反应,还会延迟皮肤屏障的修复。当皮肤屏障受损时,病原菌如金黄色葡萄球菌(Staphylococcus aureus,S.aureus)的过度繁殖往往加剧炎症反应,进一步加重皮肤敏感性。Khanda等的研究表明,S.aureus的过度生长导致慢性炎症,从而延缓皮肤屏障的修复过程。Lang等进一步指出,当皮肤屏障功能受损时,郎格汉斯细胞能够通过白细胞介素(interleukin,IL)-1β信号通路区分S.aureus与无害的S.epidermidis,当S.aureus存在时往往会产生剧烈的炎症反应。
皮肤微生物群与皮肤化学屏障: 正常情况下,微生物群通过分泌AMPs和FFA(如丙酸)在维持皮肤的弱酸性状态和健康状态中起到关键作用。当皮肤pH值升高时,微生物群的调控能力下降,无法有效抑制外来病原微生物的生长,从而影响皮肤的免疫功能。研究表明,在皮脂分泌较多的区域,痤疮丙酸杆菌(Cutibacterium acnes,C.acnes)和棒状杆菌的丰度较高,它们通过分泌脂肪酶将皮脂中的甘油三酯分解为FFA,帮助维持皮肤的低pH值,并抑制致病微生物的生长。而当C.acnes等微生物丰度降低时,皮肤的pH值升高,可导致皮肤菌群进一步失衡,进而引发皮肤敏感症状。
另一方面,棒状杆菌、微球菌或S.aureus等菌群的过度繁殖可造成代谢产物的变化,导致皮肤pH值降低,破坏皮肤化学屏障。此外,S.epidermidis可通过分泌鞘磷脂酶,帮助宿主生成神经酰胺,这种脂质对保持皮肤屏障的完整性和防止皮肤水分流失至关重要。
皮肤微生物群与物理屏障:健康的皮肤微生态有利于皮肤物理屏障的稳定。研究表明, 皮肤微生物群通过调节宿主细胞中的芳香烃受体(aryl hydrocarbon receptor,AHR),在皮肤屏障修复过程中起到了重要作用。当皮肤屏障受损时,微生物代谢物能够激活角质形成细胞中的AHR,促进上皮细胞分化并帮助恢复皮肤的完整性。通过这些研究,科学家揭示了微生物群失衡如何直接影响皮肤健康状态。
微生物群的变化不仅影响皮肤的pH值和脂质代谢,还破坏了局部免疫功能,使皮肤更易受到外界刺激的影响。这些发现为理解SS的病理生理机制提供了新的见解,同时为未来的治疗策略提供了潜在的靶点。通过调节皮肤微生物群的组成,恢复健康的微生物平衡,有望成为治疗SS的有效手段。这一观点为未来基于微生物组的治疗方法奠定了基础,凸显了微生物群在维持皮肤健康和屏障功能中的关键作用。
3、皮肤的感觉神经系统功能异常:
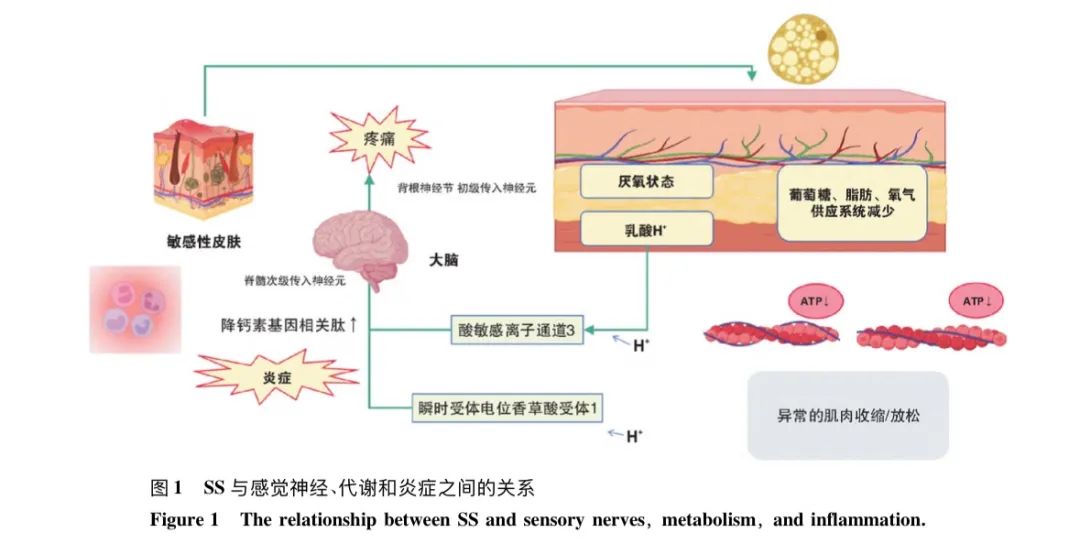
SS是一种以感觉异常为主的皮肤疾病,其感觉异常包括感觉过敏和触痛。感觉过敏是指对通常无害的触觉或温度刺激产生过度敏感反应,触痛则是指对疼痛刺激的反应异常增强。这些反应可能与神经系统功能异常、神经源性炎症以及疼痛阈值降低有关。
皮肤的神经供应由三种类型的感觉神经纤维组成:A-β纤维、A-δ纤维和C纤维。在SS中,C纤维和A-δ纤维的活跃性显著增加,释放神经肽,如P物质和降钙素基因相关肽(calcitonin gene-related peptide,CGRP),这些神经肽不仅作用于神经元,还与肥大细胞等免疫细胞相互作用,激发炎症反应,导致血管扩张,炎症反应加剧。此外,神经激肽(neurokinin,NK)、肠活性血管肽(vasoactive intestinal peptide,VIP)和神经肽Y(neuropeptide Y,NPY)也在皮肤神经功能和炎症反应的调节中起重要作用。
瞬时受体电位香草酸受体1(transient receptor potential vanilloid 1,TRPV1)是SS中引发神经源性炎症的重要受体。TRPV1是一个多模态感受器,能响应高温、低pH 值和机械压力等有害刺激,在角质形成细胞、成纤维细胞、肥大细胞、内皮细胞以及感觉C纤维和A-δ纤维中均有表达。TRPV1对温度、pH值及化学刺激极为敏感,因此许多SS的患者在遇到温度变化时会出现瘙痒、灼痛和疼痛等不适症状,表明TRPV1及其相关通路与SS的发病密切相关。
TRPV1活性可以通过多种细胞内信号通路增强,尤其是蛋白激酶A、蛋白激酶C、磷脂酶C和Ca2+/钙调蛋白依赖性激酶II。这些途径在炎症介质或低pH值的作用下会增强TRPV1的活性,降低感觉神经元的刺激阈值,从而增加敏感性。此外,TRPV1在角质形成细胞和成纤维细胞中的作用也显著影响细胞的增殖、分化及炎症反应。这表明TRPV1不仅是疼痛和瘙痒的传感器,还参与了皮肤屏障功能的调节和炎症的发生。
在T细胞中,TRPV1有功能性表达,当T细胞受体激活后,TRPV1的表达水平显著上调。TRPV1的激活会通过Ca2+内流增强T细胞的病理性反应,导致促炎细胞因子如IL-2、干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)的释放,进一步加重炎症反应,破坏皮肤屏障。此外,阻断TRPV1还能抑制血管内皮生长因子的分泌,减少血管反应性和渗透性,特别是在没有红斑的SS中。
树突状细胞中的TRPV1激活后可使得细胞分泌IL-23,进一步激活CD4+T细胞和CD8+T细胞,这些免疫细胞浸润皮肤可加重炎症和皮肤屏障的破坏。
在SS中,组胺通过激活特定的神经受体诱导瘙痒,尤其是H1和H4受体。敏感性皮肤的神经末梢对外界刺激的反应增强,神经系统更易被组胺等瘙痒介质激活。组胺与神经元上的H1和H4受体结合后,触发感觉神经元的去极化,进而通过传入神经纤维将瘙痒信号传递到中枢神经系统,引发瘙痒感。因此,SS敏感状态的发生是由神经源性炎症、TRPV1的过度激活以及免疫反应的异常共同影响(图1)。异常代谢产(如厌氧状态、乳酸积累、ATP减少)增加作用于神经系统,使得感觉神经传导信号(酸敏感离子通道3,瞬时受体电位香草酸受体1,降钙素基因相关肽)增强。
SS的治疗策略
鉴于SS发病机制的复杂性,治疗上需要从多个层面入手,系统修复皮肤屏障、调节神经功能以及控制炎症。
1、修复皮肤屏障功能:
修复皮肤屏障功能是SS治疗的核心策略之一。保湿剂和油脂性成分在修复皮肤屏障中发挥了关键作用。天然保湿因子(如透明质酸)通过增加皮肤的水分含量,帮助皮肤保持水合状态, 防止水分流失。而凡士林、角鲨烯等油脂性成分则通过在皮肤表面形成保护膜,进一步减少水分蒸发,增强屏障功能。可有效缓解皮肤的干燥和敏感症状。
2、降低感觉神经的高活跃性:
降低神经高活跃性的相关药物包括: ①TR- PV1拮抗剂: 反式4-叔丁基环己醇(trans-4-tert-Butylcyclohexanol),能够有效抑制TRPV1的活性,减轻疼痛和不适感;②TRPV4受体抑制剂:TRPV4受体抑制剂能够有效减少由神经源性炎症引发的瘙痒感,尤其适用于由于外界刺激引起的SS的症状。
研究发现,钙调神经磷酸酶抑制剂,如环孢素(Cyclosporine)和他克莫司(Tacrolimus),可降低感觉神经的高活跃性。研究表明,0.1%的他克莫司软膏在治疗成人面部SS上效果显著,能够改善紧绷感和刺痛感。
胀果甘草提取物(glycyrrhiza inflata extract) 作为一种抗炎成分,可通过减少前列腺素E2的生成缓解皮肤炎症反应,在神经保护和抗氧化方面也具有作用,可缓解神经性疼痛和与感觉神经过度活跃相关的症状(如痛觉过敏和触觉异常)。研究发现,甘草提取物能减少氧化应激指标并改善与神经功能相关的生化参数,表明其具有抗痛觉敏感的作用,并可通过减少炎症和氧化损伤来影响感觉神经的活跃性,在SS的管理中发挥降低神经敏感性的作用。
3、调节菌群失衡:
近年来,益生菌在调节皮肤微生物群以及缓解皮肤炎症中发挥了重要作用。微生物失衡会导致炎症加剧,因此通过调节微生物群,可以有效缓解敏感性皮肤的炎症反应。益生菌副干酪乳杆菌(Lactobacillus paracasei)可以修复皮肤屏障,其机制是通过调节皮肤的微生物群来增强皮肤的 免疫反应,缓解炎症和减少TEWL,从而改善皮肤健康。
此外,研究表明,长双歧杆菌(Bifidobacterium longum)的裂解产物能够抑制辣椒素(Capsaicin)诱导的CGRP,从而抑制神经源性炎症反应。乳酸杆菌(Lactobacillus rhamnosus)裂解物可增强皮肤屏障功能的作用。乳酸杆菌通过促进紧密连接蛋白(如FLG和CLDN1)的表达,改善皮肤的屏障功能。此外,乳酸杆菌还能通过TLR2/Akt信号通路,减轻由十二烷基硫酸钠(sodium lauryl sulfate,SLS)引发的皮肤细胞损伤。
结语与展望
综上所述,SS的机制复杂且相互作用,包括皮肤屏障受损、神经系统异常、炎症反应和微生物群失衡。这些机制的相互作用表明未来的治疗策略需要多角度、综合性地解决问题。个性化治疗方案的开发将有助于提高SS患者的生活质量,并为治疗提供更多的选择。这些机制之间往往相互作用,未来的研究需深入探讨微生物菌群失衡、神经系统异常、屏障功能受损、皮肤炎症之间的相互作用,以开发更精准的治疗方案,从而提高患者的生活质量。
参考文献:
1.NOH Youngji,曹婷,叶城斌,邹颖.敏感性皮肤的发病机制及治疗进展[J].皮肤性病诊疗学杂志, 2025, 2(32):140-148.
2.WOLLENBERGA,GIMÉNEZ-ARNAU A.Sensitiveskin: a relevant syndrome,be aware[J].J Eur AcadDermatol Venereol,2022,36(Suppl 5) : 3-5.
3.XIAO X,QIAO L,YE R,et al.Nationwide survey and identification of potential stress factor in sensitive skin ofChinese women[J].Clin Cosmet Investig Dermatol,2020,13: 867-874.
4.其他文献略。


