【Blood】老年fit急性髓系白血病的治疗挑战和未来方向
时间:2025-03-12 12:12:01 热度:37.1℃ 作者:网络
老年fit AML
AML的治疗进展主要集中在年轻(<60岁)或老年(≥75岁)且状态不佳的患者中,而60-75岁且fit患者群体的治疗选择存在不确定性,事实上这部分患者也占着AML中相当大的比例。
临床医生在选择诱导方案时,必须应对多种不确定因素:通常健康的老年患者在强化疗中是否会出现不必要的毒性?这些患者是从传统蒽环类药物和阿糖胞苷诱导治疗中获得更多的长期获益,还是从依赖于新型“靶向”抑制剂(如维奈克拉)的低强度治疗方案中获得更多的长期益处?如果患者对初始治疗有反应,那么随后哪种干预措施可以在保持良好生活质量的同时提供最高的总体生存?
《Blood》近日发表综述,讨论了老年fit成人AML患者的注意事项,包括fitness的确定、fitness之外应评估的因素,以及改善这些患者预后的挑战和创新。

哪些患者“适合”强化治疗?
理想情况下,应该有经过前瞻性验证、易于应用的评分系统来评估患者的fitness,这个评分系统可以在AML诊断时计算并应用,并能够准确预测任何患者的治疗相关并发症和死亡风险。这样的标准可实现根据治疗强度和预期毒性重复分配治疗方案,并显著提高临床研究的普适性。该问题在AML治疗模式中仍是一个广泛讨论的空白领域。
目前的数据描述了三种临床方法来回答这个问题。第一种方法是利用从临床数据集中推导出的计算器来预测接受细胞毒性药物诱导治疗的患者的治疗相关死亡率(TRM),例如TRM计算器和AML综合模型(AML-Composite Model)。第二种方法是通过在基线时进行老年综合评估(GA)来确定患者是否适合接受诱导治疗,作为衡量frailty程度的方法。多项前瞻性研究表明,GA可为老年患者提供有价值的信息,包括在计划接受强化诱导治疗的老年患者中提供早期死亡和并发症的风险,但尚无前瞻性、随机研究对上述工具进行验证,因此没有证据表明,基于TRM计算器或GA选择不同的治疗方案(即使是强度较低的方案)是否会改变部分患者的不良预后。大多数研究方案目前采用第三种方法,即Ferrara标准,其于2013年发表,使用体能状态、高龄和/或合并症的存在来描述“unfitness”。该标准未经过前瞻性验证,对疾病生物学不敏感,如上所述,也无法区分是否有替代方法可以提供相似或更好的预后。
目前也没有关于动态评估的数据;尽管患者的状况可能随着成功治疗而改善,或者随着原本可耐受的治疗的累积毒性而恶化,这些限制阻碍了这些模型在诱导治疗分配中的采用,即使有强烈的标准化呼吁。然而在临床上,医生可以将上述方法之一(TRM评估、GA或Ferrara标准)作为诱导决策的辅助工具,该做法也与国际治疗指南一致。
目前,正在努力将老年综合评估和frailty程度测量纳入MyeloMATCH,这是美国NCI最近启动的AML平台研究。在2024年5月启动时,这项大型研究没有正式定义“fitness”,而是要求注册医生判断患者是否“适合”接受常规诱导治疗。然而其最终目标是修改研究并验证合并症、认知、身体功能和情绪健康的核心测量指标,以识别与治疗耐受性相关的组成部分。该老年综合评估将使用完成初始计划治疗过程的能力和早期死亡作为关键终点。如果该努力能够实现,长期目标是将这些经过验证的方法与疾病特异性分子特征相结合(独立于年龄),并为患者分配特定的诱导策略。
哪些患者应该接受非强化诱导方案(不考虑fitness)?
一旦医生确信一位60岁以上的患者健康状况足以接受阿霉素和阿糖胞苷治疗,接下来的问题通常为,患者应该接受该治疗吗?总体而言,因疾病相关原因,老年患者比年轻患者更难通过强化诱导达到完全缓解——老年患者更常有先前的骨髓增生异常或骨髓增殖性疾病、更有可能接受过先前抗癌治疗、通常有克隆性造血的背景(存在由促炎微环境滋养的肿瘤克隆,随后出现不良核型或分子学特征),所有这些特征都导致对强化治疗耐药。在传统诱导的随机研究中,高龄始终作为这些状态的代名词,且与更差的预后相关。即使在现代试验中,将靶向药物添加到传统背景中,老年患者也可能无法获益。例如在FLT-3抑制剂quizartinib的随机III期研究中,患者年龄上限为75岁,539例随机患者中有40%超过60岁。事后分析显示,在超过60岁的亚组中,两组之间的OS(总生存期)没有显著差异,HR(风险比)为0.911,且超过60岁的患者中位OS(quizartinib组为17.5个月,对照组为14.2个月)短于60岁以下患者(quizartinib组未达到,对照组为23个月)。表1总结了包括老年fit患者的随机III期研究的结果。
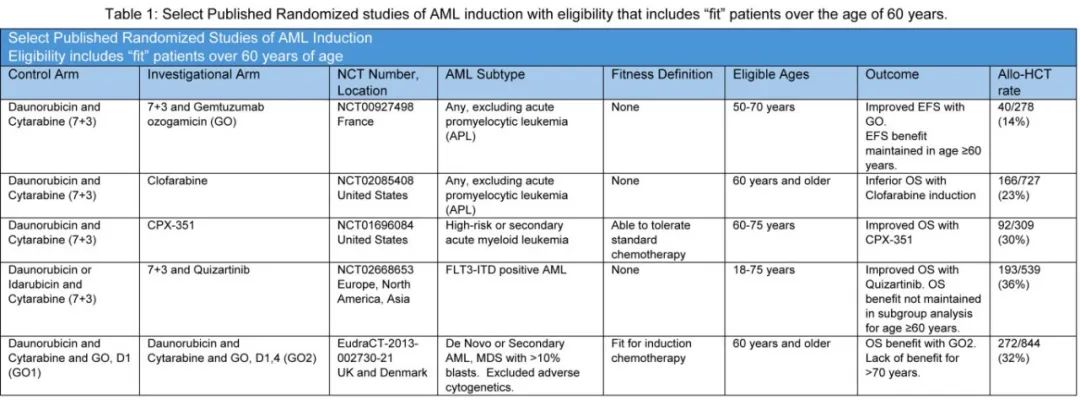
去甲基化药物联合BCL2抑制剂维奈克拉的研究取得了令人鼓舞的结果,提供了一种替代方法。备受瞩目的VIALE-A试验随机分配>75岁患者或被不耐受传统诱导治疗患者,接受地西他滨单药治疗或地西他滨联合维奈克拉(Hma-Ven)作为一线AML治疗。Hma-Ven组CR/CRi率很高,为66.4%,30天死亡率为7%,与地西他滨组相当。试验组的中位总生存期为14.7个月。与强化疗不同,Hma-Ven联合治疗需要持续进行,并且通常存在血细胞减少,需要剂量延迟或中断。该方案并非治愈性治疗。
在这个年龄组中,没有严格的前瞻性比较来指导老年患者推荐哪种治疗:有限期强化方案,还是需要持续治疗的Hma-Ven方案。在实践中,许多医生可能会与患者讨论诱导治疗选项,权衡强化与非强化方法的优点,并考虑患者的耐受风险和治疗目标。对于计划接受潜在治愈性异基因造血干细胞移植(HCT)的患者来说,完全缓解且无微小残留病很重要,而对于不接受HCT的患者,延长生存期、减少显著并发症和减少住院时间可能是目标。疾病特征应该是决策的核心。例如,对于核心结合因子或NPM1突变AML患者,通过强化诱导治疗往往可以实现治愈,而无需异基因移植。对于携带TP53突变或具有复杂或高危核型或分子特征的患者,接受强化疗的风险承受能力可能更高,无论采用何种治疗方案,这些患者的预后都很差,应该优先考虑参加临床试验。
多个研究组进行了回顾性分析,比较接受Hma-Ven治疗的患者与接受强化疗的类似患者的结果。AML真实世界证据计划比较了<75岁的患者,患者接受基于维奈克拉的低强度联合治疗或高强度化疗。该研究显示,两组的复合缓解率(61.2% vs 57.1%)和12个月总生存率(55.4% vs 55.5%)几乎相当。宾夕法尼亚大学另一项真实世界分析基于其医院和Flatiron国家数据库的电子健康数据,比较了接受CPX-351强化治疗与Hma-Ven治疗的结果。656例患者细胞遗传学风险较平衡,总生存率也没有差异。此外,桥接异基因移植的患者的生存结局也相当。两组的30天死亡率均为5%,但Hma-Ven组约20%出现感染,而CPX-351组感染发生率为50%。在当地治疗的患者亚组中,住院时间方面,CPX-351组是Hma-Ven组的两倍多。然而回顾性比较由于缺乏前瞻性随机化,容易受到选择偏倚的影响。
目前至少有三项大型、正在进行的前瞻性随机临床试验(NCT04801797;NCT05904106;NCT05939180)正在通过随机分配新诊断患者接受传统阿霉素和抗代谢药物诱导治疗或Hma-Ven诱导治疗,直接回答这个问题。第一项是目前在美国招募患者的多中心研究,纳入任何年龄的fit患者;关键排除标准包括携带FLT3突变的患者,以及年龄小于60岁且携带NPM1突变的患者;主要终点为无事件生存期(EFS)。第二项由德国研究人员开展的II期随机试验将评估Hma-Ven与传统化疗+gemtuzumab ozogamicin在新诊断NPM1突变、适合强化疗AML患者中的疗效和耐受性;终点为EFS,EFS作为终点可以让结局涵盖死亡、进展、治疗改变以及缓解后复发。表2概述了目前在ClinicalTrials.gov上注册的正在招募的随机研究。
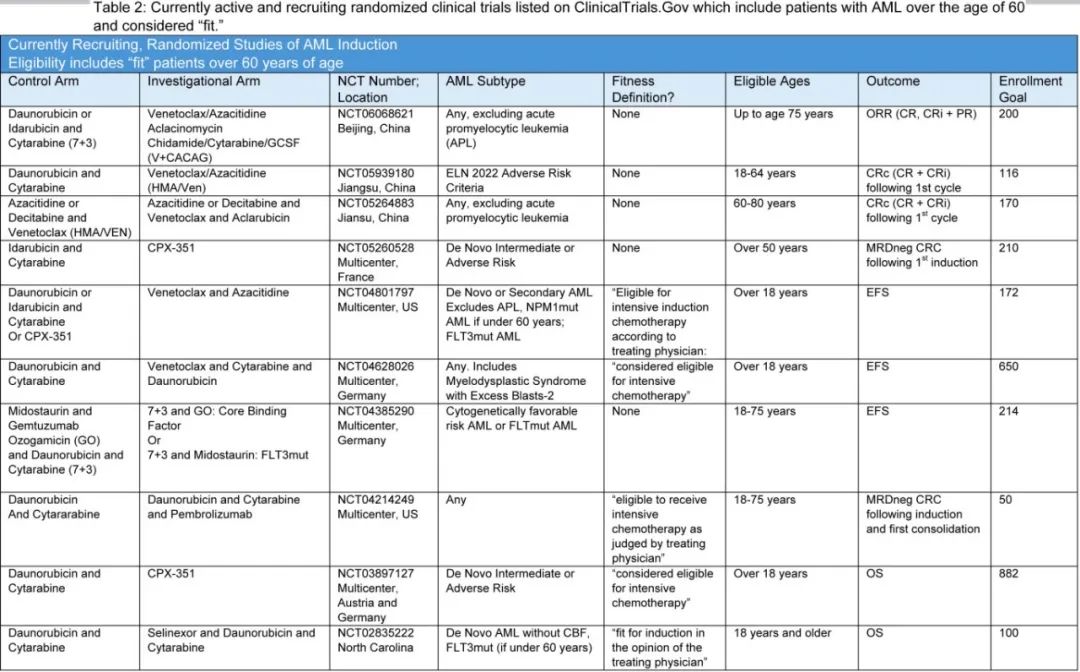
myeloMATCH平台也在开发一项针对老年fit患者的随机研究,将比较强化与非强化诱导治疗。年龄小于60岁(中危或高危)的患者随机分配到包括BCL2抑制剂与细胞毒性药物或Hma-Ven联合治疗的组别中(NCT05554393;NCT05554406)。对于老年fit患者,也讨论类似的治疗设计,可能还会根据某些分子学、细胞遗传学或历史特征进行分层。如果在没有合并症的患者中,强化和非强化方案的疗效相当,那么寻找可重复的fitness检测方法的需求可能会显著减少。
对于缓解患者,如何最好地延长生存期并减少治疗负担?
虽然诱导治疗的目标是实现缓解,但也必须努力延长长期生存并提高生活质量。ELN等风险分层标准通常用于讨论AML预后,并就HCT或其他旨在巩固缓解并提供长期生存的诱导后选择提供建议。这些标准使用细胞遗传学和分子标志物对患者进行风险分层,但多是从接受传统强化疗的年轻患者中得出的。越来越多的数据表明,接受Hma-Ven治疗的患者的预后因素可能与接受强化疗的患者不同。VIALE-A研最近进行了一项事后分析,表明根据ELN 2017标准预测的OS差异在Hma-Ven治疗中不再成立。欧洲研究人员也发表了类似的数据。最近的其他出版物也支持针对Hma-Ven诱导治疗的预期结局进行特异性风险分层。随着从试验和登记组积累的数据,或可提高非强化方案治疗成人fit患者的风险估计的精确度。
另一个挑战是更好地理解诱导终点与老年患者长期生存且生活质量良好之间的关系。几项最近的研究利用大型数据集来了解缓解状态(包括CR、CRi和CRh)的影响。完全缓解且无微小残留病通常是这种结局的最佳指标。血液学不完全恢复可能会带来感染或出血的风险以及输血负担,这在老年患者中尤为独特且具有挑战性。反复住院或高合并用药负担(例如某些靶向药物伴随的分化综合征)也可能在老年患者中出现问题,并降低生存率。
最后,必须提高老年患者接受异基因HCT的转诊率。在各种协作组研究中,与未接受异基因HCT的患者相比,在CR1(首次完全缓解)期接受移植的老年患者预后更好。此外,通过改善感染预防和移植物抗宿主病(GVHD)预防,过去十年中所有患者群体的移植相关死亡率也稳步下降。在BMTCTN 1703研究中,接受减低强度预处理的异基因移植的患者中,接受移植后环磷酰胺作为GVHD预防的一部分的患者组,移植相关死亡率为12.3%。尽管如此,在≥60岁成人中,仍有约30%转诊考虑HCT,且该比例基本保持不变。
理想情况下,对于计划接受HCT巩固治疗的患者,应开展关于最佳诱导策略的随机研究。过去,很少有接受去甲基化药物单独治疗的老年患者能够达到足够的疾病控制以进行干细胞移植。现在新型治疗方案可以达到这一终点,那么是否有更多的患者可以异基因移植巩固?诱导治疗是否仍然重要?对于这些问题,目前同样缺乏明确数据。最近由EORTC开展的一项随机研究表明,随机分配到强化疗与10天地西他滨方案的患者的总生存期相似,该研究鼓励在CR1移植。myeloMATCH将包括新型移植预处理方案的研究,并纳入各种诱导研究中缓解的患者。
在老年患者的治疗中纳入靶向药物
无论是强化治疗还是非强化治疗,只有半数老年患者获得初次缓解以及长期生存,平均生存期仍不到两年。展望未来,个性化AML治疗与增加异基因HCT可能代表着改善预后的合理途径。
近30%的新诊断AML中发现可靶向突变,针对FLT3、IDH1/2以及NPM1和KMT2A重排的靶向治疗正在一线中进行评估,无论是联合传统细胞毒性化疗,还是联合去甲基化药物-维奈克拉。例如,在一项相对小型单中心研究中,针对FLT3突变患者的阿扎胞苷/维奈克拉/吉瑞替尼三药组合在中位年龄为71岁的患者中安全给药,CRc率为96%,72%的患者至少生存18个月。在早期探索中,包括IDH1抑制剂艾伏尼布的研究,以及menin抑制剂(如revumenib)针对携带NPM1突变或KMT2A重排的患者的研究中,也报告了类似的有希望的缓解率。后续研究正在探索剂量优化,并与标准治疗进行比较。重要的是,目前没有试验将患者随机分配接受一个基石方案与另一个基石方案,也可能需要替代给药策略(正如澳大利亚多中心CAVEAT试验中所采用的,维奈克拉+阿糖胞苷+伊达比星[5+2]诱导,维奈克拉+阿糖胞苷+伊达比星巩固,维奈克拉维持)。
针对已知预后不良的突变研究新疗法也必须继续。最近对TP53突变MDS和AML进行的APR-246和抗CD47抗体magrolimab的研究显示出初步的希望,但后续研究未能证实效果。尽管如此,鉴于这种疾病亚型的预后极差,仍需继续进行严格的研究。同样,除了TP53突变疾病外,新出现的数据表明,RAS通路激活突变以及FLT3通路激活突变代表了一组对治疗没有持续反应且预后不良的患者,针对这些人群的研究至关重要。
总结
尽管今年美国将有约20000人诊断为急性髓系白血病,但该疾病仍较为罕见,使得进行大规模临床试验具有挑战性。随着越来越多的分子亚型被新药物靶向,可用于研究的患者数量必然减少;目前只有少数研究专门针对老年fit患者群体。AML研究人员必须仔细思考研究问题,这些问题不仅将惠及这一患者群体,还有助于合理设计下一代研究。
参考文献
Sameem M Abedin, Geoffrey L Uy, Laura C. Michaelis; The Fit Older Adult with Acute Myeloid Leukemia: Clinical Challenges to Providing Evidence-Based Frontline Treatment. Blood 2025; blood.2024026004. doi: https://doi.org/10.1182/blood.2024026004


