Cancer Res:中国科学技术大学张传杰等团队合作研究揭示FH缺乏肿瘤中的潜在药物靶点
时间:2025-03-09 12:08:56 热度:37.1℃ 作者:网络
延胡索酸水合酶(FH)缺乏症会导致遗传性光滑肌瘤和肾细胞癌(RCC)。FH缺乏的肿瘤缺乏有效的治疗选择。
2025年2月17日,中国科学技术大学张传杰,浙江中医药大学何强和复旦大学Li Chen共同通讯在Cancer Research在线发表题为“Chromatin Helicase CHD6 Establishes Proinflammatory Enhancers and Is a Synthetic Lethal Target in FH-Deficient Renal Cell Carcinoma”的研究论文。该研究利用一个以表观遗传学为重点的单导向RNA库,揭示了FH缺乏肿瘤中的潜在药物靶点。
筛选结果发现,染色体域解旋酶DNA结合蛋白6(CHD6)是FH突变RCC生长的一个关键调控因子。机制上,FH缺失引起延胡索酸介导的琥珀酰化作用,进而使KEAP1失活,阻止了其后续的泛素-蛋白酶体降解CHD6。稳定的CHD6与p65形成复合物,建立了促炎增强子,从而调控NF-κB介导的转录。此外,CHD6招募mSWI/SNF ATP酶,维持CHD6结合增强子区域的染色质可及性。SMARCA2/4的PROTAC降解剂AU-15330有效破坏了CHD6结合的顺式调控元件的结构,并在体内抑制了FH突变RCC的生长,而对FH正常的RCC没有影响。综上所述,这些数据表明,CHD6是FH缺失与促炎增强子组装之间的分子桥梁,赋予FH缺乏肿瘤表观遗传学易感性。

延胡索酸水合酶(FH)缺乏症肾细胞癌(RCC)是肾细胞癌中最具攻击性的类型,因其伴随有FH的胚系或体细胞缺失而被认定为RCC的独特亚型。由于其侵袭性强和高致死率,近50%的FH缺乏RCC患者在初诊时就已经出现了转移负担。靶向HIF-2α/VEGF或mTOR的系统治疗,结合免疫检查点抑制剂,针对晚期FH缺乏肿瘤的效果较差,且治疗反应因个体差异而不同。因此,有效的治疗拮抗剂非常有限,而延胡索酸所引起的肿瘤发生机制尚不明确。
已有研究表明,FH缺失会导致延胡索酸积累,进而引发肿瘤代谢效应、HIF激活以及通过NRF2激活的抗氧化反应。目前有报道指出,FH缺失还会引起慢性炎症反应,并且在FH缺乏的RCC中,白细胞的贡献明显高于正常组织及其他类型的RCC。然而,具体的分子机制仍不清楚。代谢和表观遗传机制之间的异常相互作用使RCC获得恶性肿瘤标志物,并塑造肿瘤微环境(TME)的免疫异质性。消除表观遗传易感性在特定的遗传背景下会产生合成致死效应。
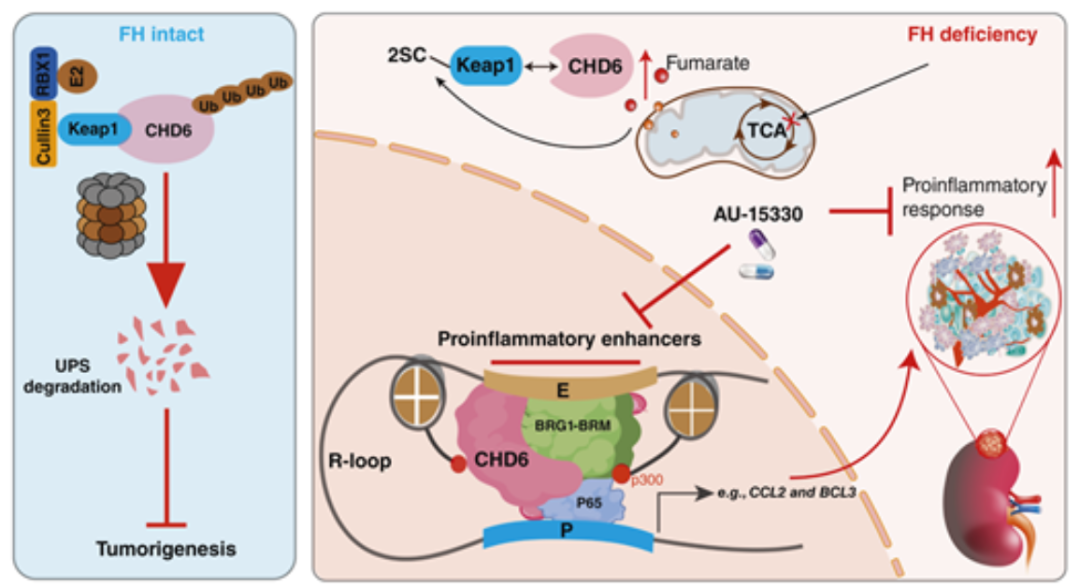
模式机理图(图片源自Cancer Research)
染色体域解旋酶DNA结合蛋白(CHD)家族是一个重要的重塑酶家族,参与调控在各种压力下的DNA可及性和转录活动。最近研究发现,在九个CHD酶成员中,CHD6在多种恶性肿瘤(如前列腺癌和结直肠癌)中促进肿瘤进展。在这项研究中,作者利用无偏的表观遗传CRISPR/Cas9策略揭示了FH与CHD6在RCC中的合成致死关系。
机制上,FH缺失通过延胡索酸介导的Keap1琥珀酰化作用积累了CHD6蛋白,阻断了随后的泛素-蛋白酶体降解通路。CHD6蛋白的升高驱动了促炎激活,进而促进FH缺乏RCC的进展。重要的是,作者揭示了CHD6组装的超级增强子(SEs)是FH突变肿瘤的新型表观遗传易感性,且在多种临床前模型中表现出有效的靶向性。
原文链接:
https://doi.org/10.1158/0008-5472.CAN-24-0787


