综述:侵袭性B细胞淋巴瘤的分类
时间:2025-02-25 12:10:40 热度:37.1℃ 作者:网络
侵袭性B细胞淋巴瘤
侵袭性 B 细胞淋巴瘤是一组生物学和临床上非常异质性的肿瘤,可能与 B 细胞分化发展的不同阶段有关。《Advances in Anatomic Pathology》近日发表综述,总结了近年来对侵袭性 B 细胞淋巴瘤的认识进展,重点介绍诊断侵袭性肿瘤的实用方法。分析了侵袭性B细胞淋巴瘤不同亚型的定义特征,包括淋巴结和结外弥漫性大B细胞淋巴瘤、病毒相关淋巴瘤、终末分化B细胞淋巴瘤、高级别B细胞淋巴瘤和伯基特(Burkitt)淋巴瘤。还特别探讨了形态学、免疫表型和遗传数据的整合,旨在改进诊断准确性和预后分层,也强调了在临床实践中实现标准化的必要性。

引言
侵袭性B细胞淋巴瘤是最常见的B细胞淋巴瘤,代表着一组异质性的恶性肿瘤,其形态和表型特征、遗传异常、临床表现和预后各不相同。准确和及时的诊断对于有效的患者管理至关重要,因为不同亚型之间的治疗选择和预后可能存在显著差异。
成熟淋系肿瘤的国际共识分类 (ICC) 反映了分子遗传学和免疫表型的最新进展,并为这些恶性肿瘤的诊断提供了全面框架,为病理学家区分不同实体提供了实用指导。该综述的重点是利用 ICC 建立的最新标准,在日常临床实践中诊断侵袭性 B 细胞淋巴瘤的实用方法。这些肿瘤的生物学特征可能与B细胞分化过程中卵泡生发中心、暗区和亮区、终末分化等不同阶段有关(图1)。
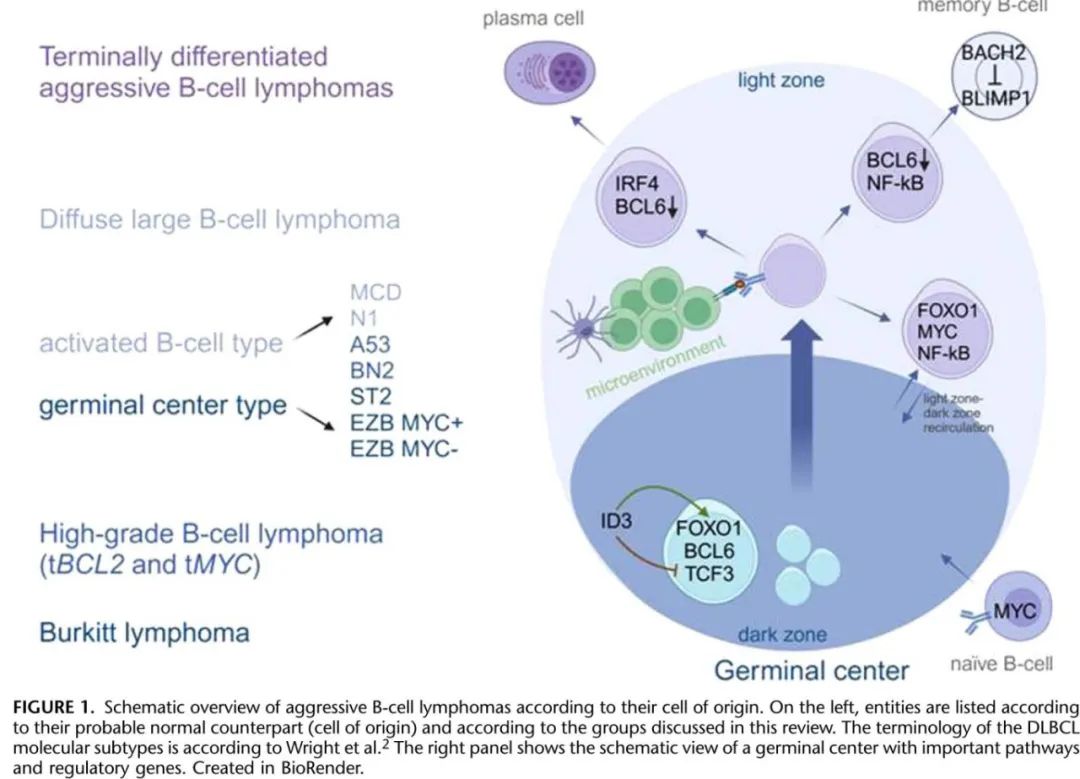
该综述讨论的关键实体主要分为淋巴结或结外弥漫性大 B 细胞淋巴瘤 (DLBCL)、EB病毒 (EBV) 和人类疱疹病毒8型 (HHV8) 相关大 B 细胞淋巴瘤、伴有终末 B 细胞分化的大 B 细胞淋巴瘤、高级别 B 细胞淋巴瘤 (HGBL) 和 Burkitt 淋巴瘤(表1)。

上述实体每个都有独特的诊断挑战,需要整合组织病理学、免疫表型、基因检测和临床数据的多学科方法。该综述的目的是为病理学家提供一个清晰、实用的指导,以应用当前的诊断标准来诊断这些侵袭性B细胞淋巴瘤,并强调了有助于分类的关键形态学和分子特征。
淋巴结为主型弥漫性大B细胞淋巴瘤
弥漫性大 B 细胞淋巴瘤,非特指型
弥漫性大 B 细胞淋巴瘤,非特指型 (DLBCL-NOS) 是一种异质性疾病,具有不同的形态、表型、分子和基因组变异和亚型,且这些异质性的临床意义仍是一个不断发展的研究领域。DLBCL-NOS是世界上最常见的成人淋巴瘤(占所有淋巴瘤的30%至40%)。大多数患者表现为淋巴结受累,但结外病变也不少见。结外LBCL在特定部位可能对应不同的疾病,将在下一节进一步描述。
形态学和表型
DLBCL由大B细胞组成,其细胞核大小与巨噬细胞相同或大于巨噬细胞或静止淋巴细胞的两倍以上,呈弥漫性生长模式,无其他特异性实体的特征。在细胞学上,DLBCL可分化为中心母细胞、免疫母细胞和间变性变体;这些变异与临床治疗无关,但在其他淋巴瘤的鉴别诊断中很重要。大多数病例为de novo,但从惰性小B 细胞淋巴瘤转化也较为常见,在DLBCL周围可以观察到惰性淋巴瘤(如滤泡性淋巴瘤[FL]或慢性淋巴细胞白血病[CLL])的残留物(图2)。
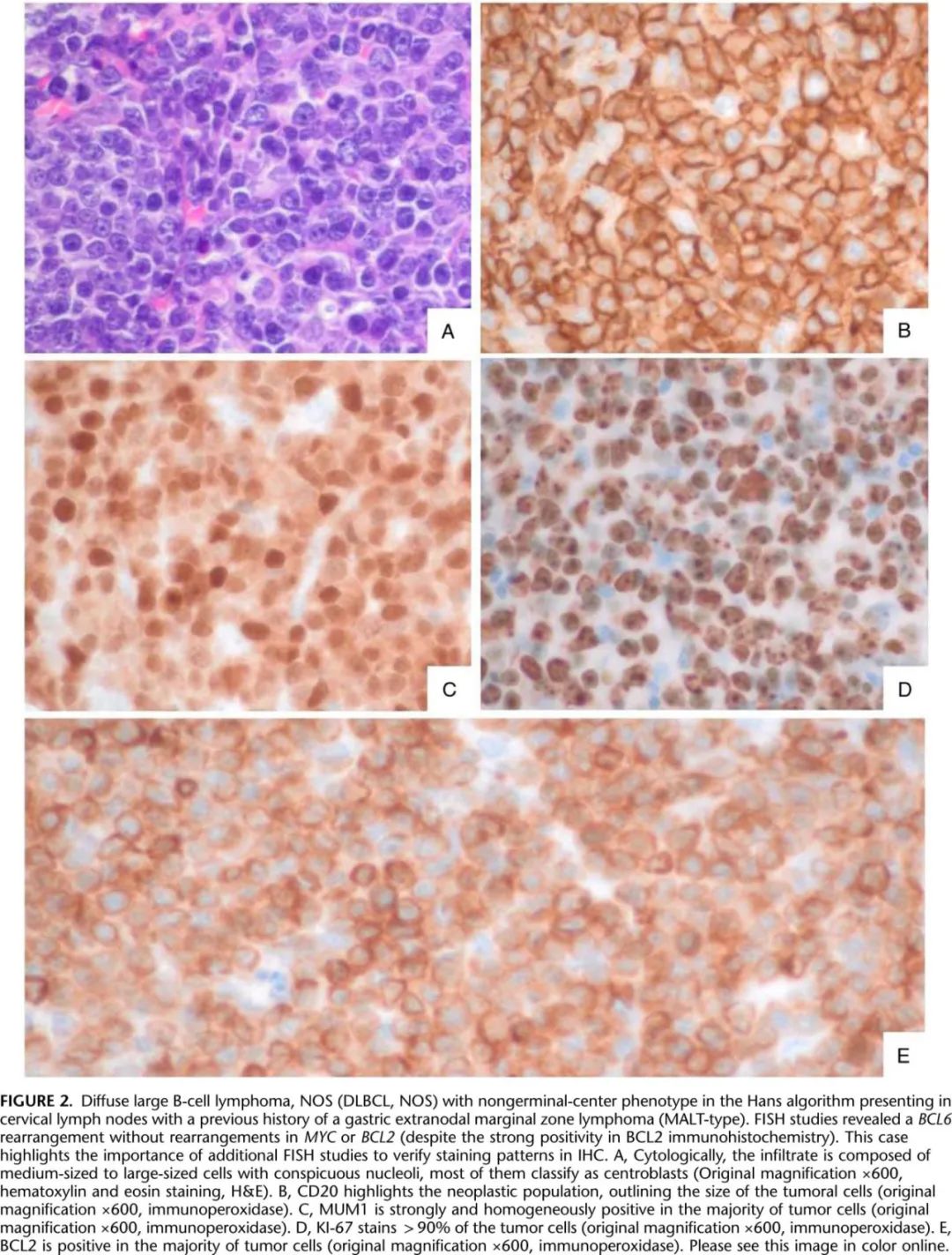
免疫表型的可变性反映了DLBCL-NOS的异质性。泛B细胞标志物(CD20、CD79a、CD19和PAX5)通常呈弥漫性阳性。在利妥昔单抗治疗后,CD20可能呈阴性或仅呈异质性阳性,在这种情况下应检测额外的B细胞标志物。需要CAR-T 细胞治疗的患者应检测CD19,且治疗后可能丢失。部分病例可能异常地共表达 T 细胞标志物。在高达15%的 DLBCL 中报告了 CD5 阳性,这些肿瘤需要通过整合临床病理学数据与 Richter 转化 (RT) 或多形性套细胞淋巴瘤 (MCL) 仔细鉴别。其他 T 细胞标志物(CD8、CD7、CD3和CD2)可能在高达10%的 DLBCL 中表达,但共表达>1个 T 细胞标志物非常罕见 (1%)。仅 CD5 表达与不良预后相关,但可能是由于其与活化 B 细胞 (ABC) 分子亚型相关。
细胞周期蛋白 D1 在1%-2%的 DLBCL 中可能呈阳性,但通常无潜在基因重排;这些病例通常为 CD5 和 SOX11 阴性。有趣的是,部分表达细胞周期蛋白 D1 的 DLBCL 也可能携带 CCND1 重排,从而需要鉴别诊断多形性 MCL。与 MCL 不同,这些病例通常携带BCL6、BCL2或 IRF4 的其他易位,可能有小 B 细胞淋巴瘤转化的证据,如边缘区淋巴瘤 (MZL) 或FL,具有与 DLBCL 而非 MCL 相似的突变特征,且CCND1重排似乎是由IG重链切换或体细胞超突变介导的次要事件,而非像MCL中看到的异常V(D)J重排。15%-25%的患者表达CD30,尤其是间变性形态的情况下。Ki67增殖率经常升高 (30%~80%) 但并非考虑高级别淋巴瘤诊断的标准。MYC和 BCL2 的表达可变,介于10%-60%和50%-80%,并且与他们各自的易位无关,易位只出现在5%到15%的肿瘤中。部分 DLBCL 表现出MYC(在 >40%的肿瘤细胞中表达)和BCL2(在 >50%的肿瘤细胞中表达)的同时免疫组化表达,而没有潜在易位;该组患者称为双蛋白表达,与不良预后相关,但并非单独的分类类别,因为该现象似乎与ABC亚型或TP53改变等多种因素相关。
分子亚型:起源细胞
基因表达谱(GEP)研究已经确定了DLBCL的2种分子亚型,其表达特征与生发中心细胞(GCB样)和活化B细胞(ABC样)相关。使用基因表达方法,约50%-60%的病例分可类为GCB-DLBCL,30%-40%为 ABC-DLBCL,约10-20%的 DLBCL无法分类。这两种主要亚型在分子发病机制上存在差异,GCB-DLBCL主要依赖于PI3K/AKT/mTOR通路,而ABC-DLBCL主要依赖于NFκB激活。根据起源细胞 (COO) 进行区分具有临床意义,因为 ABC-DLBCL 与 GCB-DLBCL 相比显示预后不良。鉴于基于 mRNA 的检测具有局限性,免疫组化 Hans 算法是最常用的 DLBCL COO 分类方法。CD10、BCL6和MUM1的cutoff均为30%,当肿瘤在没有MUM1的情况下表达CD10或BCL6时,将肿瘤归类为GCB DLBCL;当肿瘤同时为CD10和BCL6阴性或在没有CD10的情况下表达MUM1时,将肿瘤归类为non-GCB DLBCL。
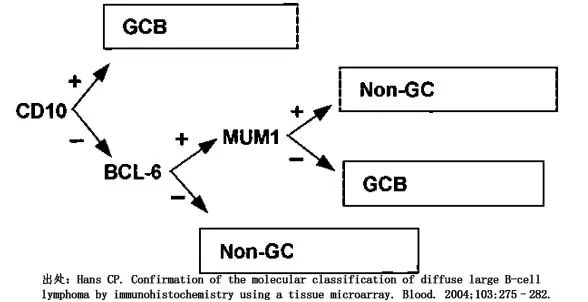
尽管基于GEP和基于IHC的DLBCL亚型具有相关性,但IHC方法的结局预测似乎更具争议性。IHC算法无法识别不可分类的 GEP 肿瘤。此外,此外,表达CD10和MUM1的肿瘤可能对应不同的实体,如LBCL伴终末B细胞分化(如浆母细胞淋巴瘤分化)或LBCL伴IRF4易位;在这种情况下建议评估其他标志物和IRF4易位。DLBCL的COO亚分类提供了重要的生物学信息,但似乎仅限于捕获DLBCL的广泛异质性。ICC建议通过GEP或IHC进行DLBCL的COO分型,并应认识到后者的局限性。
遗传学和基因组亚型
DLBCL中最常见的结构重排为BCL2(18q21)、BCL6(3q27)和MYC (8q24),发生率分别为约20%-30%、30%和5%-15%的。最常见的伴侣为IG基因,特别是MYC和BCL6,但其他伴侣也经常报道。强烈建议对结构变异进行检测,因为这可能意味着诊断的改变,而免疫组织化学标记不够敏感,也不够特异性,无法捕获这些改变。
近期的研究已经确定DLBCL-NOS的5至7个基因组亚群(表2)。
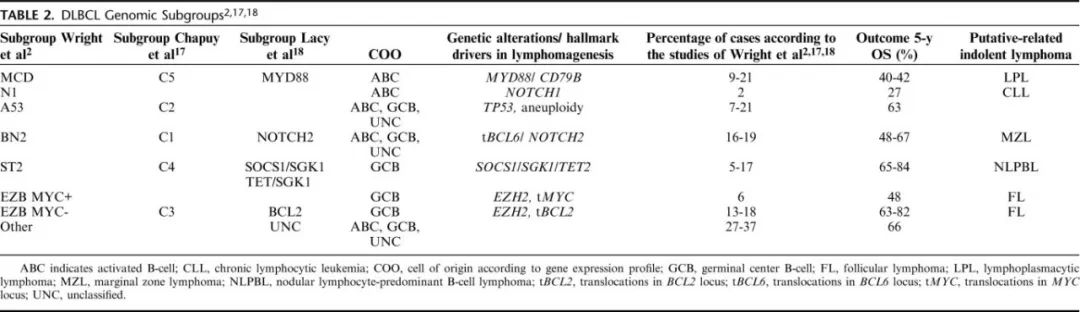
尽管以不同的方式进行分类,但分类的结果相似。MCD/C5/MYD88类型包括MYD88和CD79B频繁突变的non-GCB/ABC样DLBCL,并表现出B细胞受体和NF-κB信号的激活;病例包括大多数结外DLBCL和免疫豁免部位DLBCL(见结外DLBCL部分)。N1是一种罕见的NOTCH1突变亚型,预后不佳。A53/C2是TP53、CDKN2A、RB1和非整倍体频繁突变的一个亚群;有趣的是该亚型的ABC-DLBCL的预后比GCB-DLBCL差。BN2/C1/NOTCH2亚型常见NOTCH2和SPEN突变以及BCL6易位。COO具有异质性,可能与MZL转化相关。ST2/C2 DLBCL是没有BCL2易位的GCB-DLBCL,其特征为SGK1和JAK-STAT通路突变(STAT3,SOCS1);突变谱与结节性淋巴细胞为主型B细胞淋巴瘤(NLPBL)相似。EZB/C3组可分为MYC+和MYC−;两组均表现出BCL2改变(易位和突变)、表观遗传调控因子的改变(包括EZH2激活),以及KMT2D、CREBBP、EP300和ARID1A的失活,因此具有FL的突变特征。可能还存在MYC易位,其预后较差。这些病例显示GNA13、DDX3X和FOXO1突变,以及在BL和MYC和BCL2重排的高级别B细胞淋巴瘤(HGBL-MYC/BCL2)中描述的生发中心“暗区”转录特征。虽然不同的肿瘤类别在3个系统中有重叠,但Wright等人的建议中仍有很大比例的病例无法分类(仅有约45-50%可分类),而在其他模型中所有肿瘤都可以分类,表明各分类标准存在较大差异。
富于T细胞/组织细胞大B细胞淋巴瘤
富于T细胞/组织细胞大B细胞淋巴瘤 (T-cell/Histiocyte-rich Large B-cell Lymphoma,TCRBCL) 是一种侵袭性肿瘤,在中年男性患者中占优势,多累及肝脏和脾脏。大多数肿瘤为de novo,但进展自结节性淋巴细胞为主型 B 细胞淋巴瘤 (NLPBL)也有报道。NLPBL具有丰富的肿瘤微环境(TME),类似于经典型霍奇金淋巴瘤(CHL),但关键区别在于肿瘤细胞维持在CHL中下调的B细胞程序,因此被ICC重新命名。
TCRBCL表现为大而非典型的细胞,细胞质宽而苍白,与NLPBL的淋巴细胞优势(LP)细胞(所谓的爆米花[popcorn]细胞)相似,TME由小T细胞和丰富的组织细胞组成。以弥漫性生长为主的TCRBCL和NLPBL的鉴别较为困难,检测TME可能会有所帮助。肿瘤细胞表达CD20、CD79a和PAX5。其他阳性标志物有BCL6、MEF2B、OCT2和EMA。CD21和CD23染色的滤泡树突状细胞(FDC)可用于NLPBL的鉴别诊断,因为背景中FDC的结节网通常(至少局部)保留在NLPBL中。TCRBCL几乎没有小B细胞,TME中主要是T细胞和组织细胞,而NLPBL中仍然存在小B细胞。反复突变的基因与NLPBL相同,包括JUNB、DUSP2、SGK1和SOCS1,进一步支持了这些实体的关系。
伴11q异常的的B细胞淋巴瘤
伴11q异常的大B细胞淋巴瘤是儿童和年轻成人中最常见的淋巴瘤,表现为局部淋巴结受累,标准免疫化疗下预后良好。部分病例存在免疫缺陷。这些肿瘤的细胞学可能可变,细胞大小为中到大,不像BL中那样单调,更接近DLBCL,或介于DLBCL和BL之间。肿瘤细胞表达泛B细胞和生发中心标志物,如CD10、BCL6和LMO2(50%的病例),而BCL2表达不常见。除了在常规实践中FISH检测到的11q端粒远端丢失和近端增加外,肿瘤的遗传格局更类似于DLBCL而非BL,具有BTG2、DDX3X、ETS1、EP300和GNA13突变,而始终缺乏MYC重排和BL中描述的突变,如ID3、TCF3和CCND3.24。仅11q端粒丢失的肿瘤是否属于该疾病仍有争议。
结外弥漫性大B细胞淋巴瘤
部分DLBCL 起源于结外部位,其临床和生物学特征与主要表现为淋巴结的患者有所不同。这组肿瘤包括 ABC 亚型的几种结外DLBCL、原发性纵隔 B 细胞淋巴瘤、纵隔灰区淋巴瘤和临时实体人类疱疹病毒8型 (HHV-8) 和 EB 病毒 (EBV) 阴性原发性渗出型淋巴瘤(primary effusion lymphoma)。
ABC亚型结外弥漫性大B细胞淋巴瘤
最近的基因组研究揭示了起源于不同结外部位的 DLBCL 的分子相似性,例如原发性中枢神经系统DLBCL (PCNSL)、原发性睾丸DLBCL、原发性皮肤DLBCL-腿型和血管内大 B 细胞淋巴瘤。这些肿瘤大多数为 MCD/C5/MYD88 基因组亚型的non-GCB/ABC-DLBCL,MYD88 和 CD79a经常发生突变。然而根据受累部位,它们也具有特殊的临床和生物学特征,支持将其作为单独的临床病理学实体。应仔细审查这些结外 DLBCL 的临床病理学数据,特别是如果已知其他受累部位或表型特征不一致,如 GCB 表型或EBV+,因为这些结外部位也可能发生其他 DLBCL 亚型。
PCNSL 和原发睾丸 DLBCL 是非常密切相关的实体,具有 MCD/C5/MYD88 亚组突变和参与免疫逃逸的基因(如 PD-L1 和PD-L2)遗传变异,可能与其免疫豁免部位起源有关。PCNSL可能在睾丸中复发,反之亦然。玻璃体视网膜淋巴瘤认为是PCNSL的一种变体,但由于诊断材料非常稀缺,并且与葡萄膜炎的鉴别经常需要进行克隆和/或突变的分子检测,因此诊断起来特别困难。原发性皮肤DLBCL-腿型优先累及大多数老年患者的下肢。血管内大 B 细胞淋巴瘤显示毛细血管和小血管内肿瘤细胞的特殊生长,偶尔外渗到周围组织;由于多器官受累,症状可能变化很大,病程进展迅速;部分累及骨髓和肝脾的患者也可能出现噬血细胞综合征;总生存率很低。有广泛组织浸润的病例应归为伴血管浸润的DLBCL。
人类疱疹病毒8阴性和 EB 病毒阴性原发性渗出型淋巴瘤
HHV8 阴性和 EBV 阴性原发性渗出型淋巴瘤是一种临时疾病,主要发生于没有HIV感染或其他免疫缺陷的老年男性,其特征为在导致液体过载且没有肿瘤肿块形成的情况下,腔积液中存在大量非典型成熟B细胞。肿瘤细胞表达至少一种成熟 B 细胞标志物(CD20、CD79a和CD19)。大多数病例 (79%) 为non-GCB 表型,浆细胞标志物及 EBV 和 HHV8 感染均为阴性。全球范围内均有描述,但在东亚(日本)更常见。预后优于原发性渗出型淋巴瘤 (PEL)。应将具有相似表现的 EBV 阳性 LBCL 从该类别中排除,因为这些通常是与免疫抑制相关的侵袭性淋巴瘤,最好归类为 EBV 阳性DLBCL。
原发性纵隔B细胞淋巴瘤
原发性纵隔b细胞淋巴瘤(PMBL)是一种罕见肿瘤,通常表现为纵隔肿块,多发生于年轻女性。组织学方面,肿瘤由弥漫性生长的中型至大型肿瘤细胞组成,具有丰富的苍白细胞质。背景中常可见纤维化,以及数量不定的反应性淋巴细胞、组织细胞和粒细胞。肿瘤细胞表现出成熟的B细胞程序,表达泛B标志物(CD30、CD23和MAL,可变,介于弱阳性到强阳性)。分子谱分析显示激活NF-κB(例如REL、TNFAIP3和NFKBIE)和JAK-STAT(例如SOCS1、STAT6)通路并促进免疫逃逸(例如 CIITA 失活、CD58、PD-L1、PDCD1LG2)的基因存在复发性改变。这些分子改变与 CHL 中观察到的相似,支持这些实体之间存在生物学关系。
术语灰区淋巴瘤指LBCL 和 CHL 之间表现出重叠特征的肿瘤。目前的概念是将纵隔灰区淋巴瘤 (MGZL) 与纵隔外肿瘤分开,因为后者表现出不同的临床、病理和分子特征,应分类为DLBCL-NOS,或在 EBER 表达的情况下分类为 EBV 阳性 DLBCL(图3)。MGZL的诊断需要满足形态学和表型标准才能排除 CHL 的诊断,例如高肿瘤细胞密度和表达至少2种 B 细胞标志物。典型的CHL TME由淋巴细胞、巨噬细胞、树突状细胞和嗜酸性粒细胞组成,CD20异质阳性病例应诊断为CHL。
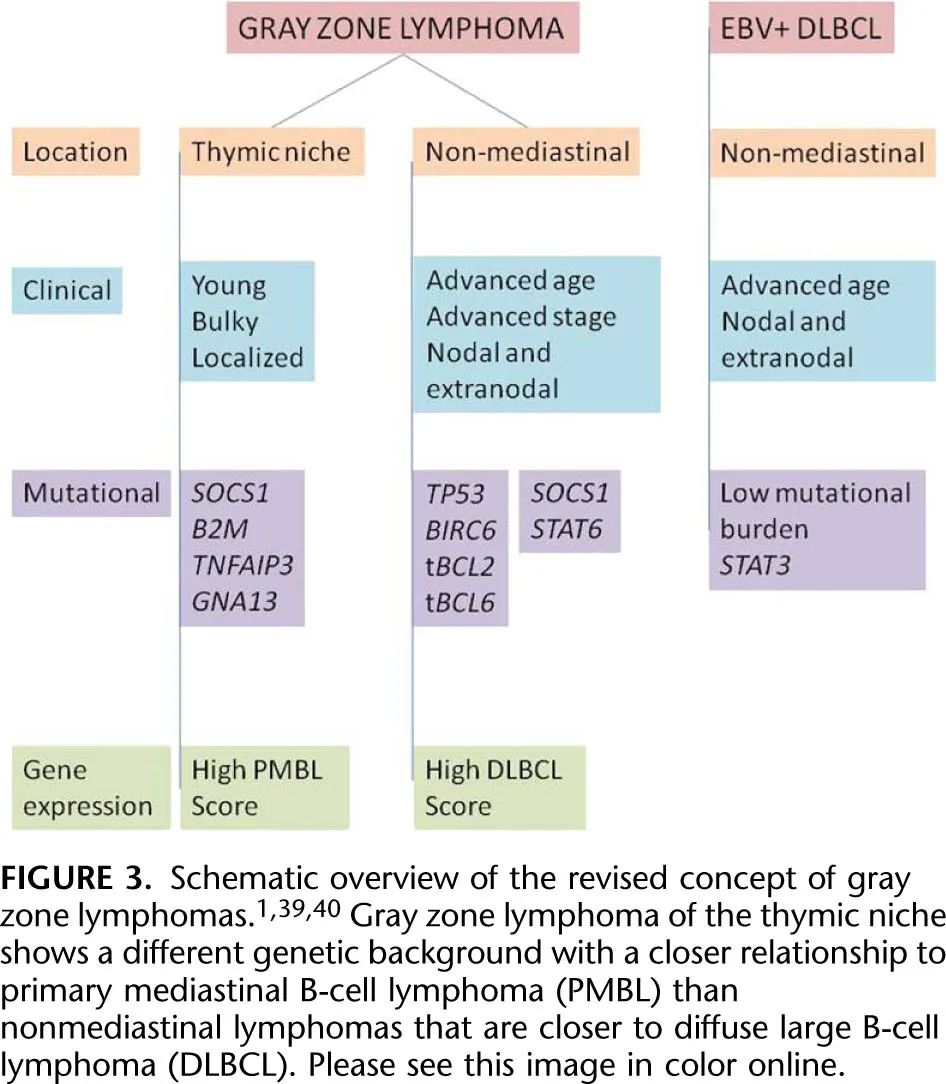
EB病毒相关大B细胞淋巴瘤
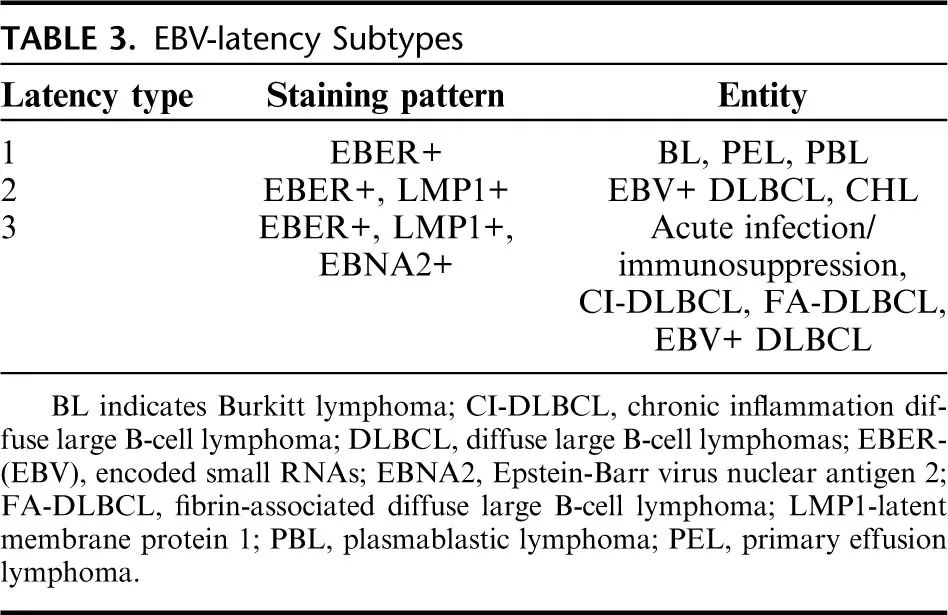
侵袭性淋巴瘤的多种亚型与 EBV 感染有关。病毒检测最常用的检测方法是对病毒的EBER小非编码RNA(EBER-ISH)进行原位杂交。推荐通过EBNA2和LMP1染色对病毒潜伏期进行免疫组化检查,因为它可以提供关于患者免疫状态的进一步信息,并有助于鉴别诊断(表3)。
EBV 阳性DLBCL-NOS(EBV+ DLBCL) 是一种年龄范围较广的疾病,在老年患者中尤其常见,但也可发生于儿童和免疫缺陷患者。根据定义,>80%的肿瘤细胞应为 EBER-ISH 阳性。形态学介于单形态到多形态,具有不同的炎症背景和偶尔的坏死区域。部分病例存在THRLBCL样模式,主要发生于年轻患者。与EBV阴性DLBCL相比,老年患者的总生存率较低。EBV+ DLBCL表达成熟B细胞标志物,并且更常为non-GCB表型及表达MUM1。在某些情况下鉴别诊断CHL可能具有挑战性,因为大多数病例为CD30阳性,但CD15不常表达。此外,B细胞标志物的强表达可将EBV+ DLBCL与CHL区分开来。EBV潜伏期通常为2型,表达LMP1,EBNA2阴性。
伴有慢性炎症的DLBCL (CI-DLBCL)及其亚型纤维蛋白相关DLBCL (FA-DLBCL),具有良好预后,但仍属于不同实体。大多数CI-DLBCL和FA-DLBCL表现为EBV潜伏期3型,但也有EBV阴性病例的报道。
终末分化大B细胞淋巴瘤
部分LBCL表达终末分化B细胞表型,伴成熟B细胞标志物(CD20、CD79a和PAX5)下调,浆细胞相关抗原(如MUM1、CD138、BLIMP1),偶尔表达EMA和XBP1。这些肿瘤大多出现在免疫缺陷的背景下,除了免疫能力强的患者中发生的ALK阳性LBCL外,EBV和/或HHV8感染多为阳性。
间变性淋巴瘤激酶(ALK)阳性大B细胞淋巴瘤
ALK 阳性 LBCL 是一种主要发生于中年男性患者的侵袭性淋巴瘤,预后不佳,中位生存期为12.2个月。形态学上,大多数肿瘤呈弥漫性生长模式,具有免疫母细胞或单形性大细胞形态。EBER-ISH 为阴性,偶见 CD4 表达。ALK表达是定义性特征,它基于ALK易位,最常见的是CLTC::ALK。ALK易位的其他伴侣也有报道。肿瘤经常表达IgA、EMA和磷酸化STAT3,后者可能与ALK激活有关。CD30为阴性。ALK抑制剂已与化疗联合使用。
浆母细胞淋巴瘤
浆母细胞淋巴瘤 (PBL) 主要发生于免疫缺陷患者,最常见的是HIV,但也见于移植后、医源性或免疫衰老的老年患者,偶见于儿童。大多数病例表现为结外受累(口腔、胃肠道),并有侵袭性临床过程。肿瘤由成片的大细胞组成,呈浆母细胞性外观。坏死和核碎裂较常见,星空模式很重要。约75%为 EBV 阳性,伴潜伏期I型(表3)。除终末分化表型外,部分肿瘤还可能为 CD56 或 CD10 阳性。与髓外浆母细胞性骨髓瘤的鉴别具有挑战性。尽管有重叠特征的患者报道,但免疫缺陷、EBV阳性和无骨病变倾向于PBL。50%-75%的HIV阳性患者存在 MYC 重排及随后的细胞周期失调,而在 HIV 阴性患者中略低。PBL 的基因组复杂性较高,涉及MAPK、JAK/STAT和NOTCH通路的激活改变,STAT3、SOCS1、NRAS、TP53、MYC和 EP300 存在复发性突变。EBV+ PBL中JAK/STAT通路基因改变更常见;与 EBV-PBL 相比,这些肿瘤显示出不太复杂的核型,TP53突变较少,预后较好。
人类疱疹病毒8型相关淋巴增生性疾病
该组肿瘤包括多种惰性和侵袭性疾病,如HHV8生发性LPD、HHV8阳性DLBCL-NOS、PEL和腔外PEL。偶尔的病例可能在这些实体之间有重叠的特征,导致精准诊断较为困难。这些肿瘤大多发生于免疫缺陷患者,但也可能发生于免疫功能正常的个体,尤其是老年人。
HHV8 阳性 DLBCL 是一种大细胞淋巴瘤,常见于淋巴结和脾脏,在多中心 Castleman 病 (MCD) 背景下偶尔累及外周血,但并非总是如此。肿瘤细胞类似于浆母细胞或免疫母细胞,CD20、MUM1、CD45、IgM和λ轻链限制性阳性,而 CD138 为阴性。EBV 通常为阴性。与 MCD 中偶尔观察到的浆母细胞扩增相反,IGH呈克隆性重排,未显示体细胞超突变。
PEL 和腔外 PEL 最常见于 HIV 阳性个体,其他免疫功能低下患者较少发生,并且与不同的临床病理学特征相关。肿瘤细胞较大,具有不同的免疫母细胞性、浆母细胞性或间变性形态,表达终末 B 细胞分化标志物(MUM1、EMA、CD138和CD38),而成熟 B 细胞抗原(CD20、CD79a或PAX5)为始终阴性。CD45和 CD30 为阳性,部分病例可表达CD4,HHV8 LANA-1潜伏膜蛋白为阳性。大多数(但并非所有病例)存在潜伏期I 型EBV。克隆重排的 IGH 携带体细胞超突变。已报告BCL6、MYC、PAX5和 RhoH/TTF 突变和复杂核型,但不存在 TP53 突变和 MYC 易位。也有报道 B 细胞和 T 细胞受体重排的双表型病例。
高级别B细胞淋巴瘤
HGBL 包括3种侵袭性成熟淋巴肿瘤亚型,具有一些相同的形态学特征,但基因改变有所不同(表1)。ICC根据MYC和BCL2或BCL6重排的存在分为两种亚型,而没有双重基因打击的肿瘤定义为HGBL-NOS。携带 MYC 伴 BCL2 或 BCL6 重排的肿瘤应分为2类,诊断这些肿瘤的一个关键要素在于鉴定MYC、BCL2和 BCL6 重排(通常通过 FISH);但如何使用不同探针的策略值得商榷。免疫组化可用于选择具有 GCB 表型的肿瘤,因为几乎所有 HGBL-MYC/BCL2 和50%的 MYC/BCL6 均具有该表型。MYC 和 BCL2 表达对于相应 FISH 探针的选择没有用处,合理的方法是从 MYC 分离试验开始,如果为阳性,则继续使用 BCL2 和 BCL6 分离探针。然而仅使用 MYC 分离探针可能会遗漏4-12%的病例,因此IGH::MYC融合探针的额外使用可降低假阴性率。
伴 MYC和BCL2 重排的高级别B细胞淋巴瘤
伴有MYC 和 BCL2 重排的 HGBL(HGBL-MYC/BCL2) 是一种预后不良的高度侵袭性肿瘤。伴 MYC和 BCL2 重排的1-3A级 FL仍应归类为FL。具有表达TdT和CD34的母细胞形态的罕见白血病肿瘤应考虑为伴有这种双重易位的急性淋巴细胞白血病。HGBL-MYC/BCL2的形态可能随DLBCL、母细胞或BL与DLBCL之间的细胞学特征而变化,这一点应在报告中予以认识。HGBL-MYC/BCL2似乎主要来源于生发中心暗区细胞,表达B细胞和生发中心标志物,特别是表达CD10伴MUM1阴性, Ki67增殖率高。MYC和BCL2通常在40%的细胞中呈阳性,但在某些情况下MYC可能较弱,存在于较少的细胞中。TdT可能在某些病例呈阳性,但CD34为阴性。从遗传学上讲,这些肿瘤通常具有复杂核型和在FL中也观察到的基因突变,如BCL2、CREBBP、EZH2和TNFRSF14,并结合在BL中也存在的突变基因,如ID3、CCND3和FOXO1。在大约25%到30%的病例中观察到TP53突变。
伴 MYC 和BCL6 重排的高级别B细胞淋巴瘤
伴BCL6重排的HGBL (HGBL-MYC/ BCL6)是一个不太好的描述类别,可能是因为这种淋巴瘤实体的稀缺性(占DH/TH淋巴瘤的10%至20%)。预后和临床结局的数据存在争议,但有研究表明结外表现比DLBCL更频繁、预后更差。与HGBL-MYC/BCL2类似,形态学可变,但DLBCL模式比母细胞样或中间型更普遍(80%的病例)。肿瘤表达成熟的B细胞标志物,具有GCB或non-GCB表型,分布相似。BCL6呈强阳性,40%至90%的病例可能存在MUM1。FISH分析可以检测到MYC和BCL6的易位,其特点是在高达30%的病例中,MYC可能与BCL6作为伴侣重排,而不涉及IG基因。有研究表明,具有这种“伪”双打击的肿瘤可能比具有MYC和BCL6独立重排的肿瘤有更好的预后。HGBL-MYC/BCL6的异质性进一步得到了以下事实的支持:在DLBCL分子算法中,这些病例中的一部分归为EZB淋巴瘤,而另一些则被归为BN2亚型。TP53突变的频率低于HGBL-MYC/BCL2。基于这些结果,ICC将HGBL-MYC/BCL6维持为临时独立实体。
高级别B细胞淋巴瘤,非特指型
HGBL-NOS是一个应严格使用的类别,包括母细胞样或中度伯基特样形态,没有双打击MYC/BCL2或MYC/BCL6。其中部分病例可能只有MYC重排,分子背景似乎为异质性。需要更多的研究来阐明这些肿瘤的分类。
伯基特淋巴瘤
BL 是一种侵袭性肿瘤,多发于儿童和年轻人。主要有3个流行的变体:散发型(sBL)、地方型(eBL)和免疫缺陷相关型(iBL)(表4)。地方型 BL 主要见于撒哈拉以南和南美洲赤道地区。免疫缺陷相关型最常见于获得性免疫缺陷综合征(AIDS)。
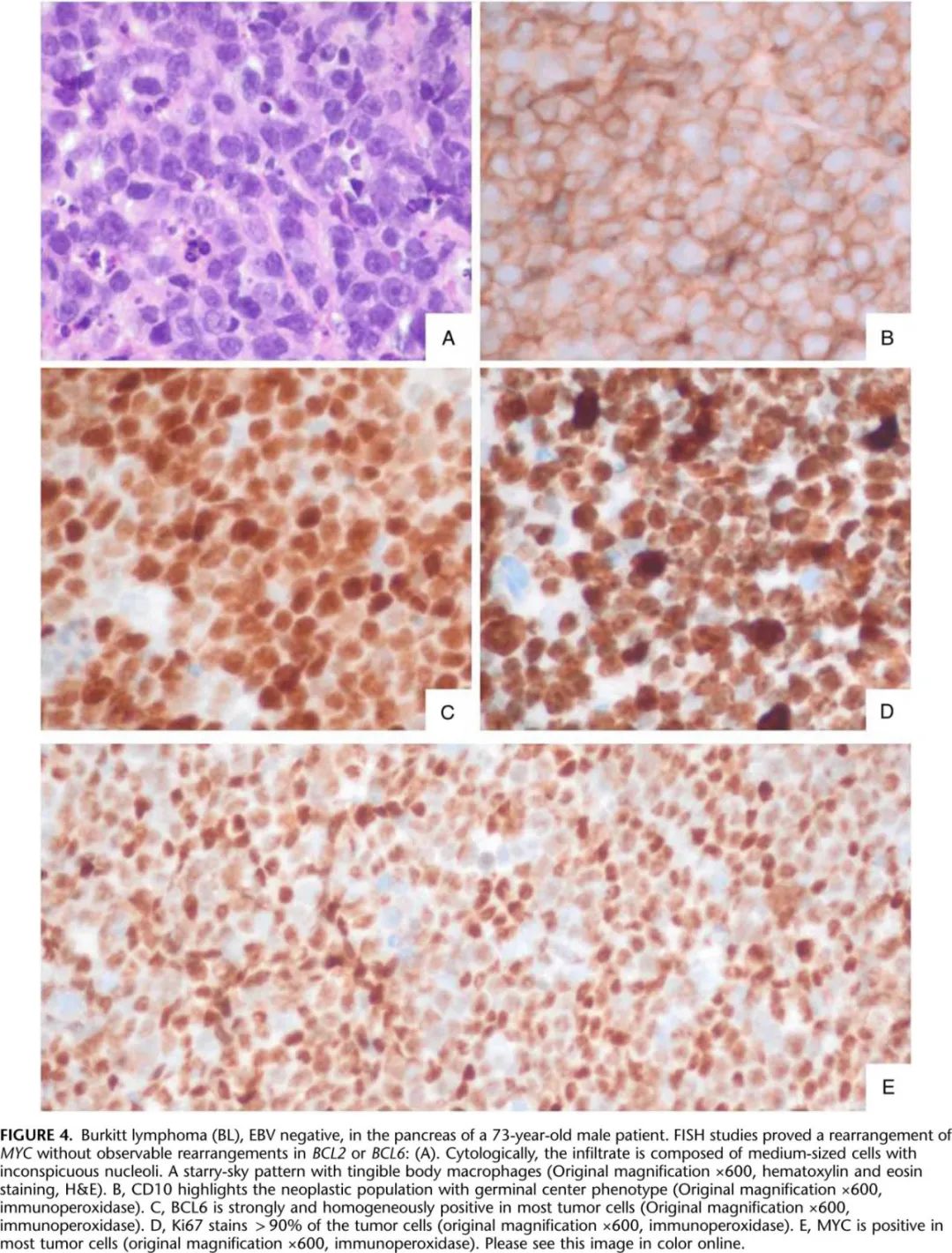
形态学上,BL表现为中等大小肿瘤细胞单调弥漫性生长,核仁不明显,有丝分裂频繁,呈星条形(图4)。BL是一种生发中心源性肿瘤,表达CD20、BCL6和CD10。Ki67检测到的增殖率非常高。BCL2通常为阴性,TdT为阴性。EBV的表达频率取决于变体(表4)。SOX11在约30%的病例中呈阳性,主要是EBV阴性。部分病例中MUM1可能呈阳性。
BL的分子标志是MYC易位与免疫球蛋白的位点,最常见的是IGH(80%),其次是IGK或IGL。经常发生突变的基因有ID3、TCF3、CCND3、DDX3X、SMARCA4、MYC和TP53,它们影响细胞周期和/或组成性地激活BCR/PI3K/AKT通路。这些改变在流行病学变异中分布不同(表4)。ICC已经分离了以前的白血病BL TdT+病例,因为这些病例更适合归为伴有MYC重排的B淋巴母细胞淋巴瘤,并且常携带RAS突变(在BL中不常见)。
总结
侵袭性 B 细胞淋巴瘤是一组高度异质性疾病,其遗传和分子发病机制在近几十年来得到了彻底研究,这些信息越来越多地用于常规诊断。特别是,对MYC、BCL2和BCL6易位的FISH研究对于识别几种实体(如HGBL的不同亚型)以及11q改变的BL和LBCL的困难病例至关重要。基因组检测虽然并非常规诊断所必需,但可以为MGZL或玻璃体视网膜淋巴瘤等疑难病例的分类提供信息,并且在不久的将来,可能有助于靶向治疗的治疗决策。
总结
Frauenfeld L, et al.Advances in the Classification of Aggressive B-cell Lymphomas.Adv Anat Pathol . 2025 Jan 15. doi: 10.1097/PAP.0000000000000484.


