Atherosclerosis 西苑医院刘玥团队揭示循环脂质、降脂药物与血管钙化的遗传关联
时间:2025-02-24 12:08:50 热度:37.1℃ 作者:网络
血管钙化(Vascular Calcification, VC)是心血管疾病、慢性肾病等患者死亡的重要推手,其本质是血管壁中羟基磷灰石的异常沉积。尽管临床广泛使用他汀等降脂药物,但循环脂质、降脂药物与血管钙化的关系长期存在矛盾结论:他汀类药物减缓斑块却可能加速冠状动脉钙化(CAC)的发生;脂蛋白(a)(Lp(a))与CAC的关联性在不同研究中结论不一。深入探讨循环脂质与血管钙化之间的关系,对于开发新的治疗策略具有重要临床意义。

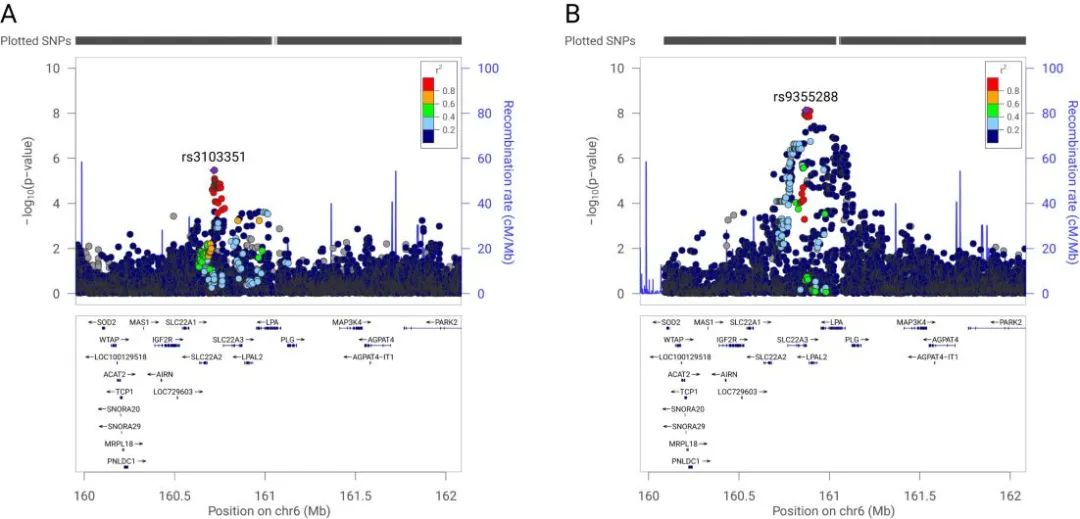
近日,中国中医科学院西苑医院心血管病中心刘玥主任医师团队在欧洲动脉粥样硬化学会(European Atherosclerosis society)会刊Atherosclerosis杂志上发表了题为“Genetic Association of Circulating Lipids and Lipid-lowering Drug Targets with Vascular Calcification”的研究成果。研究团队首次系统性揭示了循环脂质代谢与血管钙化的遗传因果关系。研究整合全球大型基因组数据库,筛选与7种循环脂质(LDL-C、TG、Lp(a)等)及13个降脂靶点(如PCSK9、LPA基因)相关的遗传工具变量,通过多维度分析—包括单变量/多变量MR、药物靶点MR (DTMR)、共定位及中介分析—系统构建了从基因到疾病的完整证据链。尤为关键的是,团队创新性结合表达数量性状位点(eQTL)数据,成功锁定肝组织中LPA基因表达与CAC的因果关系,为后续药物开发奠定了基础。

本研究的核心发现表现在以下三个方面:一是构建脂质因果网络图谱,阐明CAC与主动脉钙化(AAC)的差异化风险。遗传代理的高水平LDL-C (风险增加56%)、TG (45%)和Lp(a) (17%)均直接驱动CAC进展,且多变量调整后效应仍显著;载脂蛋白B (apoB)是AAC的唯一独立风险因素(风险增加18%),而与LDL-C无显著关联,提示不同血管床的钙化机制存在差异;HDL-C对CAC和AAC均显示保护作用,但其效应在多变量分析中被削弱,凸显联合干预的重要性。二是发现并明确LPA基因是CAC的潜在干预靶点。肝组织中LPA基因表达每升高1个单位,CAC风险增加14.5%(p=0.028),共定位分析进一步证实两者在±1 Mb区域内共享因果变异;靶向LPA基因的siRNA或反义寡核苷酸(如Pelacarsen)可通过抑制Lp(a)合成降低CAC风险;LDLR、HMGCR等传统靶点虽与CAC相关,但效应显著弱于LPA基因,提示开发新型靶向CAC药物的必要性。三是代谢因素的中介效应与临床启示。血清高钙(β=0.205)和高磷(β=0.572)水平直接增加CAC风险,而与慢性肾病(CKD)本身无显著因果关联,提示钙磷紊乱是肾病继发钙化的关键环节。2型糖尿病(T2DM)与CAC存在直接因果关系,强化血糖管理对血管保护的重要意义;CAC与AAC的风险因素差异呼吁个性化治疗,如高危人群需优先控制Lp(a)和apoB水平。
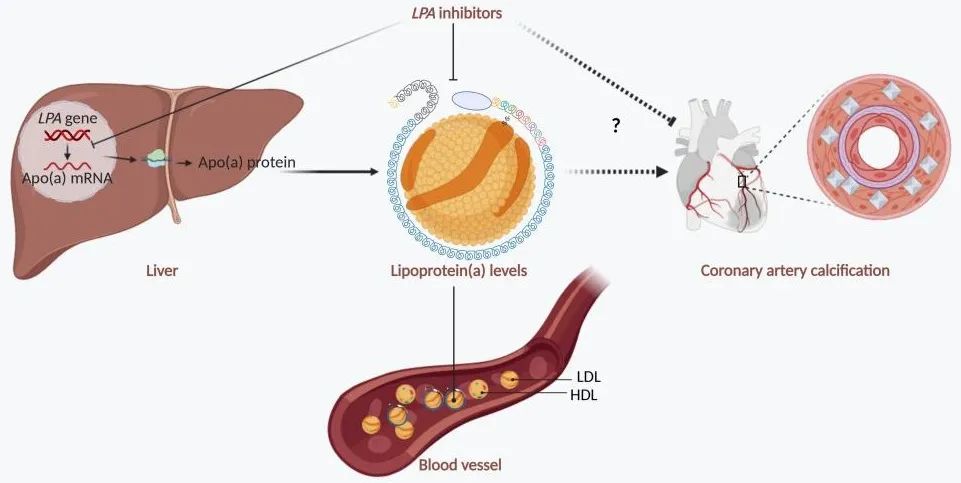
血管钙化是横跨心血管、内分泌和肾病领域的全球健康挑战之一,也是研究重大疾病跨器官机制的重要中介。本研究结合DTMR、SMR与共定位分析方法,构建了一种用于解析复杂疾病遗传机制的研究框架,为血管钙化的遗传学研究提供了新的思路。对于未来临床实践也具有重要的启示意义,建议将Lp(a)纳入心血管疾病筛查体系,尤其在CAC高发人群中开展基因检测,联合降脂(如LPA抑制剂+他汀)可能比单一疗法更有效,相关临床试验亟待推进;肾病和糖尿病患者需强化钙磷代谢监测,早期干预以阻断钙化进程。
中国中医科学院西苑医院专业型硕士研究生张鹏飞和博士研究生王文婷为该项研究的共同第一作者,刘玥主任医师为唯一通讯作者,本研究得到国家自然科学基金项目、中国中医科学院卓越青年科技人才专项及国家中医药管理局青年岐黄学者培养项目的资助。
原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S0021915025000334


