追踪妇科肿瘤 “蛛丝马迹”:cfDNA/ctDNA 检测在临床决策中的大作用
时间:2024-12-21 06:02:18 热度:37.1℃ 作者:网络
游离 DNA(cfDNA)分析在癌症患者的管理中具有多种有前途的临床应用,在不同类型的实体瘤(例如肺癌、乳腺癌和结肠癌)中确立了临床有效性。癌症携带的独特基因改变可以在癌症患者的血浆和其他体液中检测到,是肿瘤来源 DNA 的替代来源。技术进步和下一代测序(NGS)的广泛可及性使得循环肿瘤 DNA(ctDNA)测序分析成为可能,采用固定和个性化肿瘤知情 panel。在多种实体瘤类型中,肿瘤大小、疾病负荷和高级别组织学类型与 ctDNA 水平相关。检测血浆来源的 cfDNA 中肿瘤来源的分子改变有助于诊断,指导治疗选择,并作为治疗反应和预后的生物标志物。分子残留病(MRD)处于 cfDNA 分析的最前沿,对新辅助和辅助治疗的降级/升级有影响。cfDNA 分析用于早期癌症识别正在积极研究中。妇科癌症的原理验证研究表明了在缺乏特异性生物标志物的癌症中的可行性和创新潜力,包括在宫颈癌患者中追踪人乳头瘤病毒(HPV)cfDNA。本综述概述了目前可及的 cfDNA/ctDNA 检测,cfDNA 分析在临床决策中的作用,以及妇科癌症中 cfDNA 研究的现状和潜在临床应用。
循环游离(cf)DNA
在过去的十年中,循环游离(cf)DNA 分析在肿瘤学研究中受到了极大的关注,具有广泛的有前途的肿瘤生物标志物相关应用,从传统活检的替代物(即“液体活检”)和预后到治疗反应的微创连续监测和微小残留病和治疗耐药机制的识别。虽然在几种不同实体恶性肿瘤中,cfDNA 分析已被验证为临床生物标志物,但 cfDNA 分析对于妇科肿瘤学领域来说仍然相对较新,新兴技术的最佳临床应用仍不清楚。
癌症携带在整个肿瘤发生过程中获得的独特分子改变,基于下一代测序(NGS)的检测作为一种识别组织来源的肿瘤 DNA 中这些分子改变的方法,已变得更加广泛可及,有助于诊断和治疗决策。在癌症患者血浆中发现的循环肿瘤(ct)DNA,即肿瘤来源的 cfDNA(见下一段),是肿瘤来源 DNA 的替代来源。虽然最初检测血液中的这些癌症相关突变在技术上具有挑战性,但测序技术和生物信息学分析近年来取得了进步,肿瘤来源的遗传和表观遗改变都可以以高特异性和灵敏度检测到。
组织/细胞通过各种机制将无包膜的片段化 cfDNA 释放到血液和其他体液中,包括坏死和细胞凋亡。在这些 cfDNA 中,来自癌细胞的 DNA 称为 ctDNA(图 1)。重要的是要注意 cfDNA 不是癌症特异性的,在健康个体中,血浆中的大多数 cfDNA 来源于造血细胞。在健康个体中,可以在血浆中检测到低水平的 cfDNA,在患有炎症性疾病或中风或手术后的人群中 cfDNA 会增加。一般来说,与健康对照相比,在癌症患者中发现了更高水平的 cfDNA,然而,早期/低负荷疾病患者的水平可能很低。重要的是,在多种实体癌类型中,肿瘤大小和疾病负荷/分期程度与可检测到的 ctDNA 水平相关,并且高分期或转移性疾病患者的血浆 ctDNA 分数最高。此外,可检测到 ctDNA 的病例比例因肿瘤类型而异,许多初始研究是在具有早期血行转移的癌症类型中进行的,例如乳腺癌和肺癌。在妇科癌症中,研究集中在利用 cfDNA 分析进行疾病监测和检测微小/分子残留病(MRD),以及识别特定的分子改变,例如卵巢癌中的 BRCA1/2 突变或子宫内膜癌中的微卫星不稳定性(MSI)。目前,用于卵巢癌 BRCA1/2 突变检测的液体活检以及基于 cfDNA 的 MRD 评估和免疫治疗反应监测可用于妇科癌症的临床应用(见下文;表 1 和图 3)。然而,其最佳使用、治疗升/降级的时间以及对患者结局的影响尚未在前瞻性临床研究中确定。
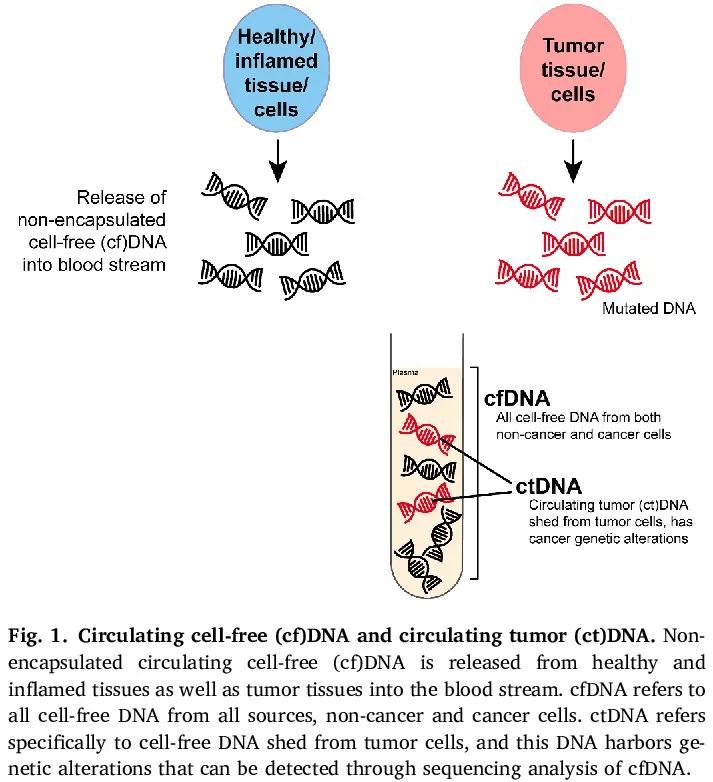
图1
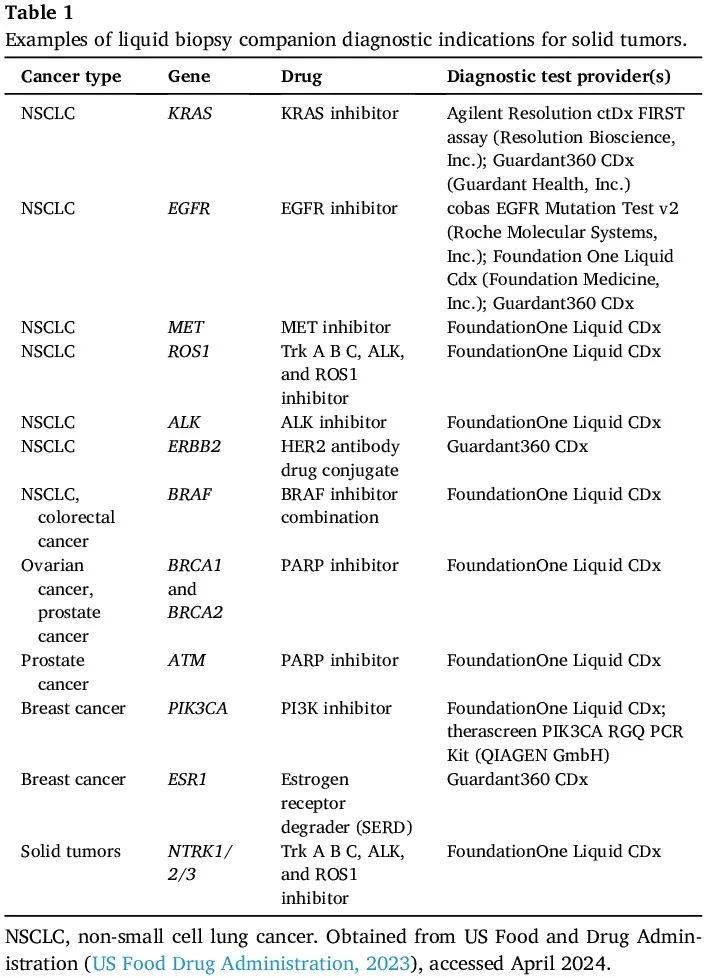
表1
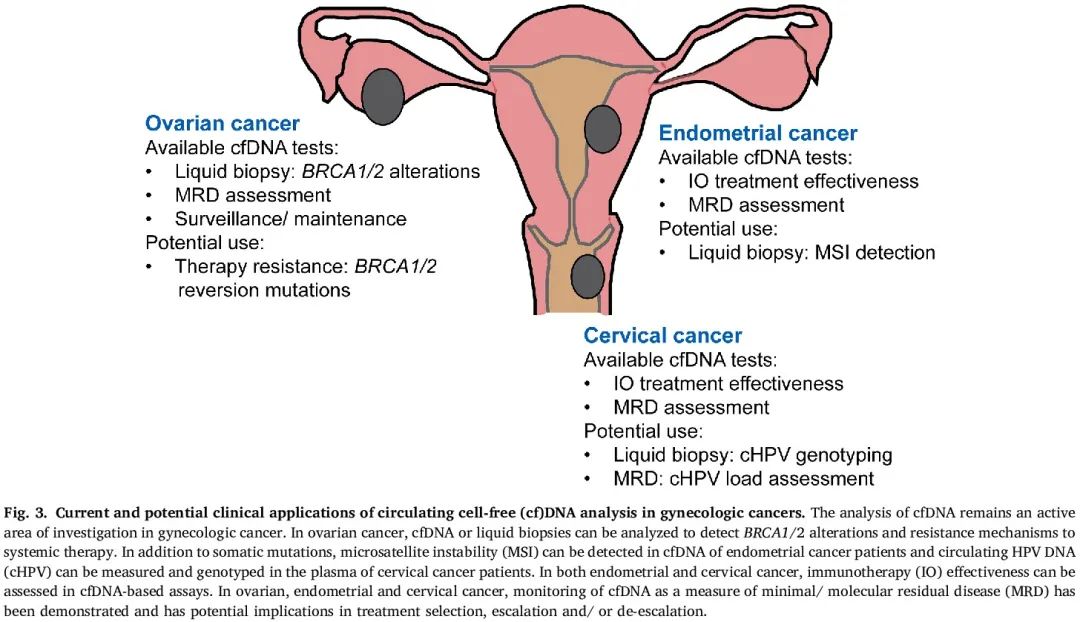
图3
本综述概述了目前可及的 cfDNA/ctDNA 检测,以及 cfDNA 分析在临床决策和妇科癌症中的作用。
cfDNA/ctDNA检测
为了检测外周血中的突变,从血浆中提取 cfDNA,可以使用不同的手动和自动方法。虽然有一些方法可以富集 ctDNA,例如通过片段大小选择,因为 ctDNA 的片段长度(中位 ∼ 144 bp)比 cfDNA 的片段长度(中位 ∼ 167 bp)短,但通常对整个分离的 cfDNA 进行分析。因此,需要灵敏和特异的检测来检测 cfDNA 中的 ctDNA。对于 cfDNA 测序分析,在商业和学术环境中,有广泛的技术和检测可及,且仍在不断涌现新方法。检测的选择取决于应用和疾病环境。一般来说,对于分子改变检测,使用两种类型的方法,一种是固定的测序panel,旨在检测常见癌症相关基因突变,另一种是个性化,也称为“定制”测序panel(图 2)。对于固定 panel,相同的 panel 用于每位患者的 cfDNA 测序分析,而对于个性化/定制 panel,首先对肿瘤 DNA 进行测序,然后选择一些在组织中识别的分子改变来设计个性化 panel,用于检测来自同一个体的 cfDNA 中的肿瘤/患者特异性突变,因此每个患者都有一个独特的 panel(图 2)。
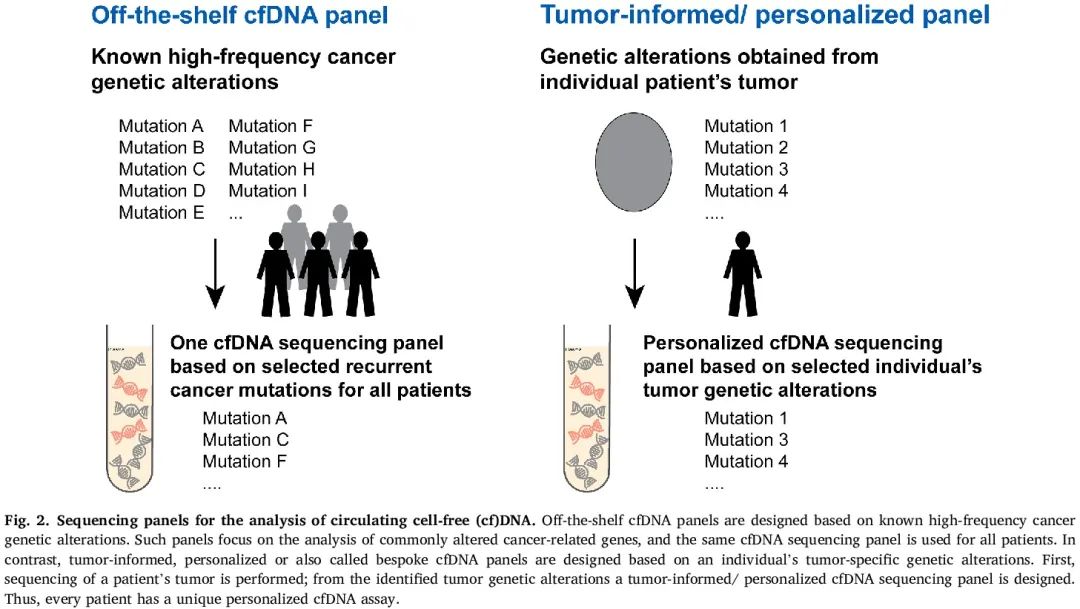
图2
固定和个性化测序 panel 的技术方法多样,包括用于评估癌症相关基因一个或多个常见突变的数字 PCR,扩增子 NGS 测序或基于杂交捕获的 NGS panel以及全基因组测序。大多数panel侧重于检测 cfDNA 中的肿瘤特异性突变,但也可以评估拷贝数变异、结构变异、结构变异断点和易位。不同检测和方法的血浆 ctDNA 检出限(LOD)不同,可以通过更高的用于测序分析的 cfDNA 输入量、测序深度、评估的分子改变数量或通过在同一 DNA 片段中捕获多个突变(即“同相”)来提高。
低血浆 ctDNA 量与高测序深度结合可能会导致测序伪影,这可能会限制分析灵敏度并影响特异性。此外,为了保持 ctDNA 检测的特异性,区分癌症信号与背景正常生物变异至关重要。cfDNA 分析中生物噪声的主要来源是克隆性造血(CH)。CH 是正常衰老过程的一部分,涉及造血干细胞中体细胞突变的积累及其在血细胞中的克隆扩增。重要的是,如上所述,血浆中的大多数非癌性 cfDNA 来源于造血细胞。超深度测序表明,CH 在普通人群中高度存在,并且 CH 相关突变可以在绝大多数癌症和非癌症患者的血浆中检测到。CH 突变与血液系统癌症和其他癌症类型(包括妇科癌症)中发现的突变相似,最常涉及 DNMT3A、JAK2、TP53、TET2、ASXL1 和 SF3B1。cfDNA 中的这些造血细胞来源的 CH 相关突变可能伪装成肿瘤来源的突变,其错误归类为肿瘤相关 ctDNA 可能会对患者管理产生影响。因此,重要的是将 cfDNA 突变分析限制在同一患者的匹配肿瘤组织中也存在的那些改变(即基因分型)和/或进行匹配的 cfDNA - 白细胞测序,以准确解释和区分 CH 和肿瘤来源的突变。此外,使用唯一标识符(即分子条形码)标记单个 DNA 分子,加上复杂的计算工具,也可识别和抑制重现性背景错误。最近,正在开发将遗传和表观遗传甲基化分析与蛋白质肿瘤标志物和/或病毒基因组等相结合的多模式或多分析物 cfDNA 检测,这可能会提高灵敏度和特异性。
cfDNA分析用于临床决策
cfDNA 分析在肿瘤学领域正在迅速发展,有许多已获批的检测(表 1)以及有希望的临床应用和优于传统癌症筛查工具和诊断检测的优势。作为液体活检,可以使用血液样本定量血浆中的 ctDNA 水平,避免侵入性组织活检。此外,组织活检提供肿瘤的单一分子图谱,而 cfDNA 测序可以在一次检测中识别在原发性肿瘤和转移性疾病中观察到的整个体细胞分子改变库,反映肿瘤内和肿瘤间异质性,可以检测单个患者的多个癌症,并且可以更频繁地重复,用于监测目的。
在肿瘤学 cfDNA 研究中,肺癌、乳腺癌和结肠癌仍然是目前研究最多的癌症类型,在临床试验中最为活跃。在妇科癌症中,已发表的 cfDNA 研究和临床试验较为有限(见下文)。美国食品和药物管理局(FDA)于 2016 年批准了非小细胞肺癌(NSCLC)的第一个液体活检检测,用于检测表皮生长因子受体(EGFR)基因突变,作为 EGFR 特异性酪氨酸激酶抑制剂的伴随诊断(CDx)。目前,NSCLC 以外的癌症也有 FDA 批准的液体活检 CDx 检测,包括乳腺癌、卵巢癌、前列腺癌和结肠癌以及泛癌种检测(表 1)。这些 CDx 检测旨在提供基于 cfDNA 的特定基因改变评估,这些改变可作为选择特定靶向疗法的生物标志物。对卵巢癌很重要的是,一种 CDx 液体活检检测可用于检测 BRCA1 和 BRCA2 突变,这是一种可识别聚 ADP 核糖聚合酶(PARP)抑制剂治疗潜在获益患者的伴随诊断(表 1)。
另一种临床应用是微小/分子残留病(MRD)检测环境中的 cfDNA 分析。MRD 是指手术和/或全身治疗后残留在体内的肿瘤细胞。landmark分析是在根治性治疗后不久的指定时间点通过 cfDNA 分析鉴定 MRD,在多种实体瘤类型中,这与复发风险密切相关。因此,MRD 检测可用于指导监测策略和复发风险最高患者的辅助治疗决策。此外,在多种疾病类型中,诊断时血浆 ctDNA 检测具有预后意义,与患者的疾病负荷呈正相关。此外,有证据表明,将 ctDNA 检测纳入解剖分期可能有助于改进初始分期的预后价值,如最近在 NSCLC 患者中显示的那样。
除了landmark分析外,治疗后连续收集血液样本,评估 MRD 的动态变化,可用于多种癌症类型的疾病监测和早期检测识别疾病复发。重要的是,在不同癌症类型中,这种连续的 cfDNA 分析可以识别分子复发,一些研究显示,比临床或影像学检出提前数月。基于 cfDNA 的 MRD 检测比现有的基于血液的生物标志物更灵敏,因此有潜力作为生物标志物,特别是对于那些没有血液标志物的疾病类型。在新辅助治疗中,全身治疗后 ctDNA 阳性与无进展生存期(PFS)和总生存期(OS)降低相关。尽管商业检测提供基于 cfDNA 的 MRD 检测,但需要临床研究来确定观察到的 MRD/ctDNA 水平变化的时间点来升级或降级治疗。此外,尚未证明早期疾病拦截,即早期 cfDNA/cfDNA 识别后对疾病的治疗,对预后有有利影响。
在辅助治疗期间或之后对连续 cfDNA 样本进行评估也可以提供一种实时监测耐药机制以指导治疗决策的方法。在全身治疗期间,癌症可能会获得耐药突变。例如,在最初 KRAS 野生型结直肠癌抗 EGFR 治疗期间,连续 cfDNA 分析用于检测血浆中的 KRAS 突变,一种已知的获得性耐药机制。类似地,雌激素受体阳性乳腺癌患者液体活检中出现 ESR1 突变是对芳香化酶抑制剂耐药的机制。
目前,仅有一部分癌症具有有效的筛查方式。基于发现血浆中肿瘤突变的检测有时比现有的生物标志物更灵敏,并且可能先于影像学检出,人们对用于早期检测的 cfDNA 分析的开发和临床应用产生了极大的兴趣。早期检出的优势是明显且多方面的,增加了干预窗口期,从而改善临床结局。然而,浸润前或早期癌症血浆中肿瘤来源 DNA 少加上当前技术的 LOD,具有挑战性。目前,只有结肠癌有获得 FDA 批准的基于血浆的筛查检测,检测结直肠癌的灵敏度为 83.1%,但检测癌前病变的灵敏度仅为 13.2%。正在努力实现基于血浆的常见癌症筛查,这有可能提高筛查的依从性,在全球范围内减少健康差异并提高可及性。
cfDNA分析在妇科癌症中的作用
在其他实体恶性肿瘤中,cfDNA 分析已作为临床生物标志物实施,而在妇科肿瘤中,液体活检标志物研究通常处于探索的早期阶段(图 3)。鉴于对妇科癌症的分子图谱和与结局相关的分子标志物的了解增加,再加上缺乏特异性生物标志物和筛查方式,cfDNA 分析有可能影响患者管理。目前正在进行的临床试验的结果备受期待。
卵巢癌
与其他癌症类型的观察结果一致,在卵巢癌患者中,cfDNA 水平与分期、疾病负荷、CA-125 水平和计算机断层扫描(CT)结果相关。早期研究表明,在匹配的血液样本中可以检测到肿瘤来源的 TP53 突变,与化疗后的疾病负荷和进展时间相关。有研究探索了 CDH1、RASSF2A 和 BRCA1 循环 DNA 甲基化水平作为卵巢癌早期识别的潜在筛查生物标志物,大多数研究产生的灵敏度相对较低,但特异性高,约为 90%,提示可以与其他可及检测结合使用,例如 CA125 水平和影像学检查。虽然在临床环境中的实用性仍有待商榷,但 ctDNA 突变的存在可以预测早期复发,其阈值低于现有的生物标志物、临床或影像学研究。
cfDNA 分析在高级别浆液性卵巢癌中的应用涉及耐药机制的鉴定。在胚系 BRCA1 或 BRCA2 突变的铂类耐药/难治性卵巢癌患者中,cfDNA NGS 揭示了 BRCA1/2 回复突变,一种已知的铂类药物和 PARP 抑制剂耐药机制。在高级别浆液性卵巢癌患者中, cfDNA BRCA1/2 回复突变的检出可以预测对 PARP 抑制的原发性和获得性耐药。
对于卵巢癌患者,临床可以使用液体活检来检测血浆中 BRCA1 或 BRCA2 突变以进行 PARP 抑制剂治疗(表 1)。此外,有可及的商业 cfDNA 检测用于 MRD 评估以识别获益于额外治疗的高危卵巢癌患者,用于监测/维持早期复发检测,和/或用于免疫治疗疗效评估。然而,应该注意的是,其中一些检测与实体瘤类型无关,卵巢癌患者的时间点和血浆 cfDNA 发生变化后治疗干预的类型尚未确定。
目前有几项前瞻性临床试验正在评估 cfDNA 分析用于上皮性卵巢癌,主要关注早期发现(例如,NCT06249308、NCT05693987)和 MRD 检测和治疗反应(例如,NCT03691012、NCT06071286)。
子宫内膜癌
子宫内膜癌是常见癌症类型之一,发病率和死亡率均增加。基于血液的生物标志物(如 CA-125)的效用有限,这使得 cfDNA 分析成为有吸引力的用于疾病监测和预后预测的潜在生物标志物。此外,虽然 I 期疾病预后较好,但不同的病理和分子因素与可变的 PFS 相关。在这种情况下,cfDNA MRD 分析可能有助于确定哪些患者将从辅助治疗中获益最大。然而,与卵巢癌不同的是,远处转移性疾病在子宫内膜癌患者中较少见,导致脱落到血液的肿瘤来源遗传物质较少,对 ctDNA 检测构成挑战。
初步研究表明,主要在患有高危疾病的子宫内膜癌患者中检测到 cfDNA,子宫切除术时,血浆 NGS 在 33% 的患者中检测到热点突变。在最近的一项原理验证研究中,cfDNA 水平与分期相关,连续 ctDNA 评估反映了对治疗有反应、疾病进展和复发。在超过 90% 的病例中,在 cfDNA 中准确识别了肿瘤中的体细胞突变,并且基线或术后 ctDNA 的存在与 PFS 降低显著相关。此外,最近的研究报道了子宫抽吸物微卫星不稳定性(MSI)检测和 cfDNA 作为微创的子宫内膜癌分型手段和用于监测对免疫检查点抑制的反应。
子宫内膜癌辅助治疗的现状处于不断变化之中。不同的临床、组织病理学和现在分子特征被纳入分期系统,用于确定预后和辅助治疗的患者选择。cfDNA 分析的一个潜在有意义的临床应用是辅助治疗分层,通过术后 cfDNA 监测评估 MRD。Recio 及其同事分析了 101 例子宫恶性肿瘤患者的术后 ctDNA,与既往发现一致,较高危组织学类型的患者更可能术后 ctDNA 阳性。重要的是,校正了组织学类型、错配修复(MMR)和 p53 状态后,术后 ctDNA 或 MRD 阳性是复发的唯一显著危险因素。用于 MRD 评估和/或免疫治疗疗效评估的与实体瘤类型无关和妇科癌症特异性的 cfDNA 检测现在可用于子宫内膜癌患者。临床试验目前正在探索 cf/ctDNA 分析在子宫内膜癌中的应用,然而,评估早期发现(例如,NCT06083779)和预后/预测(例如,NCT05049538,NCT05504161)。
宫颈癌
尽管宫颈癌细胞学筛查以及人乳头瘤病毒(HPV)检测和 HPV 疫苗广泛可及,但美国的宫颈癌发病率虽然自 1970 年代以来显著下降,但在过去十年中基本保持不变。部分原因可能是缺乏筛查途径和/或缺乏对筛查的依从性、患者对宫颈癌的认识不足以及 HPV 疫苗的接受和有效性。由于大多数宫颈癌与高危 HPV 感染有关,宫颈癌中的 HPV cfDNA 为开发用于诊断和疾病监测的生物标志物提供了更多机会,因为可以在 cfDNA 中推断 HPV 的存在、类型和负荷。此外,获取液体活检以正确识别 HPV 基因型的能力对通过靶向 HPV 癌蛋白进行针对癌症的免疫治疗具有重要意义。最近的一项研究表明,放化疗后持续存在 HPV ctDNA 与较差的 PFS 独立相关,提示考虑对这些复发风险较高的患者升级治疗。对于所有实体瘤,包括宫颈癌,有市售的 cfDNA 检测用于 MRD/疾病监测和免疫检查点抑制剂治疗反应监测。与子宫内膜癌类似,目前只有少数正在进行的宫颈癌临床试验,主要评估 cfHPV DNA 作为潜在的生物标志物(例如,NCT05606133、NCT05950087)(图 3)。
总 结
最近使用更高灵敏度技术和先进生物信息学方法的研究表明,cfDNA 分析在妇科癌症中具有令人鼓舞的潜力,包括用于治疗升级和/或降级的 MRD 检测、早期疾病复发检测和免疫治疗疗效评估。此外,在卵巢癌中,液体活检用于检测 BRCA1/2 基因变异和对全身治疗的耐药机制。在子宫内膜癌中,cfDNA 测序已被用于体细胞突变和 MSI 检测,而在宫颈癌患者中,血浆 cHPV 评估和基因分型非常有趣。目前,cfDNA 检测可用于妇科癌症患者的临床应用,正在进行的临床试验将提供有关 cfDNA 分析的临床应用和有效性的更多信息。
参考文献:
Kim SH, Weigelt B. Circulating cell-free (cf)DNA analysis: Current technologies and applications in gynecologic cancer. Gynecol Oncol Rep. 2024 Jun 13;54:101431. doi: 10.1016/j.gore.2024.101431. PMID: 38947418; PMCID: PMC11211888.



