EGFR 19del非小细胞肺癌硬脑膜转移患者获益奥希替尼,实现完全缓解
时间:2024-12-21 06:02:48 热度:37.1℃ 作者:网络
本文报告了一位 80 岁女性非小细胞肺癌(NSCLC)患者使用奥希替尼完全缓解硬脑膜转移案例。患者 8 年前被诊断患有NSCLC(腺癌,T4N3M1a)。活检组织突变分析显示存在EGFR 19号外显子缺失,医生开具了吉非替尼。随访胸部CT显示影像学缓解,3 年后全身PET-CT扫描显示先前的高摄取病变消失。继续用药维持治疗,但 4 年后因无法忍受的皮炎而停药。停止治疗两年后,患者出现步态障碍,脑部MRI显示右侧小脑肿块(直径[d] = 3 cm)伴有周围水肿,与单发性脑转移相符。行乳突后枕下开颅术,完全切除硬脑膜附着病灶。由于系统评估未发现影像学病灶,仅给予放疗(4,000 cGy/10 次),未重新引入吉非替尼。患者每 6 个月进行一次脑MRI随访,术后 2 年的脑MRI显示左侧脑桥池内有一个硬脑膜外肿块(d = 2.2 cm)。连续脑脊液(CSF)细胞学检查显示肿瘤细胞阳性。在脑膜转移确诊后,给予第三代受体酪氨酸激酶抑制剂奥希替尼。两个月的随访脑脊液细胞学检查和 14 个月内连续 5 次检查均显示阴性。5 个月的随访脑部MRI显示硬脑膜软脑膜转移几乎完全缓解,并且这种反应一直维持到 13 个月的脑部MRI随访。
背 景
脑膜转移(LM)是一种令人沮丧的肿瘤并发症,没有明确的治疗方法,通常沿脑表面扩散,尤其是沿脑沟、小脑叶或脊髓表面扩散。局部放疗可能产生影像学反应,但无法阻止疾病进展。全身/脑脊液(CSF)化疗可以延长患者的总体生存期,但通常无法缓解症状。最近,研究人员遇到了一名非小细胞肺癌(NSCLC)患者,该患者在 2 年前接受了开颅手术并切除了脑实性转移瘤,随后发生了硬脑膜转移。脑脊液细胞学检查也证实了脑膜转移的诊断。根据患者既往病史,原发肿瘤存在表皮生长因子受体(EGFR)19号外显子缺失,经吉非替尼(Iressa®)和第三代受体酪氨酸激酶抑制剂(TKI)奥希替尼(Tagrisso®)治疗后缓解。患者分别在 3 个月和 2 个月的随访检查中达到影像学和细胞学缓解。截至本病例报告时,缓解已维持一年多。研究人员回顾了手术切除脑转移瘤后的隐匿性脑膜转移、无软脑膜受累的硬脑膜转移的特点,以及EGFR突变脑膜转移对奥希替尼的影像学和细胞学反应。
病 例
患者女,80 岁,8 年前确诊为NSCLC(腺癌,T4N3M1a)。活检组织突变分析显示EGFR 19号外显子缺失阳性,给予吉非替尼治疗。随访胸部CT显示影像学缓解,3 年后全身PET-CT显示先前的高摄取病灶消失(图1)。继续应用吉非替尼维持治疗,4 年后因无法耐受的皮炎停药。1.5 年后患者自行失访。
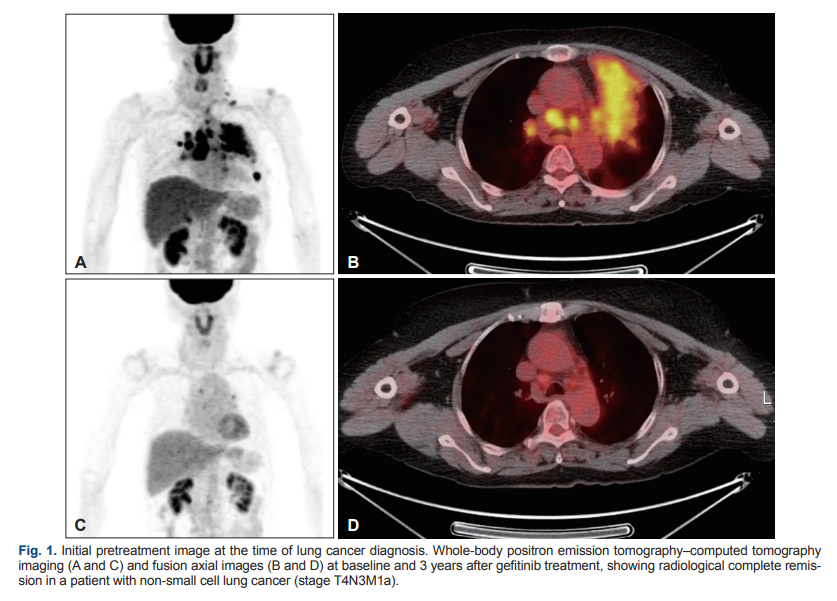
▲图1 肺癌诊断时和初次治疗时的影像
停止治疗两年后,患者因步态紊乱就诊。脑MRI显示右侧小脑肿块伴肿瘤周围水肿(直径 [d] =3 cm),提示为单发脑转移瘤(图2)。影像学诊断一周后,患者接受经乳突后开颅手术,术中证实病灶附着于硬脑膜。术后脑MRI证实病灶完全切除。术后全身PET未见异常高摄取病灶。开颅术后,患者接受放疗(4,000 cGy/10次),并在门诊定期随访,未接受进一步辅助治疗。
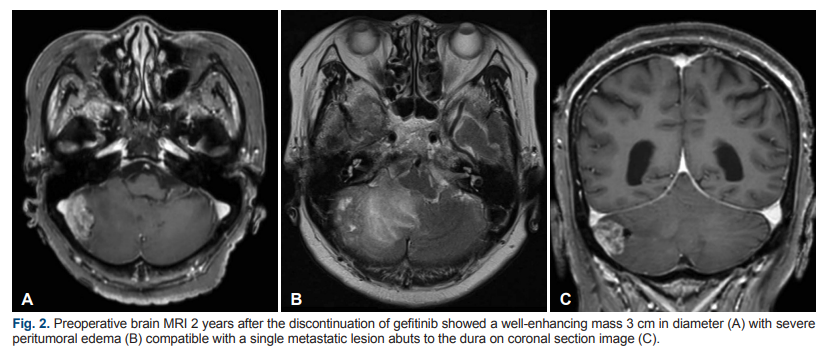
▲图2 停用吉非替尼2年后术前脑MRI显示直径 3 cm的增强肿块 (A),伴有严重的肿瘤周围水肿 (B),与冠状切面影像上与硬脑膜相邻的单个转移性病变相符 (C)
开颅手术两年后,随访脑部MRI显示,在脑桥池左侧、梅克尔洞内上方有一个增强良好的硬脑膜外肿块(d = 2.2 cm),没有海绵窦、实质侵犯或脑沟强化的证据(图3A-C)。由于最近的全身评估(包括胸部CT)未显示复发的影像学证据,因此原发性硬脑膜肿瘤(如脑膜瘤)是鉴别诊断之一。然而,考虑到患者的年龄和之前的脑部MRI检查未发现任何硬脑膜病变,放射科医生报告硬脑膜转移是最可能的诊断。患者没有发现神经系统异常。通过腰椎穿刺进行了连续脑脊液分析,第二次检测时证实了肿瘤细胞的存在。确诊为脑膜转移后,对原发肿瘤进行了重新评估,但检查未发现原发肿瘤复发的证据。血清EGFR突变阴性。全脊柱MRI显示未发现脑膜转移。医生开具了奥希替尼,每日剂量 80 mg。奥希替尼服药 2 个月后脑脊液分析显示癌细胞呈阴性,随后 14 个月内连续 5 次脑脊液分析均为阴性。奥希替尼给药 3 个月后随访脑部MRI显示脑膜转移接近完全缓解(图3D-F),这种缓解至少维持到患者治疗 13 个月,后因经济原因停药。
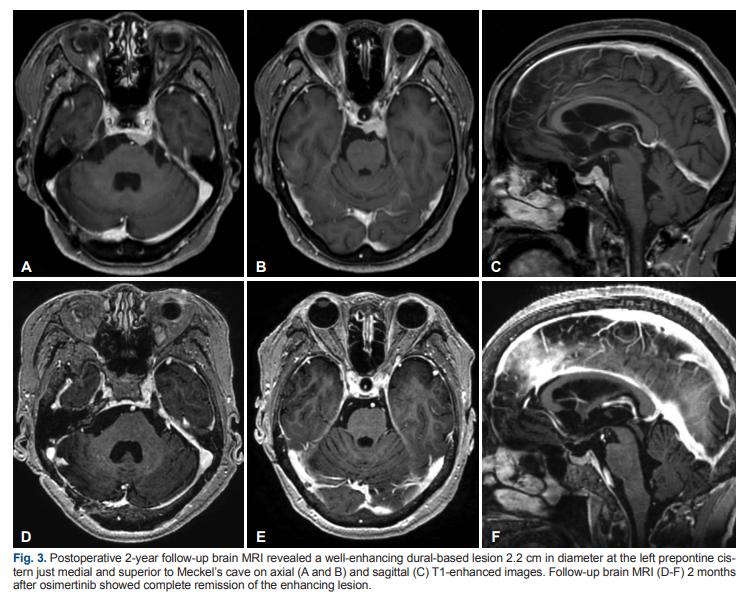
▲图3 术后2年随访脑部MRI显示,在轴向(A、B)和矢状面(C)T1增强图像上,左侧脑桥池梅克尔洞内侧上方有一个直径 2.2 cm 的强化硬脑膜病变;奥希替尼治疗2个月后的随访脑部MRI(D-F)显示强化病变完全缓解
讨 论
LM的特征是原发性肿瘤病变转移至脑膜结构。据报道,LM的发病率高达 8%,最常见的原发性来源包括乳腺癌和肺癌。LM本身并不罕见,尤其是在晚期癌症患者中,但单独的颅内硬脑膜转移(DM)与主要累及蛛网膜、蛛网膜下腔或软脑膜的典型LM相比更为少见。单一DM的发病率很难估计,因为之前的研究大多依赖尸检报告,并未将DM与LM区分开来。Nayak等人分析了 122 例单一DM患者,结果显示DM最常见的来源是乳腺癌、前列腺癌和肺癌。由于颅骨转移瘤直接扩散是最常见的扩散方式,70% 的病例有上覆颅骨的转移,34% 有脑侵犯。在本病例中,DM没有表现出相关的实质或颅骨病变。
已有报道显示,像本文患者这种开颅术后发生脑膜转移,其特点是位置和与原发手术部位的关系。van der Ree等人报道,在后颅窝进行手术后发生脑膜转移的风险高于在幕上进行手术后发生脑膜转移的风险,这表明脑膜转移是由于癌细胞直接转移或“滴状转移”而发生的,后者更容易暴露于脑脊液。在我们之前的研究中,手术切除的脑实质转移瘤的位置是一个值得关注的问题,研究人员发现脑膜转移往往发生在接触性或受累的脑脊液通路(脑室或软脑膜表面)病变中,而不是分离性病变中。从解剖学角度来看,DM发生在脑脊液腔内。因此,研究人员可以推测癌细胞通过脑脊液附着到硬脑膜上,或者硬脑膜来源的转移性病变暴露于脑脊液流中。本文的一名作者(GHS)正在对DM或脑脊液通路接触性脑转移中的LM发生情况进行持续评估,暂定标题为“隐匿性LM”。从这些隐匿性LM中获得的脑脊液样本中,29% 的脑脊液细胞学检查结果呈肿瘤细胞阳性,23% 的患者实际发生了LM,中位进展时间为 6.0 个月(未发表数据)。
由于病例数量有限,DM的治疗选择仍存在争议。对于有症状的DM,如果是可切除的单个病变,通常进行手术切除。然而,Meng等人认为单一切除不足以提供足够的生存获益,并且基于一项对 46 例手术切除的DM病例的回顾性单中心研究,对切除部位进行辅助放疗与延长生存时间有关。在他们的研究中,活动性全身性疾病和靠近静脉窦是不良预后因素。Nayak等人指出,由于DM是轴外病变,因此与实质性脑转移相比,治疗药物的输送应该更容易,应该考虑。在本病例中,使用奥希替尼进行系统治疗获证是有效的。必须仔细选择治疗药物,以实现患者的最大生存获益。最近的研究报道了小分子量靶点抑制剂对LM的疗效。Masuda等人认为,虽然靶点抑制剂对血脑屏障或血脑脊液屏障的渗透率并不优于传统的细胞毒性化疗药物,但靶点抑制剂可以在纳摩尔水平达到有效浓度,而细胞毒性化疗药物需要微摩尔浓度。在本病例中,研究人员使用了第三代TKI奥希替尼,影像学和细胞学反应均显示该药物对EGFR突变的NSCLC的LM有效。Ahn等人在一项多中心回顾性研究中报道了奥希替尼(每日 80 mg)对EGFR T790M阳性晚期NSCLC患者以及既往EGFR TKI治疗后出现进展的患者具有LM活性,就像本文病例一样。他们观察到 55% 的患者有影像学反应,中位LM进展生存期为 11.1 个月。然而,他们没有评估脑脊液细胞学反应。Nanjo等人也报道了标准剂量奥希替尼(80 mg/天)对既往经典EGFR TKI治疗失败的EGFR T790M阳性NSCLC难治性LM病例的影响。在他们的研究中,奥希替尼计算出的脑脊液渗透率为 2.5%±0.3%,脑脊液浓度达到 14.4±2.8 nM。
综上所述,本例患者因非小细胞肺癌硬脑膜转移接受开颅手术 2 年后出现DM。患者根据脑脊液细胞学确诊及既往EGFR突变情况接受奥希替尼治疗,并在 14 个月随访期内成功控制病情。
参考文献:
Hwang J, Ahn BC, Ji SH, Gwak HS. Complete Remission of Dural-Based Leptomeningeal Metastasis in Patient With Non-Small Cell Lung Cancer by Osimertinib. Brain Tumor Res Treat. 2024 Oct;12(4):245-249. doi: 10.14791/btrt.2024.0034. PMID: 39542521; PMCID: PMC11570083.



