机械通气期间监测呼吸肌的努力
时间:2024-12-21 06:03:50 热度:37.1℃ 作者:网络
审查目的
总结呼吸努力的基本生理概念,并概述监测吸气和呼气肌肉努力的各种方法。
最近的发现
食管压力(Pes)测量是呼吸肌努力量化的参考标准,但已经提出了各种无创筛查工具。呼气闭塞压力(P0.1 和 Pocc)可以告知低努力量和高努力量以及由此产生的肺压力,其中 Pocc 在识别高努力量方面优于 P0.1。吸气屏气期间的压力肌肉指数可以揭示吸气肌的力量,但是获得可靠的吸气平台可能很困难。表面肌电图具有估计吸气用力的潜力,但这对于实时评估来说在技术上具有挑战性。呼气肌激活在危重病人中很常见,需要进行评估,即通过胃压监测。呼气肌肉激活也会影响吸气努力的解释,这可能导致对所产生的肺压力的低估和高估。机器学习应用程序未来可能会在床边自动进行呼吸努力监测。
概括
有不同的工具可用于监测机械通气期间呼吸肌的努力——从无创筛查工具到更具侵入性的量化方法。这可以促进肺和呼吸肌保护性通气方法。
要点
-
使用球囊导管测量食管压力 (Pes) 仍然是吸气努力量化的参考标准。
-
呼气闭塞压(P0.1 和 Pocc)等床边测量是针对低和高呼吸肌用力的简单且无创的筛查工具。
-
有关呼吸肌监测的未来研究应重点关注呼气肌激活和吸气肌努力解释之间的相互作用。
-
机器学习应用程序未来可能会发挥作用,以自动化集成在机械呼吸机中的呼吸努力监测。
介绍
呼吸努力反映了驱动呼吸的呼吸肌的能量消耗活动。其大小主要受脑干呼吸中枢输出强度,即呼吸驱动的强度控制[1,2](图1)。驱动力和努力是不同的,但又密切相关的生理实体:当膈神经和膈肌功能完好时,高驱动力会导致高努力。然而,在危重患者中常见的呼吸肌功能障碍的情况下[3],高呼吸驱动导致低吸气努力,导致呼吸困难感[4]。
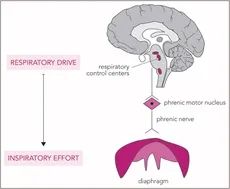
图 1:呼吸驱动和努力的生理途径。呼吸驱动反映了脑干呼吸中枢的输出。通过膈神经运动单元,这会导致膈肌的激活并产生力。
了解呼吸努力的生理学对于个性化呼吸机设置以提供肺和呼吸肌保护性通气至关重要[4,5]。事实上,过低和过度的呼吸动力和努力都与膈肌功能障碍有关[6,7],过度的努力可能导致高(区域)肺膨胀压力(例如,通过pendelluft [8])并可能导致自我伤害肺损伤[4,5,9]。关于高强度运动对膈肌和肺损伤的影响仍缺乏令人信服的证据;然而,这也凸显了需要可靠且易于使用的监测工具来评估此类影响。
本综述描述了呼吸努力的基本生理概念,并概述了机械通气期间监测呼吸肌努力的各种方法,重点关注最新进展。我们还详细讨论了呼气肌的作用,因为人们越来越认识到呼气肌激活在危重病人中很常见[10],需要对其进行评估,并且还会影响吸气努力的监测和解释[11,12]。
呼吸用力的生理学
呼吸肌泵必须产生作用力来克服气道的阻力压力和呼吸系统的弹性压力,以实现肺泡通气。食管压(Pes)测量作为胸膜压的替代,可以将呼吸系统弹性压力分开,用于拉伸肺部[即跨肺压(PL ) ]和扩张胸壁所需的压力[13]。
在自主呼吸中,吸气努力主要由横膈膜产生。辅助吸气肌随着运动或疾病而募集,包括胸骨旁肌、肋间外肌、斜角肌和胸锁乳突肌[14]。吸气肌的激活导致胸膜和气道相对于大气压出现负压;这种压力梯度驱动气流进入下呼吸道,从而产生肺部充气。到期通常是被动的;然而,在呼吸系统承受高负荷或吸气肌能力低的情况下,呼气肌会被募集,包括外侧腹壁肌肉和内肋间肌[10]。主动呼气是增加潮气量超出单独吸气肌作用能力的关键机制[15]。
在机械通气期间,呼吸机根据提供的支持压力的大小部分卸载呼吸肌,或者在强制通气时完全卸载深度镇静的患者的呼吸肌。因此,辅助通气中的潮气量取决于呼吸机辅助和患者的努力,这意味着仅监测呼吸机波形并不能了解患者的实际努力和高肺膨胀压力的风险。
监测吸气用力
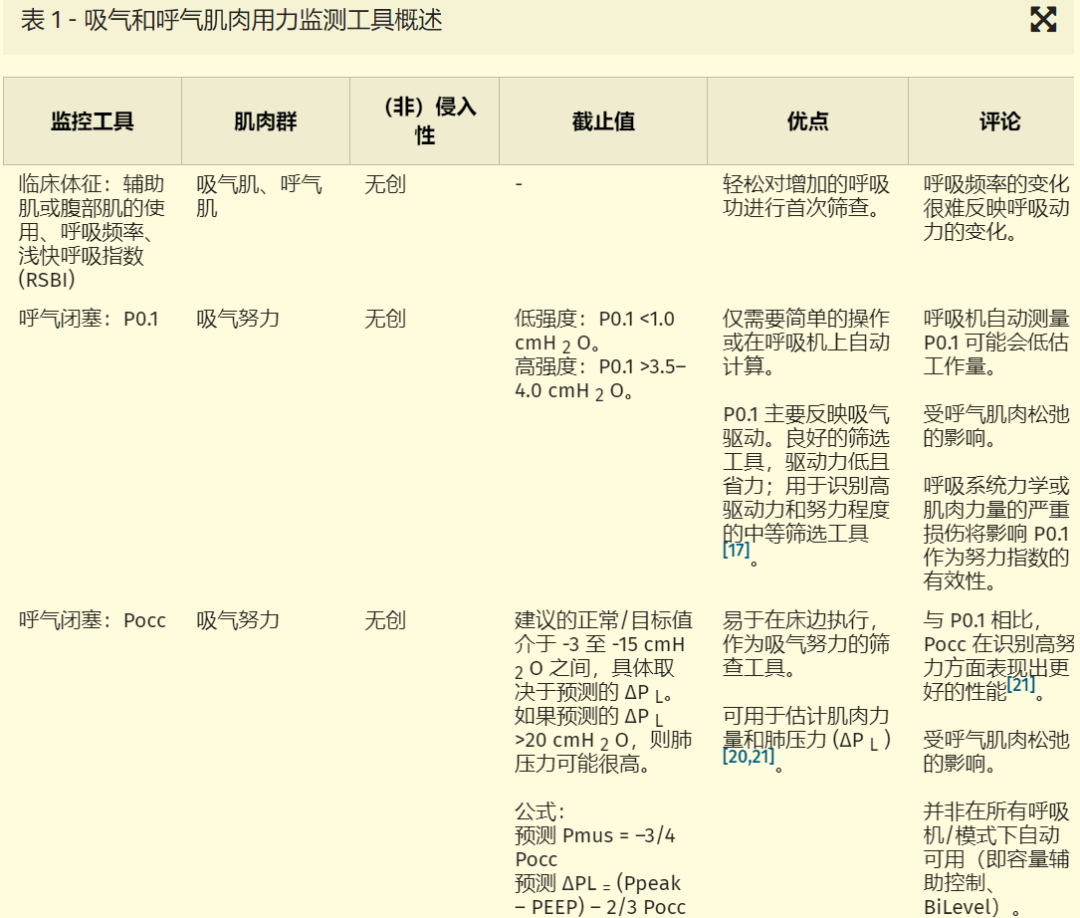
人们提出了不同的技术来评估呼吸肌的力输出,并总结在表 1中。

食管测压
Pes 测量仍然是监测吸气力度的参考标准。最近对该技术的应用进行了广泛的总结[13]。如今,通过将食管球囊连接到呼吸机或床边监护仪,可以轻松地实时观察 Pes。自发努力过程中 Pes 的下降,即 ΔPes 或 Pes 摆动,反映了吸气肌收缩(膈肌 + 辅助吸气肌)产生的胸膜压力下降。需要注意的是,吸气时的总呼吸肌压力(Pmus)还包括扩张胸壁所产生的压力。然而,这需要了解胸壁弹性,而在主动呼吸期间不可能准确测量胸壁弹性。人们认为可以使用被动通气期间测量的值,或者可以将胸壁弹性粗略估计为预测肺活量的4%[16]。
当使用双气囊鼻胃管将 Pes 测量与胃压力 (Pga) 监测相结合时,可以获得跨膈压力 (Pdi = Pga – Pes),作为膈肌特定的作用力测量值。
通过考虑收缩或容量位移的持续时间,可以从 Pes、Pmus 和 Pdi 追踪中获得更复杂的努力测量,包括:呼吸功(潮气量-压力曲线下的面积)、压力-时间乘积(在努力持续时间内的压力积分)或压力率乘积(压力波动乘以呼吸频率)。这些方法大多仅限于研究应用。
无创替代物
闭塞压力
P0.1 和闭塞压力 (Pocc)(图 2a)是可以从 Paw 波形间歇地得出的两种驱动力和努力的无创测量值。P0.1 主要是呼吸驱动力的替代指标[17,18],测量为吸气阻塞的前 0.1 秒内气道压力下降。由于持续时间短,患者对这种闭塞没有意识反应,并且对呼吸力学损伤或神经肌肉功能障碍的敏感性有限,除非出现严重紊乱的情况[18]。P0.1 与膈肌电活动有中等相关性(健康受试者,受试者间相关性R 2 = 0.51),与吸气努力相当好(患者, P0.1 和 Pes-time-受试者间相关性R 2 = 0.67)产品)[17]。研究发现,它对于识别极端驱动力和努力程度特别有用,P0.1 <1.0 cmH 2 O 是低呼吸驱动力的良好筛查工具,P0.1 >3.5–4.0 cmH 2 O 反映了较高的驱动力和努力程度。17]。P0.1可以直接在呼吸机上获得,但不同的呼吸机使用不同的算法,例如0.1秒闭塞期间的压降(手动选择P0.1操作),或者从压降的斜率自动推断在触发阶段。因此,该值有时可能被低估[19]。
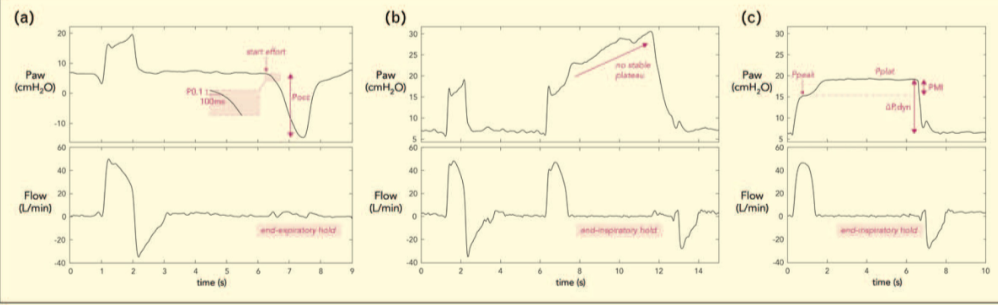
图 2:(a) 压力支持通气患者的呼气末屏气操作和由此产生的闭塞压力测量。P0.1 反映了吸气闭塞的前 100 毫秒期间气道压力 (Paw) 的下降,而全呼吸闭塞压力 (Pocc) 是吸气完全闭塞期间 Paw 的下降。此示例还显示了两种方法之间的潜在差异,并且 Pocc 比 P0.1 更好地反映了高努力:在该患者中,P0.1 为 0.9 cmH 2 O,而 Pocc 为 -21 cmH 2 O。(b) 吸气屏气操作接受压力支持通气的患者(与 a 中的患者相同)。无法达到稳定的平台期,表现为吸气屏气期间气道压力 (Paw) 持续增加,从而无法评估压力肌指数 (PMI)。这本身可能是高吸气努力的标志——与该患者的 Pocc 评估一致。(c) 理论上说明,在没有付出很大努力的情况下,该患者的可靠 PMI 测量结果如何。然后将 PMI 测量为稳定平台压力 (Pplat) 减去峰值 Paw (Ppeak) 之间的差值。然后,动态气道驱动压力 (ΔP,dyn) 也可以监测为 Pplat 减去呼气末正压。
Pocc 反映了全呼吸闭塞吸气(即呼气末屏气操作)期间的气道压力下降,因此比驱动更好地反映了吸气努力[20]。在一小群接受辅助通气的患者中,Pocc 被验证为筛查高 Pmus 和过度肺应激 [即动态跨肺驱动压 (ΔP L )] 的一种措施,使用以下公式[20],且 Pocc 测量为负值价值:
预测 Pmus = –3/4 Pocc
预测 ΔP L = (Ppeak – PEEP) – 2/3 Pocc
尽管 P0.1 [17]和 Pocc [20]针对 Pes 进行了验证,反映了整体吸气肌用力,但最近的工作[21]重点关注 P0.1 和 Pocc 与膈肌用力 (Pdi) 和肺压力的相关性,并比较了它们的相关性。同一队列中的预测值。P0.1和Pocc可以识别高ΔP L(即>20 cmH 2 O)以及低和高Pdi的极值(即Pdi <3 cmH 2 O和>12 cmH 2 O);Pocc 在检测高努力方面优于 P0.1。基于 Pocc [20],发现了类似的公式来预测努力和肺压力;因此,如果预测的 ΔP L >20 cmH 2 O,肺压力可能很高[5,21]。
考虑到患者之间关系的巨大差异,P0.1 和 Pocc 都不应用于预测努力或肺膨胀压力的精确值[17,20,21]。相反,它们是合适的筛选工具。最近有人提出,P0.1和Pocc都可以高度努力地预测重症COVID-19患者呼吸衰竭的复发[22]。
压力肌指数
压力肌指数 (PMI) 已于 1997 年引入[23],可以在辅助通气期间通过进行吸气末屏气并测量平台压力 (Pplat) 和峰值压力 (Ppeak) 之间的差值来计算(图 2b)和c)。然后,除了呼吸机辅助之外,吸气屏气还可以揭示吸气肌产生的压力:Pplat > Ppeak。先前的小型研究表明 PMI 与 Pes 时间乘积存在中度至强相关性[12,23,24]。根据 PMI 目标调节呼吸机辅助似乎是可行的[24,25]。多奇等人。[25]证明,个人对改变呼吸机辅助的反应可以分为两类:对于主动呼吸的患者,减少辅助将导致 PMI 增加,因为患者会做出更多的反应,而在“准被动”患者中,PMI 几乎没有增加。随着呼吸机辅助降低而增加[25]。这可能是吸气肌无力或呼吸机过度协助的迹象;特别是,PMI <0 cmH 2 O(即 Pplat < Ppeak)表明被动吹气。
PMI 监测存在一些局限性。首先,其准确性取决于吸气屏气的可读性。制定了可靠 Pplat 的标准[12]:到达平台期的时间短 (<800 ms)、稳定平台期的持续时间 >2 秒以及平台期的低变化 (<0.6 cmH 2 O/s) [12 ]。特别是对于具有高驱动力和努力程度的患者,稳定的平台可能很难甚至不可能测量[12,26];这本身就表明付出了很大的努力。即使在吸气屏气期间存在明显的稳定平台,呼气肌肉活动也经常存在[26]。在这种情况下,测量的气道压力不等于吸气末弹性反冲压力。最后,PMI 没有临界值(负值表明被动充气除外)。
表面肌电图
作为呼吸动力的密切替代者,膈肌的电活动,即膈肌肌电图 (EMGdi),经常被提议作为吸气努力的监测工具。参考标准是通过专用电极嵌入式鼻胃导管(也称为 EAdi 导管)获得的,无创替代方案是通过表面肌电图 (sEMGdi) [27]。EMGdi 幅度与呼吸努力相关[28-30],但受试者之间和/或受试者内不同记录之间的巨大差异(特别是在 sEMGdi [27,30]的情况下)使得仅根据 EMGdi 幅度估计努力是不可靠的。因此,需要一个转换因子:即Pmus = k × EMGdi。这里,k反映了神经力学效率,并且可以从患者特定的测量中获得,例如在呼气末闭塞期间(即k = Pocc/EMGdi 幅度在闭塞期间)[28,29]。Petersen [31]和 Grasshoff等人的最新作品。 [32]建议利用运动方程的数学模型可以根据潮式呼吸期间的 sEMGdi 提供准确的 Pmus 估计。瓦尔纳尔等人。[33]提出了 sEMGdi 波形的质量标准,以进行可靠的工作量计算,并且还发现转换因子 (Pocc/sEMGdi) 取决于所应用的 PEEP 水平[33]。
机器学习应用
机械呼吸机不断产生大量数据,但工作量监控需要额外的诊断。考虑到技术进步,预计自动化算法可以通过促进连续监测和/或识别可能受益于额外诊断的患者来提供新的机会。很少有小型研究评估流量-时间和压力-时间曲线。阿尔巴尼等人。[34]提出了根据流量波形下降部分的凹度计算的流量指数(FI):FI等于1表示吸气流量线性减小,FI<1表示凹度向上,FI> 1 朝下的凹面。作者发现 FI >1 与增加努力相关,而 FI <1 则表明患者处于被动状态。特利亚斯等人。[35]开发了一种用于 Pmus 计算的算法;这有助于同步和异步呼吸期间的自动努力检测,但仍然需要 Pes。德哈罗等人。[36]分析了方流辅助通气期间的波形,其中爪变形(即流量不足)经常与增加的努力和/或流量设置不足相关。使用神经网络模型和 Pes 作为参考,识别出具有强烈吸气努力的呼吸[36]。最后,Soundoulounaki等人。[37]通过分析辅助模式期间的流量-时间曲线来检测微弱的努力。这些试点工作展示了潜力,但需要进一步验证研究,并应建立预测低或高努力的参考值。
监测呼气肌
关联
呼气肌经常被忽视,但在机械通气患者中经常发挥作用[10]:超过三分之二的成人在辅助通气下可能会发生主动呼气[11,26]。呼气肌肉的募集增强了呼气流量和肺排空,使膈肌更靠近颅骨,这有利于下一次吸气时产生张力,并减少呼气末肺容量,从而在放松时产生吸气流量。呼气肌肉收缩也会使机械通气患者的管理变得复杂。肺容量减少可能导致肺泡塌陷、周期性复张、V/Q 不匹配、肺弹性和驱动压恶化,从而可能加重肺损伤。事实上,ARDS 患者神经肌肉阻滞后氧合改善的一个可能机制可能是呼气肌肉活动的消除[38,39]。呼气肌肉募集也可能导致动态气道塌陷[40] ——肺不均匀性和气体交换障碍的另一种机制。
评估呼气肌肉用力
识别呼气肌肉募集的第一步是临床检查(腹壁肌肉的检查和触诊)和呼气流量时间波形的观察(图3)。如果在初始峰值之后,呼气流量没有呈指数下降而是增加,则应怀疑主动呼气[11,41]。呼气流量的典型指数下降并不排除主动呼气的可能性[11]。超声可用于测量腹壁肌肉厚度/增厚[42,43]。在健康个体中,腹部肌肉厚度的增加与肌肉的电活动[44]和压力产生[45,46]有很强的相关性;后者最近在 ICU 患者中得到证实,具有中等程度的重复性[45]。
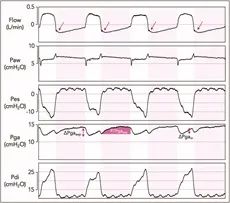
图 3:接受辅助通气并积极使用呼气肌的患者的流量、气道压力 (Paw)、食道压力 (Pes)、胃压力 (Pga) 以及由此产生的跨膈压力 (Pdi = Pga – Pes)。阴影区域代表呼吸机呼气阶段。根据呼气流量-时间曲线(参见流量追踪中的箭头)怀疑主动呼气肌肉的使用:呼气流量不会呈指数下降,而是增加,形成向上的凹度,并且流量有时无法在呼气末返回到零。通过 Pga 监测进一步量化呼气肌肉用力。吸气期间,由于膈肌收缩和随后腹压增加, Pga 增加(ΔPga in )。在主动呼气期间,腹部肌肉的收缩导致腹压增加,从而导致 Pga 增加,表现为 ΔPga exp。此呼气动作的能量消耗可以通过呼气 Pga 的压力-时间乘积 (PTPga exp ) 来估计,即呼气 Pga 曲线下的面积。
需要进行深入评估来量化呼气用力。与隔膜 sEMG 相比,记录呼气肌 sEMG 并未广泛使用,主要是由于技术挑战,特别是在危重患者中[27]。胃压(Pga)监测是目前测量呼气肌力量输出最简单的方法[13]。当呼气肌活跃时,Pga(以及胸膜压)在呼气期间增加,而在吸气开始时放松时,Pga 迅速下降。呼气 Pga 增加 (ΔPga exp ) 和吸气开始时 Pga 减少都已用于检测主动呼气[47]。然而,在吸气早期,Pga 可能会由于呼气肌肉松弛或吸气肌肉收缩而下降。因此,与早期吸气 Pga 下降相比,ΔPga exp与腹横肌 EMG 的相关性更好[48]。ΔPga exp的大小提供了呼气肌肉用力的量化,而这种用力的能量消耗可以通过呼气 Pga 的压力-时间乘积 (PTPga exp )来估计。后者可以通过计算呼气 Pga 波形下的面积得出,基线设置为静息末呼气 Pga [47](图 3)。
目前,没有数据根据 Pga 将呼气肌肉用力分级为强弱或有临床意义,但我们推断 ΔPga exp ≥1–2 cmH 2 O 可以被视为主动呼气。值得注意的是,与 Pes 的校准相比,没有方法可以校准胃气球充盈量或测量精度[13]。如有疑问,验证导管位置是否正确的最准确方法是 X 射线。
最终,当 Pga 监测不可用时,通过导尿管测量腹内压是识别和粗略量化呼气肌肉用力的简单方法。预测呼气肌用力大小的非侵入性方法尚未开发出来。然而,如上所述,临床检查、呼气流量时间波形检查和腹部肌肉超声是识别主动呼气是否存在的有价值的筛查工具。
对吸气努力监测的影响
呼气肌用力会干扰吸气用力和肺压力估计的解释。下一次吸气时呼气肌肉的放松会降低胸膜压;在计算吸气努力时应纠正此初始压降,但需要 Pga 监测。其次,Pplat 计算先决条件是吸气末闭塞期间的被动条件。即使明显平坦的平台压力也不排除呼气肌肉募集,导致肺压力高估[26]。此外,主动呼气将呼气末肺容量降低到低于 PEEP 对应的水平。在这种情况下,气道驱动压 (Pplat – PEEP) 会低估肺压力,因为由于呼气肌肉松弛,部分测量的潮气量在测量起点 (PEEP) 之前就已进入肺部。事实上,由于这种机制,相当多的患者的 ΔPL超过了气道驱动压[49]。此外,患者与呼吸机的异步,传统上被认为是吸气努力和呼吸机辅助之间的异步,可能是由腹部肌肉收缩引起的[11,50]。呼气肌募集对 P0.1 和 Pocc 可靠性的影响需要研究。关于脱机,呼气肌激活可能表明脱机失败[47,51]。
结论
有不同的工具可用于监测机械通气期间呼吸肌的努力——从无创筛查工具到更具侵入性的量化方法。这可以促进肺和呼吸肌保护方法中的个体化机械通气。不考虑呼气肌的呼吸肌用力评估是不完整的。
van Oosten, Julien P.a; Akoumianaki, Evangeliab,c; Jonkman, Annemijn H.a. Monitoring respiratory muscles effort during mechanical ventilation. Current Opinion in Critical Care ():10.1097/MCC.0000000000001229, November 15, 2024. | DOI: 10.1097/MCC.0000000000001229


