Biomaterials:锦州医科大学赵亮等团队合作研究发现“电荷重编程”碱化肿瘤细胞溶酶体促进多种癌症类型凋亡
时间:2025-03-30 12:08:49 热度:37.1℃ 作者:网络
溶酶体在调节癌症进展和耐药性方面起着至关重要的作用,迫切需要开发能够以可控方式有效调节癌症细胞溶酶体pH值的药物。
2025年3月12日,锦州医科大学赵亮、天津大学/天津医科大学郑斌共同通讯在Biomaterials上在线发表题为“Ultrasound-triggered lysosomal alkalinization to block autophagy in tumor therapy”的研究论文。该研究提出了一种压电触发的溶酶体碱化新策略。结果表明,超声刺激下,(BaTiO3/Zr/Ca)BCZT产生的电子有效地碱化了溶酶体。
分子动力学模拟进一步证明,溶酶体pH的改变导致V-ATP酶(质子泵)构象改变,增强了其与钠离子的相互作用,同时部分阻止氢离子进入溶酶体。这种机制有助于维持溶酶体碱化,降低水解酶活性,防止蛋白质降解和细胞器受损。纳米颗粒在溶酶体中的积聚导致溶酶体的膨胀和逐渐降解。溶酶体功能障碍阻碍了与自噬体的融合,抑制了肿瘤细胞的自噬并促进了各种肿瘤类型中的凋亡,显著抑制了小鼠肿瘤体积的增长。总之,该研究设计的压电触发溶酶体碱化策略为多种癌症的治疗带来了新希望。

溶酶体在癌症发展和耐药性中起关键作用。化疗是多种癌症的主要疗法,但溶酶体具有隔离亲脂弱碱性药物的能力。紫杉醇、阿霉素和阿霉素等疏水弱碱性化疗药物一旦由于质子化而积聚在溶酶体中,就很难通过溶酶体膜。此外,富集在溶酶体部位的抗癌药物最终被分泌到细胞外,导致细胞毒性降低和耐药性的产生。由于化疗药物细胞选择性差,毒副作用明显且易引起肿瘤细胞耐药,不利于肿瘤的可持续治疗。肿瘤细胞在恶性转化过程中改变溶酶体膜的鞘磷脂含量,出现溶酶体肥大现象,从而导致肿瘤溶酶体膜的稳定性下降和溶酶体膜通透性(LMP)降低。因此,迫切需要开发一种安全可控的治疗策略来碱化溶酶体,抑制肿瘤细胞自噬体融合,促进细胞凋亡。
在抗癌临床试验中,小分子药物氯喹(CQ)、羟氯喹(HCQ)和巴弗洛霉素是溶酶体酸化的靶向药物,可有效增加肿瘤细胞中溶酶体的pH值,从而逆转溶酶体诱导的药物分离。然而,此类疗法往往存在毒副作用,对正常细胞缺乏选择性,使得CQ和HCQ等小分子药物仅适合作为放疗和化疗药物(如阿霉素、卡铂、吉西他滨、替莫唑胺和铂类化合物)联合治疗的增敏剂,以增强抗癌功效。化学药物仍存在未解决的问题,包括对癌细胞的低选择性和长期治疗存在的毒副作用。因此,开发一种可以安全有效地碱化溶酶体以靶向和消除各种类型癌细胞的肿瘤疗法至关重要。
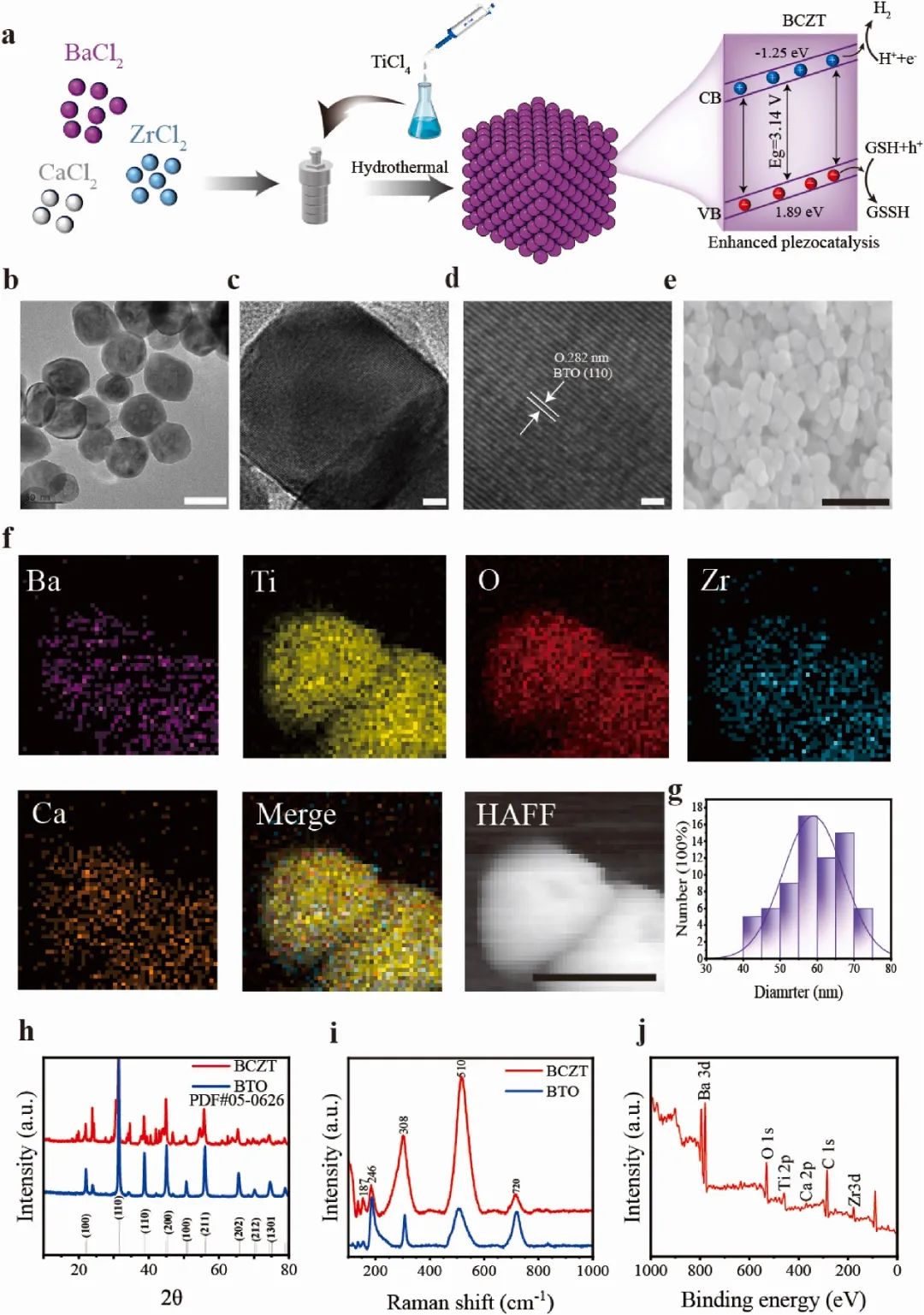
图1 BCZT纳米颗粒的制备和表征(摘自Biomaterials)
当压电材料受到外部机械应力时,中心对称性的缺乏会导致材料内的正负电荷中心发生偏移,从而导致极化。材料表面得到的电子(e−)可以催化底物的氧化还原反应或干预生物过程。基于此,作者开发了一种“纳米压电疗法”来重编程溶酶体电荷,得到的电子(e−)可以催化材料的氧化还原反应或干预生物过程。结果表明,BCZT可以在超声存在下远程且可控地与溶酶体中的氢离子结合产生氢气。蛋白质分子动力学模拟揭示了pH值升高时,囊泡质子转运ATP酶(V-ATP酶)的构象变化。V0区与钠离子的相互作用能增强,促使更多的钠离子聚集体被吸附。因此,由于静电力的排斥作用,氢离子通过V-ATP酶进入溶酶体的难度增加。进一步加剧溶酶体碱化,来自碱化癌细胞的溶酶体出现酶活性降低和自噬抑制。为验证这种方法的多功能性,作者成功诱导了六种类型的癌细胞死亡,包括常见和耐药变异体,如B16、CT26、A549、MDA-MB-231、A549-TAX和MCF-7/ADR。RNA测序和转录组学分析表明,电荷重编程疗法诱导的溶酶体碱化触发了癌细胞凋亡。在动物实验中,皮下肿瘤生长受到抑制,且没有任何癌细胞外毒性。该研究表明,电荷重编程疗法可以远程调控地碱化溶酶体,为多种类型癌症提供了一种潜在疗法。
参考消息:
https://www.sciencedirect.com/science/article/pii/S0142961225001693?via%3Dihub


