真实世界:结肠癌和直肠癌基因图谱有何差异,血液与组织突变检测一致性与ctDNA含量有关
时间:2025-03-30 12:08:39 热度:37.1℃ 作者:网络
MAPK信号通路的激活是结直肠癌(CRC)肿瘤发生过程中的一个重要驱动事件,它为治疗方案的选择提供了依据,但通过液体活检进行检测可能具有一定挑战性。研究者分析了真实世界的全面基因组分析(CGP)数据,以探究结直肠癌患者(N = 51982)中BRAF或RAS基因变异的情况,以及这些变异与其他生物标志物的共发生情况。在结肠癌样本(N = 42800)和直肠癌样本(N = 9182)中,分别有63.2%和57.9%发现了致病性的RAS或BRAF基因变异。在140例同时进行了基于组织和液体样本CGP的患者亚组中,当循环肿瘤DNA(ctDNA)肿瘤分数(TF)至少为1%时,液体活检对组织检测结果的敏感性达到了100%,这表明了组织和液体活检在检测CRC驱动基因变异方面的实用性。
研究背景
结直肠癌(CRC)是全球第三大常见癌症,对其进行的分子特征分析表明,WNT、MAPK和PI3K信号通路的激活,以及TGF-β和DNA损伤反应通路的变异,是CRC的常见特征。
在CRC中,MAPK信号通路常常因KRAS、NRAS或BRAF变异而被激活。RAS家族由三个密切相关的基因组成——KRAS、NRAS和HRAS,其中KRAS是CRC中最常发生变异的RAS家族基因,NRAS次之,而HRAS变异则是极为罕见的事件。KRAS或NRAS变异是CRC肿瘤发生过程中的重要驱动事件,是一种已知的靶向治疗的预测标志物,对于治疗方案的选择至关重要。
BRAF突变可细分为三类不同的类型:1类突变发生在V600位点,作为持续激活的单体发挥信号传导作用,是CRC中最常见的类型;2类突变形成不依赖RAS的RAF二聚体;3类突变具有较低的激酶活性或无激酶活性,但通过放大MAPK通路中的上游信号发挥作用。
重要的是,RAS和BRAF变异在很大程度上是相互排斥的,不过有研究称3类突变与RAS基因变异同时出现的频率更高。另一方面,1类突变在具有高度微卫星不稳定性的结直肠癌中高度富集。
不携带RAS/BRAF突变的肿瘤中,也存在大量能够诱导MAPK信号通路激活的其他基因变异,例如,RTK的激活型变异。在结直肠癌中,许多不同的RTK都曾被报道出现过这类变异。RTK的融合,如在结直肠癌中发生率较低的ALK、ROS1、RET和NTRK1-3的融合,就是突出的例子。其他激活型基因事件可能会影响EGFR、ERBB2或FGFR。
对于大多数转移性结直肠癌患者而言,一线靶向治疗联合化疗是标准治疗方案,靶向药物的类型(如抗EGFR、抗VEGF药物)取决于肿瘤的位置和分子状态(微卫星不稳定性、RAS和BRAF状态)。临床上已经在针对MAPK信号通路进行靶向治疗方面取得了进展,例如,在KRAS G12C或BRAF V600突变的癌症中。KRAS G12V和G12D抑制剂也在研发中。然而,在多线治疗中,最佳的治疗联合策略仍不明确。因此,需要进行全面的临床试验设计,以适应复杂且不断变化的基因组特征,并在临床试验中实现精准医疗。真实世界数据(RWD)是实现这一目标的重要工具,因为它能够对具有不同治疗史的大量患者队列进行深入分析。在此,研究者使用FoundationInsights™网络平台对RWD的临床基因组数据进行了分析,以探究结直肠癌中RAS、BRAF变异以及同时发生的其他基因变异谱。
研究结果
结直肠癌的RAS/BRAF变异谱:
在结肠癌患者样本中,36.8%的样本为RAS/BRAF野生型(RAS/BRAF-wt),而63.2%的样本分别存在已知或可能致病的RAS/BRAF变异(图1A)。在RAS/BRAF变异组中,76.8%的样本存在KRAS变异,5.6%存在NRAS变异,0.1%存在HRAS变异,15.2%存在BRAF变异。正如预期的那样,仅有2.3%的样本中同时出现RAS和BRAF变异(图1B)。
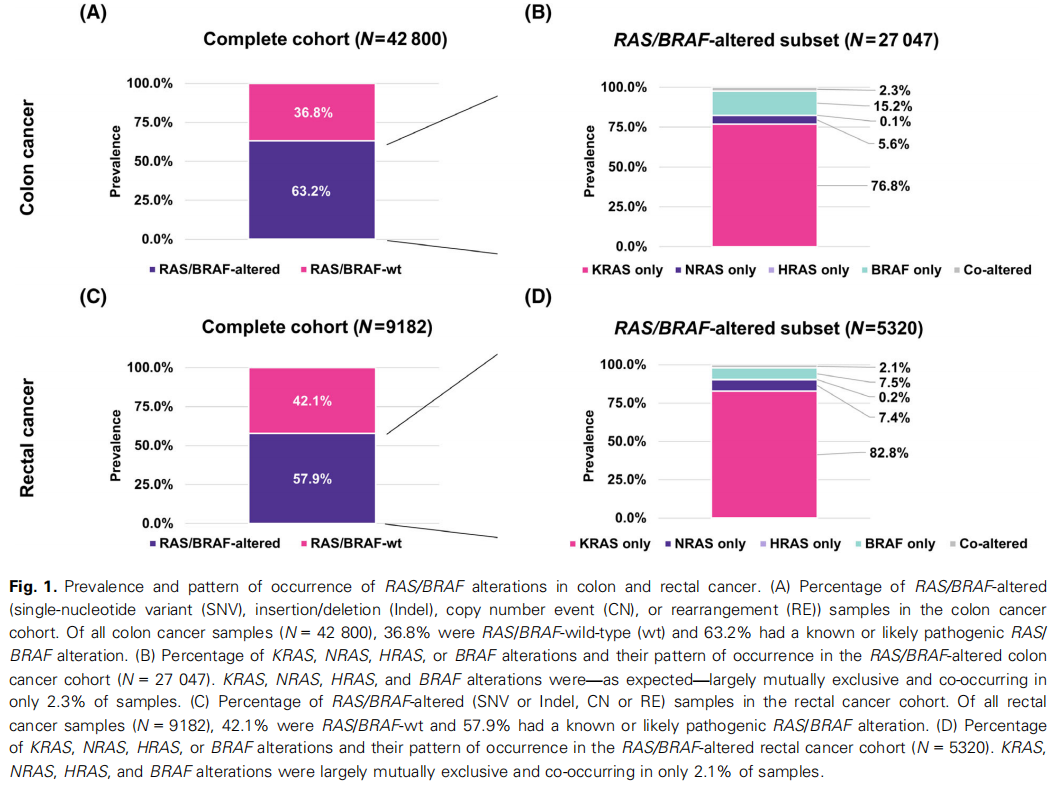
图1
在直肠癌样本中也观察到了类似的情况,其中42.1%的样本为RAS/BRAF野生型,57.9%的样本存在已知或可能致病的RAS/BRAF变异(图1C)。在RAS/BRAF变异组中,82.8%的样本存在KRAS变异,7.4%存在NRAS变异,0.2%存在HRAS变异,7.5%存在BRAF变异。同样,仅有2.1%的样本中同时出现RAS和BRAF变异(图1D)。
在结直肠癌中所有的KRAS和NRAS变异(单核苷酸变异(SNV)和插入/缺失(Indel)、拷贝数变异(CN)和基因重排(RE),无论其是否被标注为致病或位于热点区域)中,第2、3和4外显子的SNV或Indel分别占所有变异的96.0%和94.3%(图2A、B),其中大多数存在于已知的氨基酸热点区域之一。相比之下,在所有的HRAS SNV和Indel(N = 295)中,只有48个(16.3%)被归类为可能致病或致病的。
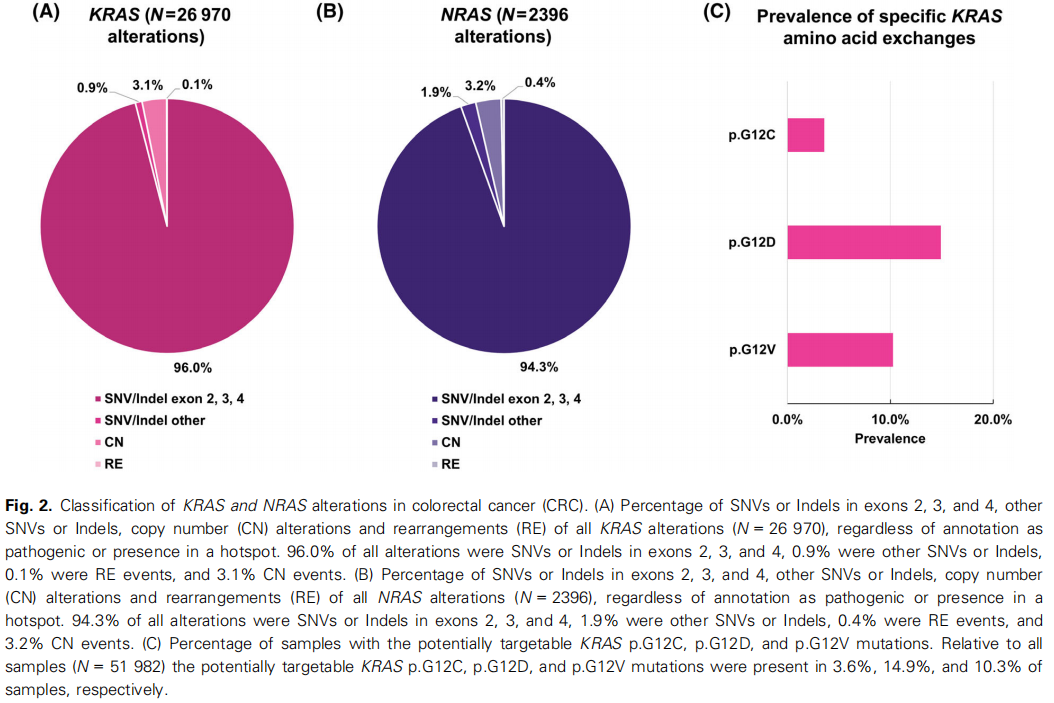
图2
相对于所有样本,潜在可靶向的KRAS p.G12C、p.G12D和p.G12V突变分别存在于3.6%、14.9%和10.3%的样本中(图2C)。
基于ctDNA和组织的CGP在检测KRAS、NRAS和BRAF V600E突变方面的一致性:
接下来,我们试图评估基于组织活检和基于液体活检(ctDNA)的CGP在检测KRAS、NRAS和BRAF V600E突变方面的一致性。一个亚组的140个样本在组织活检后的90天内采集了用于液体活检的样本,且具有相应的CGP检测结果。在这140对样本中,液体活检检测KRAS、NRAS和BRAF V600E突变的阳性一致率(PPA)分别为78.5%和90.0%,而阴性预测值(NPV)分别为77.3%和99.2%(图3A)。
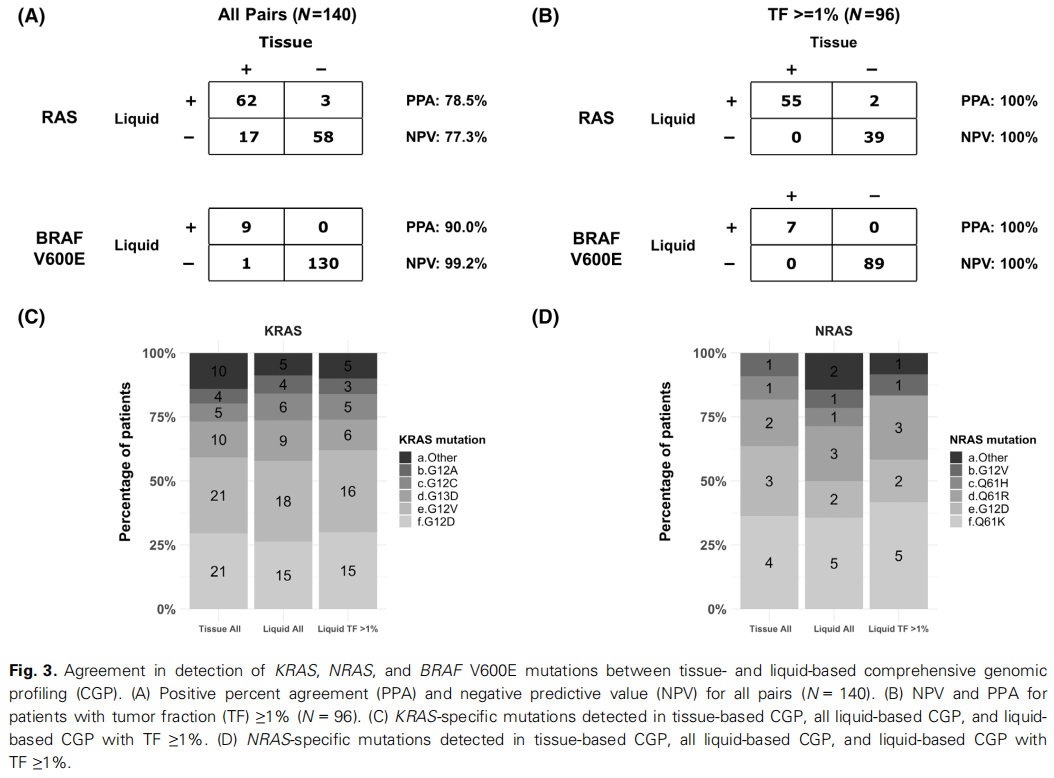
图3
在这些患者中,有96名(69%)患者的肿瘤脱落量较高,通过液体活检中ctDNA肿瘤分数(TF)≥1%来量化。在这些患者中,液体活检检测KRAS、NRAS和BRAF V600E的PPA和NPV均为100%(图3B)。
在配对的组织/液体样本队列中,最常见的KRAS变异的出现频率相似,包括G12D(组织样本中:30%;液体样本中:26%)和G12V(组织样本中:30%;液体样本中:32%)。在组织和液体样本中检测到的最常见的NRAS突变是NRAS Q61K(在整个组织和液体样本队列中均为36%,在TF≥1%的亚队列中为42%)(图3C、D)。
结肠癌和直肠癌中常见基因变异频率以及免疫肿瘤学生物标志物:
在更大的组织样本队列中,在结肠癌和直肠癌中变异频率最高的前10个基因中,重叠的基因位于相关的信号通路中,包括Wnt信号通路(APC)、RAS和PI3K信号通路(KRAS、PIK3CA)、TGFβ信号通路(SMAD4)和Notch信号通路(SOX9),此外还有肿瘤抑制基因,如TP53和FBXW7。
在结肠癌和直肠癌中,5个最常发生变异且潜在可靶向的基因分别是PIK3CA(19.6%和14.2%)、PTEN(8.7%和5.9%)、ERBB2(4.7%和6.0%)、EGFR(2.5%和2.0%)和FGFR1(2.0%和2.7%)。NTRK基因变异(NTRK1/2/3)分别存在于0.9%和0.5%的结肠癌和直肠癌样本中,ROS1基因变异分别存在于0.4%和0.2%的样本中,RET基因变异分别存在于0.6%和0.4%的样本中,ALK基因变异分别存在于0.5%和0.4%的样本中。在结肠癌中,与RAS/BRAF野生型亚组相比,RAS/BRAF基因变异亚组中PI3K信号通路基因PIK3CA、PTEN、AKT1和AKT2的变异显著富集(P < 0.01,采用Benjamini–Hochberg校正的Fisher精确检验),只有AKT3变异没有显著富集(P > 0.05,采用Benjamini–Hochberg校正的Fisher精确检验)。RTKs ALK、ROS1、NTRK1、RET、EGFR、ERBB2、FGFR1和FGFR2变异在RAS/BRAF野生型组中显著富集(P < 0.01,采用Benjamini–Hochberg校正的Fisher精确检验)。NTRK2、NTRK3、FGFR3和FGFR4没有显示出显著富集(P > 0.05,采用Benjamini–Hochberg校正的Fisher精确检验,图4A)。
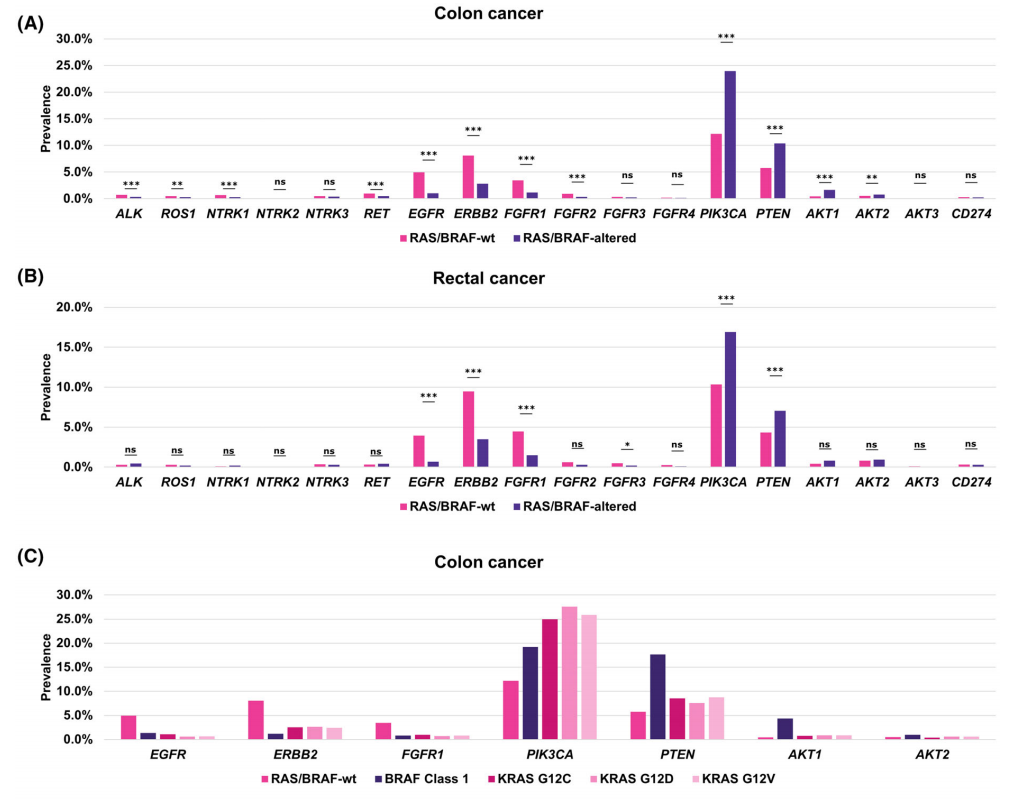
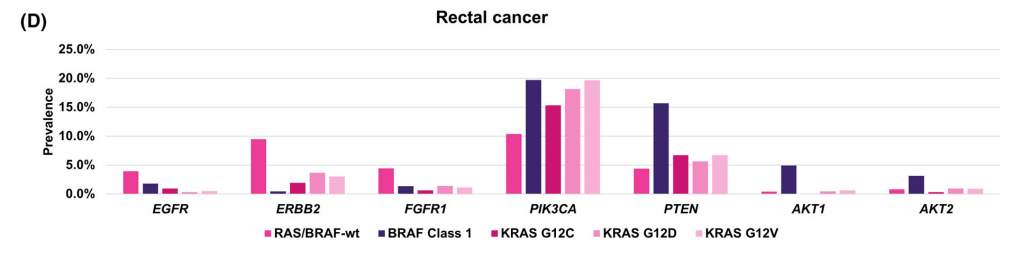

图4
在直肠癌中也可检测到类似的模式,其中PIK3CA和PTEN变异在RAS/BRAF变异亚组中显著富集,而EGFR、ERBB2、FGFR1和FGFR3变异在RAS/BRAF野生型亚组中显著富集(图4B)。进一步聚焦于BRAF 1类突变以及KRAS p.G12C、p.G12D和p.G12V突变,以及7种最常见的潜在可靶向基因变异的分析显示,PTEN、AKT1和AKT2变异在BRAF 1类突变样本中富集,而与结肠癌和直肠癌中的RAS/BRAF野生型样本相比,EGFR、ERBB2和FGFR1的变异频率在所有4个亚组中都较低(图4C、D)。
研究者还探究了免疫肿瘤学生物标志物的发生率,如微卫星不稳定性(MSI)、肿瘤突变负荷(TMB)和CD274(PD-L1)。
在结肠癌和直肠癌中,分别有6.1%和1.7%的样本为MSI-H。分别有9.6%和4.6%的样本为TMB-H。
值得注意的是,根据本研究中使用的定义,所有MSI-H样本中有98.9%同时也是TMB-H样本。此外,研究者POLE变异的发生率进行了量化,因为胚系和体细胞POLE变异是已知的导致结直肠癌高突变负荷的原因。在结肠癌和直肠癌中,分别有0.6%和0.4%的样本存在POLE变异。在结肠癌和直肠癌中,RAS/BRAF变异亚组中的MSI-H或TMB-H样本显著多于RAS/BRAF野生型亚组:在结肠癌的RAS/BRAF野生型亚组中,4.5%为MSI-H,7.8%为TMB-H,而在RAS/BRAF变异亚组中,7.1%为MSI-H,10.6%为TMB-H(P < 0.001,Fisher精确检验)。
在直肠癌的RAS/BRAF野生型亚组中,1.3%为MSI-H,4.1%为TMB-H,而在RAS/BRAF变异亚组中,2.0%为MSI-H,5.0%为TMB-H(P < 0.05,Fisher精确检验)。在结肠癌和直肠癌中,分别有0.3%的样本存在CD274变异。在RAS/BRAF野生型和RAS/BRAF变异样本之间,CD274变异没有显著富集。
在CD274基因中被归类为(可能)致病的变异中,大多数(81.6%)是拷贝数变异(图5A)。CD274基因中所有可能致病或致病的拷贝数变异事件均为扩增。在有PD-L1染色数据的CD274扩增样本亚组中,扩增组中PD-L1阳性(22C3)样本显著富集(P < 0.001,Fisher精确检验,图5B)。
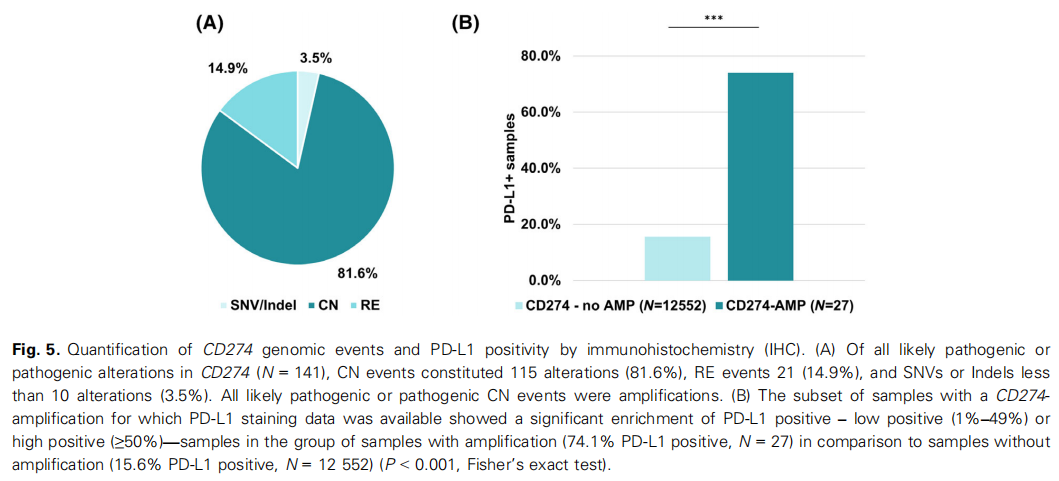
图5
MSI-H样本仅在BRAF 1类和HRAS突变的结直肠癌样本中更为常见:
重要的是,这种效应是由BRAF 1类突变样本驱动的。在所有结直肠癌病例中,与RAS/BRAF野生型样本相比,BRAF 1类突变样本中MSI-H样本显著富集(校正后P < 0.001,采用Benjamini–Hochberg校正的Fisher精确检验)。在BRAF 1类突变样本中,MSI-H样本的比例为30.3%,而RAS/BRAF野生型样本中只有3.9%为MSI-H。此外,存在(可能)致病的HRAS SNV或Indel的样本中,MSI-H样本也显著富集(校正后P < 0.001,采用Benjamini–Hochberg校正的Fisher精确检验),MSI-H样本的比例为59.1%。BRAF 3类(2.2%为MSI-H)、NRAS(1.5%为MSI-H)和KRAS(3.2%为MSI-H)突变样本中MSI-H样本较少。RAS/BRAF野生型和BRAF 2类(2.5%为MSI-H)突变样本之间没有显著差异(P > 0.05,采用Benjamini–Hochberg校正的Fisher精确检验,图6A)。与这一发现一致的是,与RAS/BRAF野生型、BRAF 2类或BRAF 3类突变样本相比,BRAF 1类突变样本中MLH1、MSH6和PMS2基因变异比例更高,但MSH2基因变异比例没有升高。存在HRAS SNV或Indel的样本中,无论HRAS变异被归类为可能致病/致病还是意义不明确/未知,MLH1、MSH6、PMS2和MSH2基因变异比例更高(图6C)。TMB的结果类似,不同之处在于BRAF 2类(7.3%为TMB-H)和3类(6.5%为TMB-H)突变样本与RAS/BRAF野生型(7.1%为TMB-H)样本相比没有显著差异(P > 0.05,采用Benjamini–Hochberg校正的Fisher精确检验)。在BRAF 1类突变样本中,TMB-H样本的比例为33.9%,在HRAS突变样本中为68.8%,在KRAS或NRAS基因变异样本中分别为6.7%和4.8%(图6B)。
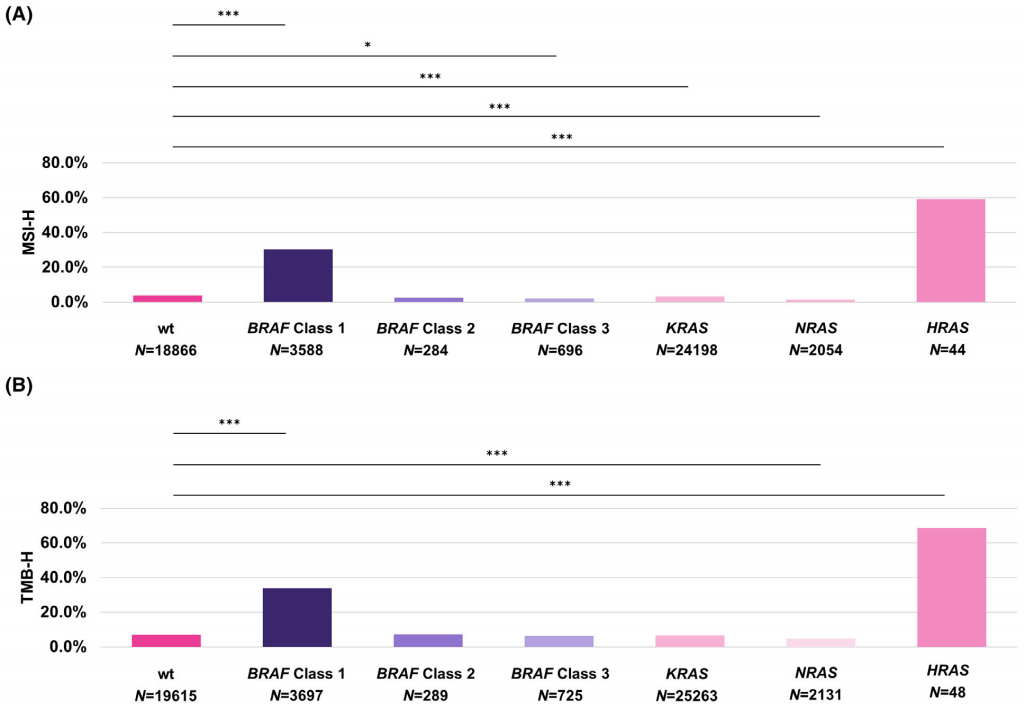
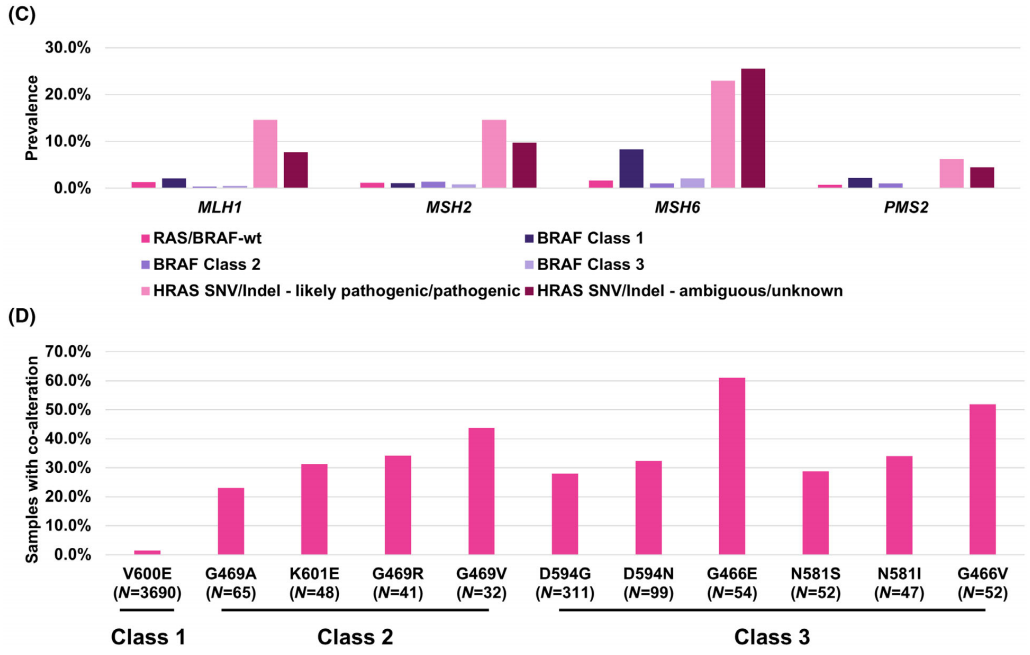

图6
在结直肠癌中BRAF 2类和3类突变常与RAS SNV或Indel同时出现:
最后,研究者根据该队列中10种最常见的BRAF突变(有关于其分类的信息),量化了有多少样本存在BRAF 1类、2类或3类突变与RAS SNV或Indel同时出现。值得注意的是,虽然BRAF V600E突变很少与RAS SNV或Indel同时出现(占样本的1.4%),但BRAF 2类突变(G469A—23.1%、K601E—31.3%、G469R—34.1%、G469V—43.8%)以及3类突变(D594G—28.0%、D594N—32.3%、G466E—61.1%、N581S—28.8%、N581I—34.0%、G466V—51.9%)常与RAS SNV或Indel(限于可能致病或致病)同时出现(图6D)。
讨 论
基于真实世界数据(RWD)的临床基因组分析为精准医疗提供了重要的见解,因为它能够获取来自大样本队列的数据,例如,对于那些在临床试验中未得到充分体现或总体上较为罕见的突变情况。
在这项研究中,RWD证实,通过基于组织和液体的CGP检测发现,结直肠癌中绝大多数的RAS变异是KRAS和NRAS基因第2、3和4外显子的SNV或Indel,且发生在已知的热点区域。当选择ctDNA TF≥1%的液体活检样本时,基于组织的CGP和基于液体的CGP在检测RAS和BRAF变异方面的一致性达到了PPA和NPV均为100%。已知ctDNA的浓度本身取决于肿瘤分期以及不同肿瘤之间ctDNA释放的生物学差异。
与先前的观察结果一致,在RAS/BRAF-wt样本中RTK基因变异富集,而在RAS/BRAF基因变异亚组中PI3K信号通路基因变异富集。PTEN、AKT1和AKT2基因变异在BRAF 1类突变样本中具有较高的发生率。
与先前在转移性结直肠癌中的研究一致,TMB-H和MSI-H样本在RAS/BRAF变异队列中显著更为常见,这种效应是由BRAF 1类突变样本驱动的。这证实了在这一亚组中,同时靶向BRAF 1类突变,结合AKT抑制和/或免疫检查点抑制是一种有吸引力的治疗理念。对于这一亚组的最佳治疗顺序,将需要开展更多聚焦于治疗顺序以及对免疫检查点抑制和/或AKT抑制剂的反应的精准医疗试验。本研究的大样本队列规模能够分别对BRAF 2类和3类突变样本以及HRAS突变样本进行特征分析。与早期报告一致,存在BRAF 2类和3类突变的样本并未显示出MSI-H样本的富集。有趣的是,极少数存在HRAS SNV或Indel的样本表现出独特的特征,即MSI-H样本显著富集,并且存在参与错配修复基因的共变异模式。
虽然在非BRAF V600E突变的结直肠癌中,同时发生的RAS突变的频率与早期研究相似,但研究者发现,在BRAF 2类和3类突变样本中,KRAS和NRAS基因的共变异都很常见,而并非局限于3类突变样本。出现这种情况的一个原因可能是患者的治疗史,例如,已知使用抗EGFR抗体治疗会使MAPK信号通路基因变异富集。
这项研究的优势在于样本队列规模大(N = 51982),这使得研究者能够从数量空前的具有罕见基因变异的病例中生成有意义的数据。总之,从基于组织和液体活检的CGP中挖掘真实世界数据能够提供有价值的见解,并且有潜力在为关键临床决策提供信息方面发挥重要作用,例如包括患者选择和分层标准在内的全面临床研究设计。
参考文献:
Schulze M, Wang X, Hamad J, et al. Real-world genomic landscape of colon and rectal cancer. FEBS Open Bio. Published online January 26, 2025. doi:10.1002/2211-5463.13957



