问诊分析:肺癌术后说是早期,结果MRD检测变阳性了!怎么办?怎样的病例需要MRD检测?
时间:2025-03-28 12:10:13 热度:37.1℃ 作者:网络
前言:有没有一种办法能监测肺癌术后会不会复发?或者能更早发现复发或转移?这不单是患者,也是医生孜孜以求的。就如我之前科普的“真早期”与“伪早期”的概念一样,可惜临床上没有十分确切的办法来甄别。目前影像上最先进的是PET-CT检查,检验上最先进的是MRD检测。但我们知道即使PET-CT检测也是许多病理良性的报恶性,恶性的会报良性,达不到100%,也就是说会有假阳性与假阴性。同样MRD对转移复发的预测可靠性更不如PET对影像的准确性。如何提高这类检查的准确性,如何评估PET的阳性或MRD的阳性,从而提早进行干预治疗?在技术达不到十分准确的前提下,我认为结合术前影像、病理分型、随访进展情况、风险因素等综合评估,或许是相对可靠的权宜之计。今天分享的这个病例做了肺癌手术,说是早期的,但随访监测MRD时发现转为阳性,临床该如何来评估与决策,希望本文能给大家一点启示,并能有专业人士参与留言讨论。
(一)病例情况
病史信息:
基本信息:
女性, 52岁 。
疾病描述:
2024年4月体检发现肺实行结节,无不适。遂于某人民医院由上海某医院某教授行胸腔镜手术切除肺右下叶,病理肺腺癌,浸润型,中分化,腺泡为主,详细请看病理报告和基因检测报告。7天后出院,一月后,三月,六月三次复查,同时MRD监测。最近一次2月底MRD阳性。 请问医生,这是复发了吗?后续该如何处理?
希望获得的帮助:
请问医生:根据14基因芯片分子风险评估模型,我这种情况是哪种风险等级?术后需要治疗吗?现在开始治疗晚不晚?
资料展示:

术前影像示右下叶实性病灶,表面浅分叶,整体有膨胀感,见支气管截断征。是典型的恶性影像表现,而且没有明显磨玻璃成分,是传统肺癌。
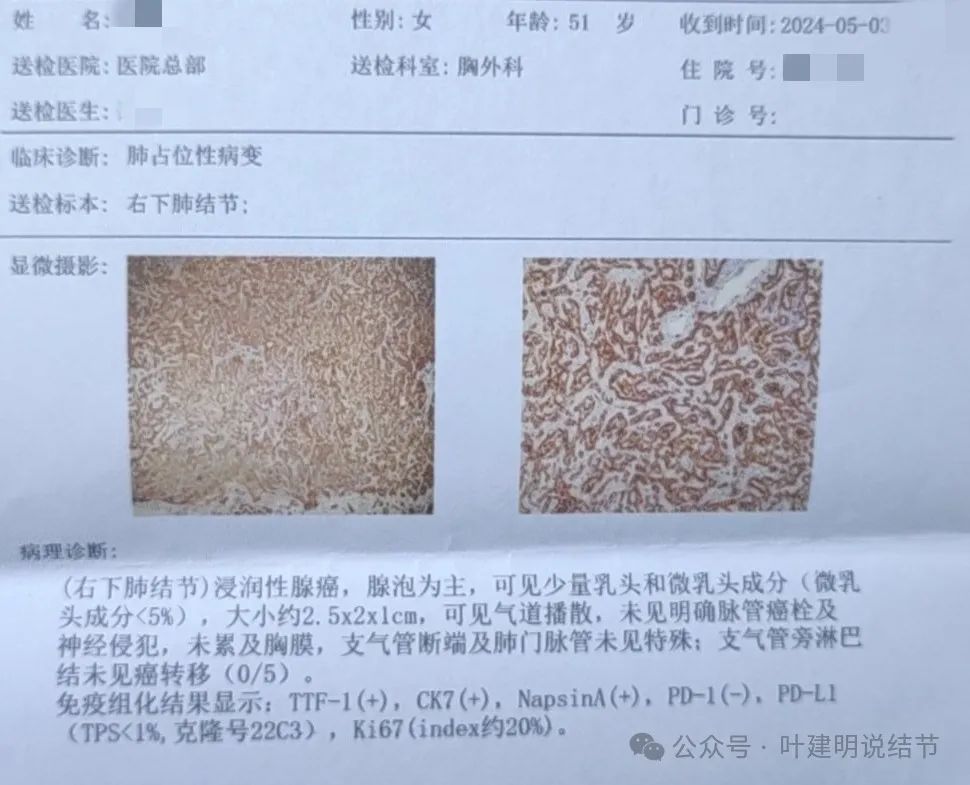
病理报告示浸润性腺癌,腺泡为主,有少量乳头和微乳头成分,其中微乳头成分不足5%,长径2.5厘米。有高危因素:气道播散。支气管旁淋巴结有5枚,未见转移,未见纵隔淋巴结情况。

出院记录中显示手术是“经胸腔镜肺癌根治术”。

术后基因检测示存在EGFR突变。

MRD监测提示前两次阴性,第三次2月底的转为阳性。
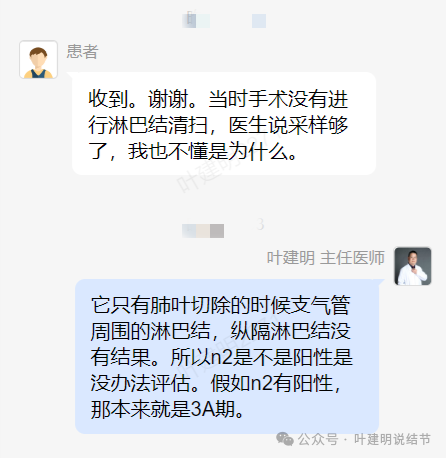
我问他为什么没有纵隔淋巴结采样或清扫的结果,患者回复是:当时手术没有进行淋巴结清扫,医生说采样就够了。
我的回复:
我想我们这样来考虑问题:
1、术前的影像是不是符合恶性程度高的肿瘤:因为现在磨玻璃密度或者混合磨玻璃密度的病灶非常常见,相对而言完全实性的传统肺癌反而占比小了。但是你的病灶是完全实性的,有支气管截断、有边缘锯齿状,一眼看去就是典型的肺癌影像表现,而且没有磨玻璃成分,就是说是传统意义上的肺癌。传统的肺癌即便是早期的,按照指南上的说法也只有百分之七十几的5年生存率。为什么?就是因为有百分之二十几是伪早期。所以你的这个病灶从术前影像上看,是有伪早期的可能性的;
2、术后病理分期是什么,准不准确:如果按照病理报告,你的肺癌分期是1A3,但是我看淋巴结只有支气管旁淋巴结,没有报告纵隔淋巴结的情况,不知道是你没有上传还是手术的时候没有清扫而采样。假如说没有纵隔淋巴结采样,那这个分期并不是非常准确,所以有存在实际上是3A期的可能性;
3、术后需不需要辅助治疗:按照术后辅助治疗指南,如果是1B期,存在EGFR突变,并有高危因素或者高危亚型,还是建议术后奥西替尼靶向治疗的。你的是1A3,与1B差一点点,但是既有高危亚型,又有高危因素,按我之前的分析,我认为是可以往1B靠的。也就是说可以考虑术后辅助靶向治疗;
4、MRD阳性的价值与意义到底如何:按照有关文献统计,MRD比影像学一般中位要早3~4个月发现转移(此处可能记忆错误,或不同文献的不同)。所以,你的MRD阳性,结合术后病理结果,存在微转移,或者几个月以后发现影像学可见的转移灶,这样的概率是存在的,而且概率偏大。所以综合而言,我倾向于给予奥西替尼或者伏美替尼等三代TKI治疗比较稳妥,并且在监测MRD。意见供参考!
(二)MRD是什么意思,如何评价肺癌MRD检测的意义,如何选择MRD检查的适应证
(这种概念性的东西先来问问Deepseek)
肺癌的微小残留病灶(Minimal Residual Disease, MRD)检测是目前肿瘤精准医疗领域的重要研究方向,其核心在于通过高灵敏度的检测技术发现传统影像学或病理学无法检测到的残留肿瘤细胞或分子标志物。
一、肺癌MRD检测的目的和意义
1. 临床目的
复发风险分层:术后或治疗后MRD阳性患者复发风险显著高于MRD阴性者,检测可识别高危人群,指导个体化干预。
指导辅助治疗决策:通过MRD状态决定是否需要强化治疗(如术后化疗、靶向或免疫治疗),避免过度治疗或治疗不足。
动态监测疗效:在放化疗、靶向治疗或免疫治疗过程中,MRD的动态变化可反映治疗反应,及时调整方案。
早于影像学发现复发:部分研究表明,MRD检测可比影像学提前数月至半年预警复发,为早期干预争取时间。
2. 科学意义
揭示肿瘤异质性:MRD检测可发现原发灶以外的耐药克隆或转移相关基因变异,为精准治疗提供靶点。
推动“治愈”标准革新:传统“无瘤状态”(NED)可能被“分子无瘤状态”(Molecular-NED)补充,重新定义疗效评估体系。
促进临床试验设计:以MRD为终点的研究(如辅助治疗降阶梯或升阶梯试验)可能加速新药开发。
二、MRD检测的适应证选择
适应证需结合肺癌分期、治疗阶段、检测技术特点及患者意愿综合判断:
1. 推荐适应证
(1)术后辅助治疗阶段:
可手术肺癌(I-III期):术后血液或组织样本检测MRD,用于预后评估及辅助治疗决策。
高危因素患者:如淋巴结转移(N+)、脉管侵犯、低分化肿瘤,即使分期较早(如IB期),MRD检测价值更高。
(2)局部晚期肺癌(III期):
根治性放化疗后MRD检测,指导巩固治疗(如免疫维持治疗)。
(3)晚期系统治疗后:
靶向/免疫治疗达到影像学缓解的患者,MRD检测可能提示停药时机或维持治疗必要性。
(4)临床试验入组:
作为分层因素或研究终点,如MRD指导的降阶梯治疗试验。
2. 需谨慎评估的适应证
(1)早期肺癌(IA期):复发风险低,MRD检测性价比需权衡,可能仅限研究场景。
(2)无法根治的晚期肺癌:肿瘤负荷高时,MRD检测对治疗决策影响有限。
(3)检测技术局限性场景:如血液ctDNA丰度过低(如鳞癌)、组织样本不足时,需结合多组学(如甲基化、CTC)提高敏感性。
3. 技术选择要点
检测方法:
ctDNA检测:主流技术,需覆盖患者个体化突变(如通过肿瘤组织全外显子测序定制Panel)。
多组学整合:联合ctDNA、CTC、外泌体或免疫标志物(如TMB)提高敏感性。
时间节点:术后2-4周基线检测,后每3-6个月动态监测(参考NCCN指南动态监测建议)。
三、现存挑战与未来方向
1.标准化问题 :检测阈值、Panel设计、采样时间尚未统一(如肺癌MRD联盟正在推进标准化)。
2.临床验证不足:多数证据来自回顾性研究,前瞻性试验(如LUNGCA-1、MERMAID)结果待公布。
3. 成本效益比:需结合卫生经济学评估,明确哪些人群真正获益。
总结:
肺癌MRD检测的核心价值在于实现从“群体化治疗”到“个体化动态管理”的转变。适应证选择应聚焦于可能改变治疗决策的中高危人群,同时强调多学科协作(MDT)及患者参与决策。未来随着技术优化和证据积累,MRD或将成为肺癌全程管理的关键生物标志物。
(三)相关研究情况解析(转自公众号《郑正有词话肺癌》)
早在上世纪九十年代,科学家就已经在肿瘤患者血液中发现一种特定的DNA碎片,即悬浮肿瘤DNA(circulating tumor DNA, ctDNA)。这部分ctDNA,来源于肿瘤细胞坏死、凋亡和分泌的小片段DNA,其携带全面的肿瘤基因信息。而且,随着研究的深入,科学家发现,肿瘤在任何阶段都会向血液中释放ctDNA,并且随着肿瘤越长越大,分泌的量会越来越多。因为肿瘤患者血液中有一大堆的循环游离DNA(cell-free DNA, cfDNA),其中绝大部分来自正常细胞,而只有极少数来自肿瘤细胞;而且,肿瘤越早期,这部分ctDNA所占比例越低。检测到它们是困难的。所幸,基因检测技术在近年来飞速发展,已有几个头部基因检测公司具备了这样的技术,可以通过抽血检测ctDNA预测肿瘤复发,即ctDNA-MRD技术。MRD是molecular residual disease的简称,代表分子水平的肿瘤残余状态。
打个比方,如果传统检查是发现牛魔王,那么ctDNA检查针对的就是牛魔王身上的牛虱子。所以针对手术切除的肺癌患者,因为原发肿瘤已经切除,传统影像学检查无从评估,而如果此时以ctDNA-MRD技术进行检测,就可以很好地反应血液中的肿瘤残余现象,从而预测其复发状态。四川华西医院胸外科的刘伦旭教授在Clinical Cancer Research上发表了一项前瞻性临床研究,纳入330名I-III期非小细胞肺癌,在手术前/术后3天以及术后1个月抽取血液标本检测其ctDNA水平。研究发现,术后ctDNA阳性患者(不论是术后3天还是术后1个月)的复发风险比阴性患者高11倍!进一步的分析显示,针对术后ctDNA阳性患者开展术后化疗可以有效延长生存(死亡风险下降70%),而针对术后ctDNA阴性患者开展术后化疗则会降低生存(死亡风险提高3倍)。更值得注意的是,ctDNA-MRD检测发现复发的时间比传统影像学检查提前273天!
在动态ctDNA-MRD技术的随访支持下:持续的ctDNA下降,MRD水平下降,提示治疗有效;持续的ctDNA清零,MRD水平清零,提示病灶彻底清除;持续的ctDNA上升,MRD水平上升,提示肿瘤负荷增多,复发风险增高。
2008年发表在Journal of Clinical Oncology上的一篇文章,把过去针对肺癌术后化疗的数据做了一个汇总分析,发现即便在高风险人群中,术后化疗也仅仅是把5年生存率提高5.4%。其实关键就是我们不能有效识别那些真正可以从化疗中获益的人群。
ctDNA-MRD技术的出现,在理论上,ctDNA直接由肿瘤释放,肿瘤越大、ctDNA释放越多,可以很好地反应肿瘤负荷;在技术上,我们已经可以实现对微量ctDNA的有效提取,并拥有了可以从ctDNA到MRD状态的成熟算法;在应用上,ctDNA-MRD技术已经在真实世界研究中得到广泛探索,并在前瞻性临床研究(LUNGCA)中得到进一步确证。在LUNGCA数据中,有一组数据,其患者中,术后MRD阳性患者仅仅26例,占总体患者比例8%。这部分患者中,给予化疗可以有效降低约80%的复发风险。但是,除了他们,其他都是MRD阴性患者,达304例,占总体患者比例高达92%。这部分患者中,给予化疗会增加60%的复发风险。
(四)叶建明学习感悟与想法
今天我们不讨论中晚期本来就需要辅助治疗的患者人群,因为这部分群体本就要给予辅助治疗并影像学复查监测(或加MRD监测),或者如郑博士文章中所给出的结论的话,术后辅助化疗可否按MRD结果来定,阴性就不必化疗,阳性的才化疗?但这由于目前仍未纳入指南的建议,所以事实上仍是在研究阶段。
今天结合前面分享的病例,我们来想想,对于术后分期是早期或中期肺癌,尤其是1A期的非小细胞肺癌,我们到底要不要做MRD检测,以及如何如何决策术后是否要辅助治疗?
叶建明认为:不管影像学的随访还是MRD的监测,目的都是希望早点发现转移,从而及早干预,期望获得更好的预后。我们可否这样来考虑:
1、风险低,很可能是“真早期”的病例,不需要MRD检测:包括原位癌、微浸润性腺癌以及浸润性腺癌贴壁为主型,也包括中分化并含贴壁成分的浸润性癌,而分期仍在1A期的。
2、分期在2期以上,反正要术后辅助治疗的,不一定要MRD检测:因为前面说了,这个人群本来就必要辅助治疗的,若以后指南说按MRD区分是否给予术后辅助治疗,那么当然要检测的。
3、分期在1B期又有高危亚型或高危因素,按术后辅助治疗指南该考虑术后辅助治疗而对化疗或靶向治疗又心存疑虑的可以考虑MRD检测:因为有高危因素或高危亚型并不等于存在微转移,不等于是“伪早期”,此时若依MRD的结果来决定是否辅助治疗应该多了一个强有力的依据。至少在MRD阴性时拒绝辅助治疗多了心理上的安慰。
4、分期在1A期,尤其是1A2或1A1期,但低分化,高危亚型占比高的应该考虑MRD检测:检测的目的若是阳性,当然应该采取相对积极的术后辅助治疗措施,阴性则按术后辅助治疗指南只随访不治疗。
总体而言,我们无法从影像上更早发现肿瘤复发转移,MRD又做不到100%准确,价格却相对较高,如何综合评估筛选适合的人群,既让检查更有价值,又不至于过度检查浪费资源,花冤枉钱,结合目前所能得到的病理亚型、高危因素,或再结合术前随访过的话,进展快慢等多因素评估或许是合理的。


