Nat Cancer | 靶向 zDHHC8:通过调控 GPX4 棕榈酰化增强肿瘤细胞铁死亡敏感性
时间:2025-03-20 12:09:06 热度:37.1℃ 作者:网络
铁死亡(ferroptosis)是一种由铁催化的脂质过氧化驱动的程序性细胞死亡方式,与多种疾病密切相关,尤其在肿瘤进展中扮演重要角色。CD8+ 细胞毒性 T 细胞能够通过诱导铁死亡来杀伤肿瘤细胞,但肿瘤细胞常通过抵抗铁死亡实现免疫逃逸。S-棕榈酰化是一种可逆的蛋白质脂质修饰,能够调节蛋白质的稳定性、亚细胞定位和活性,但其在铁死亡中的作用尚不清楚。
3月19日,Nature Cancer杂志发表了一项开创性研究,揭示了锌指 DHHC 域蛋白 8(zDHHC8)通过调控谷胱甘肽过氧化物酶 4(GPX4)的 S-棕榈酰化,显著影响肿瘤细胞对铁死亡的敏感性,并为抗肿瘤免疫提供了新的策略。题目为“Palmitoylation of GPX4 via the targetable ZDHHC8 determines ferroptosis sensitivity and antitumor immunity”

研究团队通过高通量小分子化合物筛选,发现棕榈酰化抑制剂 2-溴棕榈酸(2-BP)能够显著增强多种肿瘤细胞(包括人成纤维肉瘤细胞 HT-1080、黑色素瘤细胞 A375、B16-F10 和结直肠癌细胞 MC38)对铁死亡诱导剂(如 RSL3、ML162 和 IKE)的敏感性。进一步研究发现,谷胱甘肽过氧化物酶 4(GPX4)是铁死亡的关键调节因子,其 S-棕榈酰化修饰对铁死亡抵抗至关重要。通过构建 GPX4 突变体和竞争肽,研究者确定了 GPX4 的第 75 位半胱氨酸(Cys75)是其主要的棕榈酰化位点。
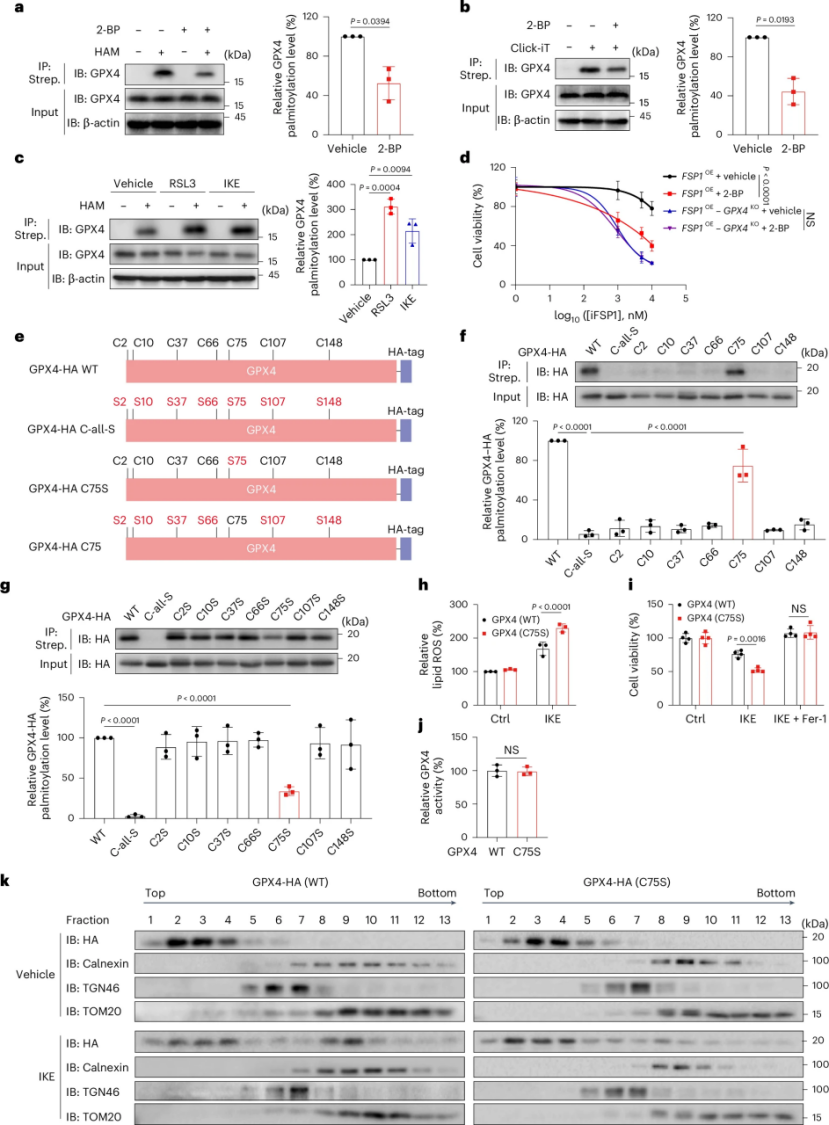
图 GPX4 的棕榈酰化对于铁死亡抗性至关重要
为了鉴定负责 GPX4 棕榈酰化的酶,研究者对 zDHHC 家族成员进行了筛选,发现 zDHHC8 是 GPX4 棕榈酰化的主要酶。共免疫沉淀实验和分子对接分析表明,zDHHC8 能够与 GPX4 相互作用,并且铁死亡诱导剂能够增强这种相互作用。zDHHC8 的催化位点 Cys134 与 GPX4 的 Cys75 在空间上接近,这可能是 GPX4 主要棕榈酰化位点为 Cys75 的原因。在 zDHHC8 缺失(KO)的细胞中,GPX4 的棕榈酰化水平显著降低,细胞对铁死亡的敏感性显著增加。
基于 zDHHC8 的关键作用,研究者通过虚拟筛选和分子对接分析,从约 22 万种小分子化合物中筛选出 PF-670462 作为 zDHHC8 的特异性抑制剂。PF-670462 能够显著增强多种肿瘤细胞对铁死亡诱导剂的敏感性,并且这种作用不依赖于其已知的靶标 CK1δ/ε。实验表明,PF-670462 通过与 zDHHC8 的 N 端结构域结合,促进 zDHHC8 的溶酶体降解,从而降低 GPX4 的棕榈酰化水平。
在体内实验中,PF-670462 显示出良好的耐受性,未对正常组织造成明显毒性。在 B16-F10 荷瘤小鼠模型中,PF-670462 处理显著抑制了肿瘤生长,增强了脂质过氧化水平,并且促进了 CD8+ T 细胞的浸润。此外,PF-670462 处理的肿瘤中 IFN-γ、TNF 和颗粒酶 B(GZMB)阳性的 CD8+ T 细胞数量显著增加,表明 PF-670462 能够增强 CD8+ T 细胞的细胞毒性功能。值得注意的是,铁死亡抑制剂 Liproxstatin-1 能够逆转 PF-670462 的抗肿瘤效果,进一步证实了 PF-670462 通过增强铁死亡敏感性来抑制肿瘤生长。此外,PF-670462 与抗 PD-1 免疫检查点抑制剂联合使用时,能够显著增强抗肿瘤效果,延长小鼠的生存期。
综上所述,该研究不仅揭示了 zDHHC8-GPX4 轴在调控肿瘤细胞铁死亡敏感性中的关键作用,还发现了 PF-670462 这一潜在的治疗靶点。通过靶向zDHHC8,可以增强肿瘤细胞对铁死亡的敏感性,进而促进抗肿瘤免疫反应。未来,基于 zDHHC8的靶向治疗有望成为肿瘤治疗的新方向,为患者带来新的希望。
原始出处:
Liang Zhou, et al. 2025.Palmitoylation of GPX4 via the targetable ZDHHC8 determines ferroptosis sensitivity and antitumor immunity. nature cancer


