Cancer Cell | HIF-1α:解锁肿瘤铜死亡抵抗之谜
时间:2025-03-19 12:09:16 热度:37.1℃ 作者:网络
铜死亡(cuproptosis)是指铜离子过量积累导致的细胞死亡,其与铜稳态和蛋白质脂酰化密切相关。铜死亡的发现为癌症治疗提供了新的思路,但其在实体肿瘤中的应用受到低氧微环境的限制。低氧微环境是实体肿瘤的特征之一,会导致肿瘤细胞代谢重编程,增强其生存能力。研究表明,低氧条件下肿瘤细胞对铜死亡的抵抗性显著增强,但其具体机制尚不清楚。
HIF-1α是低氧条件下细胞适应的关键转录因子,能够调控多种基因的表达,参与细胞的能量代谢、血管生成和细胞存活等过程。在肿瘤中,HIF-1α的异常激活与肿瘤的恶性进展、耐药性和预后不良密切相关。因此,研究HIF-1α在铜死亡中的作用及其调控机制,对于开发新的癌症治疗策略具有重要意义。
近期,《Cancer Cell》杂志发表了一项重要研究,揭示了低氧诱导因子-1α(HIF-1α)在调控肿瘤细胞铜死亡抵抗中的关键作用及其分子机制,为癌症治疗提供了新的靶点和策略。题目为:Hypoxia inducible factor-1a drives cancer resistance to cuproptosis

研究者利用空间转录组测序技术分析了透明细胞肾细胞癌(ccRCC)和乳头状甲状腺癌(PTC)的肿瘤组织,识别出低氧和常氧区域,并计算了铜死亡和低氧的评分。结果显示,低氧区域的铜死亡评分显著低于常氧区域,表明低氧微环境可能促进肿瘤细胞对铜死亡的抵抗。单细胞RNA测序分析进一步证实了低氧细胞簇与铜死亡抵抗细胞簇的高度重叠。实验结果表明,低氧条件显著减轻了铜载体(如elesclomol和CuCl₂)诱导的铜死亡,且HIF-1α的敲除能够恢复癌细胞对铜死亡的敏感性,而HIF-1α的过表达则增强了铜死亡抵抗性。
研究者进一步探讨了HIF-1α调控铜死亡的具体机制。他们分析了铜死亡相关基因的表达变化,重点关注了二氢硫辛酰胺S-乙酰转移酶(DLAT)的表达。DLAT是线粒体丙酮酸脱氢酶复合体(PDH)的关键亚基,也是铜的靶标蛋白。结果显示,低氧条件下DLAT及其脂酰化形式(lip-DLAT)的表达显著下调,且这种下调依赖于HIF-1α。HIF-1α通过激活丙酮酸脱氢酶激酶1和3(PDK1/3)来抑制DLAT的表达。PDK1/3能够磷酸化PDH复合体中的E1α亚基,导致PDH失活,进而减少DLAT的表达。通过CRISPR/Cas9技术敲除PDK1和PDK3能够恢复DLAT的表达,并增强癌细胞对铜死亡的敏感性。
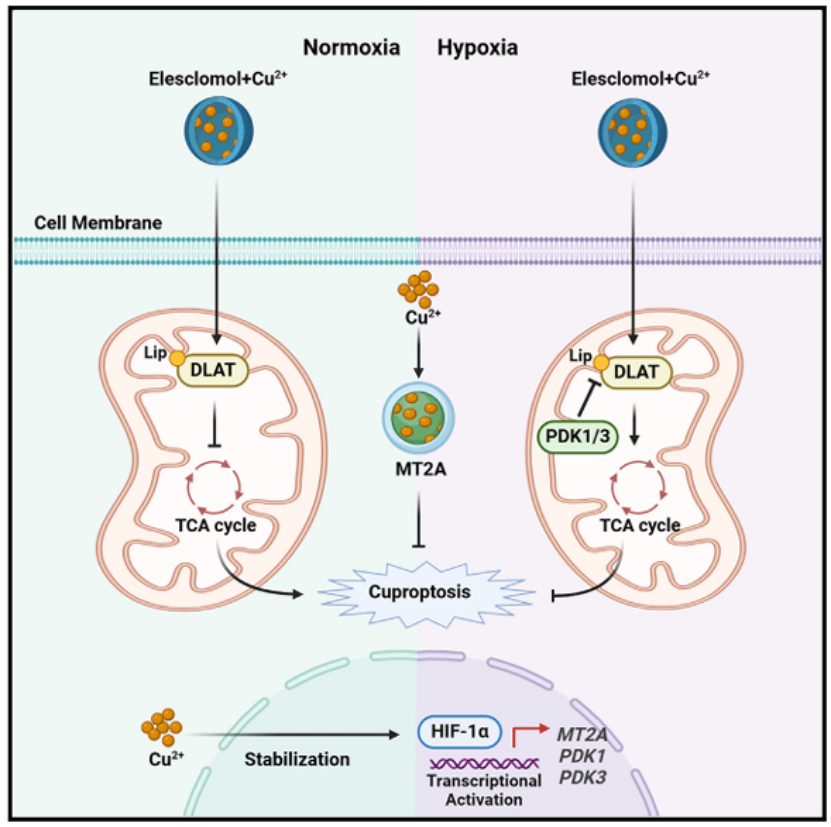
研究模式图
研究者进一步分析了HIF-1α在铜稳态中的作用。他们检测了多种金属硫蛋白(MT)家族成员的表达变化,发现MT2A在低氧条件下显著上调,且这种上调依赖于HIF-1α。MT2A主要定位于细胞核和细胞膜,与线粒体共定位较少。低氧条件下,MT2A的表达显著上调,且HIF-1α的敲除能够抑制MT2A的表达。此外,低氧条件下线粒体铜水平显著降低,而MT2A的过表达能够进一步降低线粒体铜水平,增强铜死亡抵抗性。相反,MT2A的敲除则增加了线粒体铜水平,加剧了铜载体诱导的铜死亡。
研究者进一步探讨了铜与HIF-1α之间的相互作用。结果显示,铜处理显著增加了HIF-1α蛋白的稳定性,且这种稳定性增加不依赖于HIF-1α mRNA水平的变化。铜处理显著减少了HIF-1α的泛素化水平,表明铜能够抑制HIF-1α的降解。金属亲和力实验和分子对接分析表明HIF-1α与铜具有较高的亲和力,铜能够直接结合HIF-1α,抑制其与E3泛素连接酶复合体的相互作用,从而阻止HIF-1α的降解。
基于上述发现,研究者进一步探讨了HIF-1α抑制剂在铜死亡治疗中的应用潜力。他们利用HIF-1α抑制剂PX-478处理肿瘤细胞,并检测了其对铜载体诱导的铜死亡的影响。结果显示,PX-478能够显著增强肿瘤细胞对铜载体诱导的铜死亡的敏感性,且这种增强效应在多种癌细胞系中均得到验证。在体内模型中,PX-478与低剂量铜载体(CuCl₂ 0.25 mg/kg)联合治疗显著抑制了肿瘤生长,且未引起明显的肝损伤或其他不良反应。相反,高剂量铜载体(CuCl₂ 2.5 mg/kg)治疗虽然也能抑制肿瘤生长,但引起了严重的肝损伤。
综上所述,本研究深入揭示了HIF-1α在肿瘤细胞抵抗铜死亡中的关键作用及其分子机制,为癌症治疗提供了新的靶点和策略。研究发现,HIF-1α通过抑制DLAT表达和促进MT2A积累来抑制铜死亡,且铜能够稳定HIF-1α蛋白,形成一个正反馈循环,进一步增强铜死亡抵抗性。此外,研究还发现HIF-1α抑制剂能够增强肿瘤细胞对铜死亡的敏感性,且联合治疗策略在体内模型中表现出良好的抗肿瘤效果和安全性。未来的研究可以进一步探索HIF-1α抑制剂的临床应用潜力,开发更有效的HIF-1α靶向药物,为癌症治疗提供新的思路和方法。
原始出处:
Hypoxia inducible factor-1α drives cancer resistance to cuproptosis. Cancer Cell. 2025 Mar 4:S1535-6108(25)00067-4. doi: 10.1016/j.ccell.2025.02.015. Epub ahead of print. PMID: 40054467.


