陆军军医大学朱楚洪等AM:调控基质粘弹性生成人动脉样血管类器官
时间:2024-12-22 12:03:19 热度:37.1℃ 作者:网络
心肌梗死与血运重建
在非传染性疾病中,心血管疾病是全球发病率和死亡率的主要原因。其中,心肌梗死在病理学表现为长期缺血导致的心肌细胞死亡。在心脏缺血性损伤后,尽管通过内在的血管新生反应,能够在一定程度上进行自我修复,但该反应的速度和程度不足以防止心肌的广泛损伤。如果没有及时干预促进血运重建,心肌细胞在疾病进展中难以存活。
新生小鼠心脏损伤后,内皮细胞可以迁移并重新组装成侧支动脉,但这一过程在成年人中几乎不存在。内皮祖细胞(EPCs)移植到缺血心肌中会增加毛细血管密度,但由于缺乏壁细胞成分,仅靠EPC不足以提供动脉形成所需的复杂细胞组成。
血管类器官体外诱导为毛细血管网络
类器官(Organoid)通过模拟在体发育过程进行自组织,形成与对应器官相似的空间结构、细胞组成以及功能的迷你器官。Wimmer等人(Nature, 2019;Nat Protoc, 2019)首次通过对hPSC聚集的拟胚体诱导中胚层和血管分化,在离体水平产生了包含内皮细胞和周细胞的三维人体血管类器官(hBVO),随后将其包埋在I型胶原-Matrigel混合基质中,使得类器官自组织进行血管出芽,并形成毛细血管网络。Liu等人将人胚胎干细胞衍生的hBVO注射到心肌梗死小鼠模型的缺血区,显示出比单个早期血管细胞(EVC)更高的治疗潜力(Advanced Science, 2022)。但是,当前血管类器官仅为毛细血管,仍然面临缺乏血管平滑肌细胞(SMCs)与无法在体外诱导动脉分化的挑战。
调控基质粘弹性生成人动脉样血管类器官
近期,陆军军医大学朱楚洪教授和华南理工大学边黎明教授的研究团队提出了一种通过调节基质粘弹性将hPSCs衍生的hBVO诱导为人动脉样结构的策略。该研究通过免疫荧光染色及三维重建、单细胞测分析等方法,揭示了动态水凝胶可诱导hBVO血管出芽,形成具有SMC和更大管腔的动脉样结构。体内移植后,hBVO和动态水凝胶的组合有效地促进了梗死心脏的动脉重组,修复了心脏功能。相关工作以“Matrix Viscoelasticity Controls Differentiation of Human Blood Vessel Organoids into Arterioles and Promotes Neovascularization in Myocardial Infarction”为题发表在Advanced Materials。该研究第一作者为陆军军医大学讲师孙大雨、博士生杨冠渊、硕士生郑飞洋以及华南理工大学张琨雨副教授。

【文章要点】
该研究合成了明胶-β-环糊精(GelCD)作为动态水凝胶,并选择相似硬度的甲基丙烯酰明胶(GelMA)作为非动态水凝胶。在血管类器官培养的第6-11天,将其分别包埋在动态水凝胶和非动态水凝胶中进行血管出芽。发现动态水凝胶会促进hBVO血管出芽形成复杂血管网络,且具有更大的管腔直径(图1)。进一步,通过免疫荧光染色,发现动态水凝胶中hBVO具有更高的血管生成水平,且三维重建可见相邻hBVO的血管吻合(图2)。
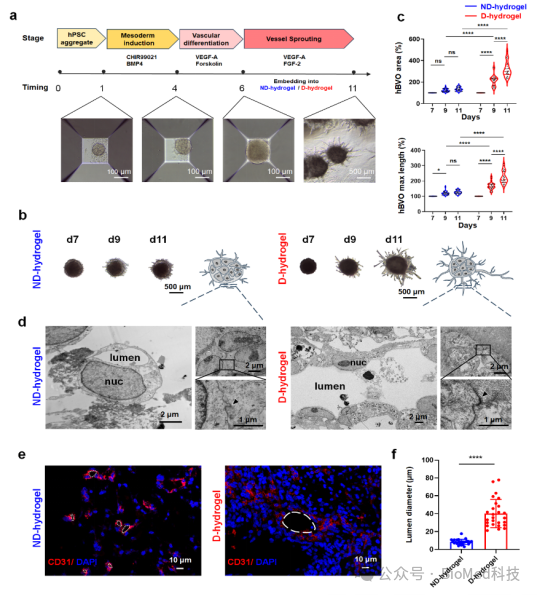
图1 hBVO在动态和非动态水凝胶中的形态学结构及管腔大小
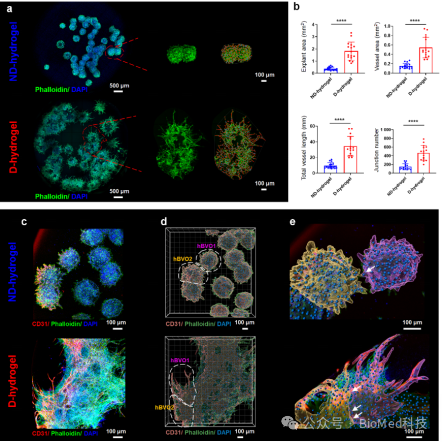
图2动态和非动态水凝胶中hBVOs中的血管生成水平及三维重建
采用单细胞RNA测序(scRNA-seq)分析了动态和非动态水凝胶内hBVO的细胞组成,发现具有相同的内皮细胞、间充质细胞和过渡态细胞。但是在两种水凝胶中壁细胞出现分化差异,非动态水凝胶中分化出独特的周细胞,而动态水凝胶中分化出独特的平滑肌细胞(图3),提示非动态水凝胶体外诱导hBVO为毛细血管,而动态水凝胶可体外诱导其为动脉样结构。
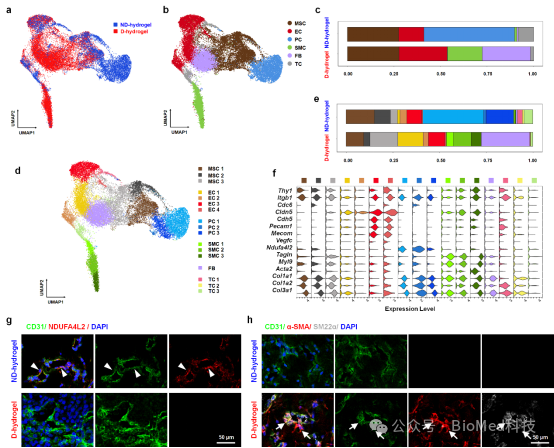
图3 单细胞RNA测序鉴定血管类器官在动态或非动态水凝胶中的不同细胞组成
将hBVO联合动态或非动态水凝胶移植至SD大鼠心梗模型的心脏缺血区域,在体水平进一步验证其治疗效果(图4)。
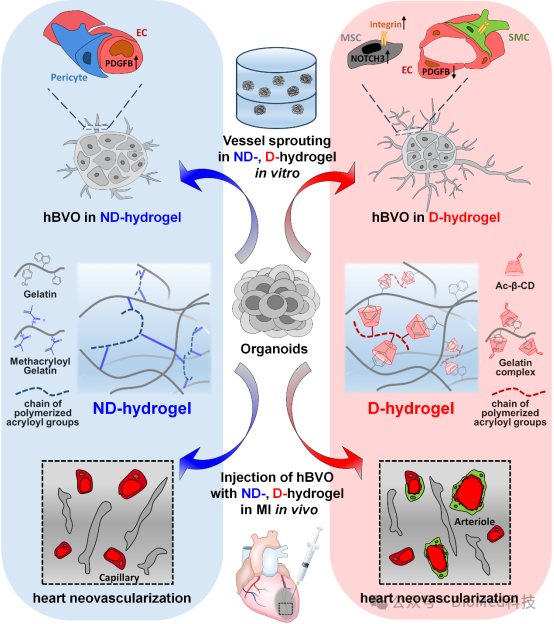
图4 研究相关模式图
【文章要点】
在这项研究中,作者首次报道了一种使用hPSC与合成动态水凝胶快速体外生成人动脉样结构的组织工程策略。本研究探索了基质粘弹性对血管类器官发育过程中自组织和多能分化的影响,强调了将基质粘弹性整合到生物材料设计中的重要性,以创建用于组织工程的复杂血管网络。动脉的形成对于有效将hBVO整合到更大组织结构中十分重要,并为再生医学转化应用提供了新思路。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202410802


