Theranostics 山东大学齐鲁医院王东海教授团队揭示内皮间质转化促进颈动脉粥样硬化进展新机制
时间:2024-12-21 06:00:46 热度:37.1℃ 作者:网络
全球疾病负担研究(global burden of disease study, GBD; https://ghdx.healthdata.org)数据显示,脑卒中是我国成人致死、致残的首位病因。中国是最大的发展中国家,人口约占世界总人口的五分之一,卒中患者人数高居世界首位。颈动脉粥样硬化的进展已被证实与脑卒中、短暂性脑缺血发作等脑血管缺血性事件的发生密切相关。近期研究表明,近四分之一的中国成年人存在颈动脉内中膜厚度增加或颈动脉斑块,40-54岁健康人群约1/3可见血管粥样硬化性改变,对个人、家庭和国家健康卫生体系造成巨大负担。因此,进一步研究颈动脉粥样硬化的发病机制,寻找新的分子诊疗靶点具有重要的现实意义和理论价值。
近日,山东大学齐鲁医院神经外科王东海教授团队在生物医学1区杂志Theranostics上发表题为“PIM1 instigates endothelial-to-mesenchymal transition to aggravate atherosclerosis”的研究论文,首次证实了PIM1诱导内皮间质转化(Endothelial to mesenchymal transition, EndMT)促进颈动脉粥样硬化斑块进展的新机制。

颈动脉粥样硬化斑块的发生发展是多种细胞共同相互作用的结果,而内皮细胞损伤和功能失调则是动脉粥样硬化斑块发生的始动环节。内皮损伤刺激因素可导致颈动脉、主动脉和冠状动脉内皮细胞向平滑肌样间充质细胞转化(α-SMA、Snail、Slug表达增高),即EndMT。发生EndMT的内皮细胞丧失内皮特性(VE-cadherin、CD31表达减少),失去内皮细胞的屏障作用,并伴随内皮细胞炎症反应和功能受损。EndMT会使得内皮细胞迁移能力增强并释放促炎趋化因子,导致斑块内新生血管和巨噬细胞浸润,进而加速动脉粥样硬化斑块不稳定破裂。
首先,研究者通过分析公共数据库中小鼠动脉粥样硬化斑块的单细胞数据(GSE155513),将第26周斑块中内皮细胞的转录组数据与第0周的正常血管内皮细胞转录组数据进行差异分析,将上调的基因与内皮间质转化中上调的基因取交集后,共得到了13个共同的差异基因,进一步选择了PIM1进行深入研究。从齐鲁医院神经外科王东海教授团队前期建立的人颈动脉粥样硬化斑块标本库中随机选择稳定斑块和不稳定斑块各10例进行免疫组化和免疫荧光染色发现, PIM1在不稳定斑块中表达量升高,并且主要集中表达在血管内皮细胞,以及围绕在血管内皮细胞周围的巨噬细胞中,且在不稳定斑块中新生血管处尤为显著。但PIM1在这过程发挥作用的分子机制尚不明确。
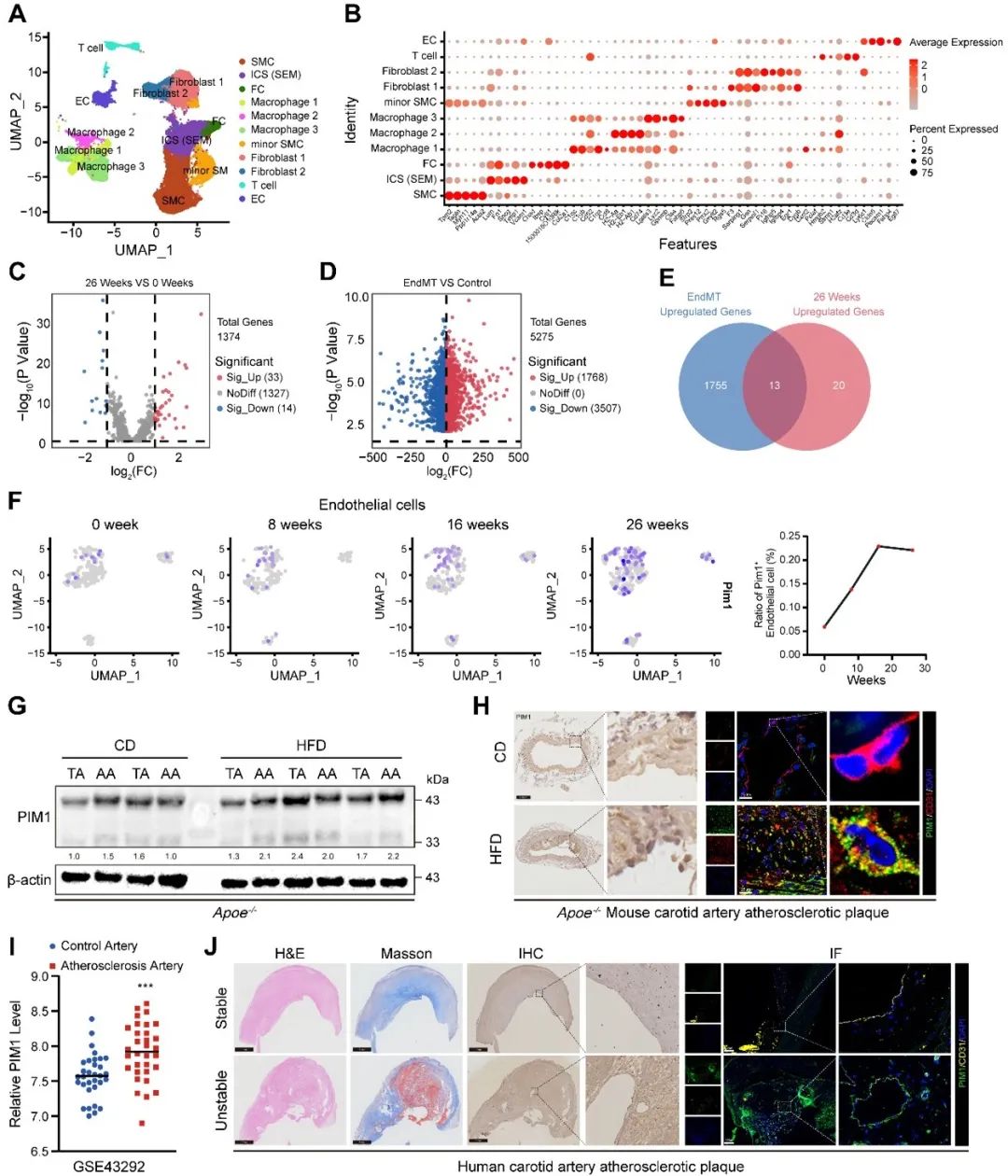
研究者进一步探讨了PIM1发挥抑制内皮间质转化及减缓动脉粥样硬化进展的机制。将PIM1-免疫共沉淀后的蛋白质谱数据与前期研究中敲减PIM1后的磷酸化蛋白修饰组学结果取交集发现,NDRG1是PIM1的下游磷酸化底物。研究者进一步通过分子对接探讨了PIM1和NDRG1的结合位点,并通过Co-IP进行了验证。令人惊奇的是,NDRG1在Ser330位点发生磷酸化后,进入细胞核增加,即发生质-核转位,而敲减PIM1可以抑制这一过程。因此,合理推断PIM1导致的NDRG1 (Ser330)磷酸化及其亚细胞定位改变与内皮间质转化和动脉粥样硬化进展密切相关。
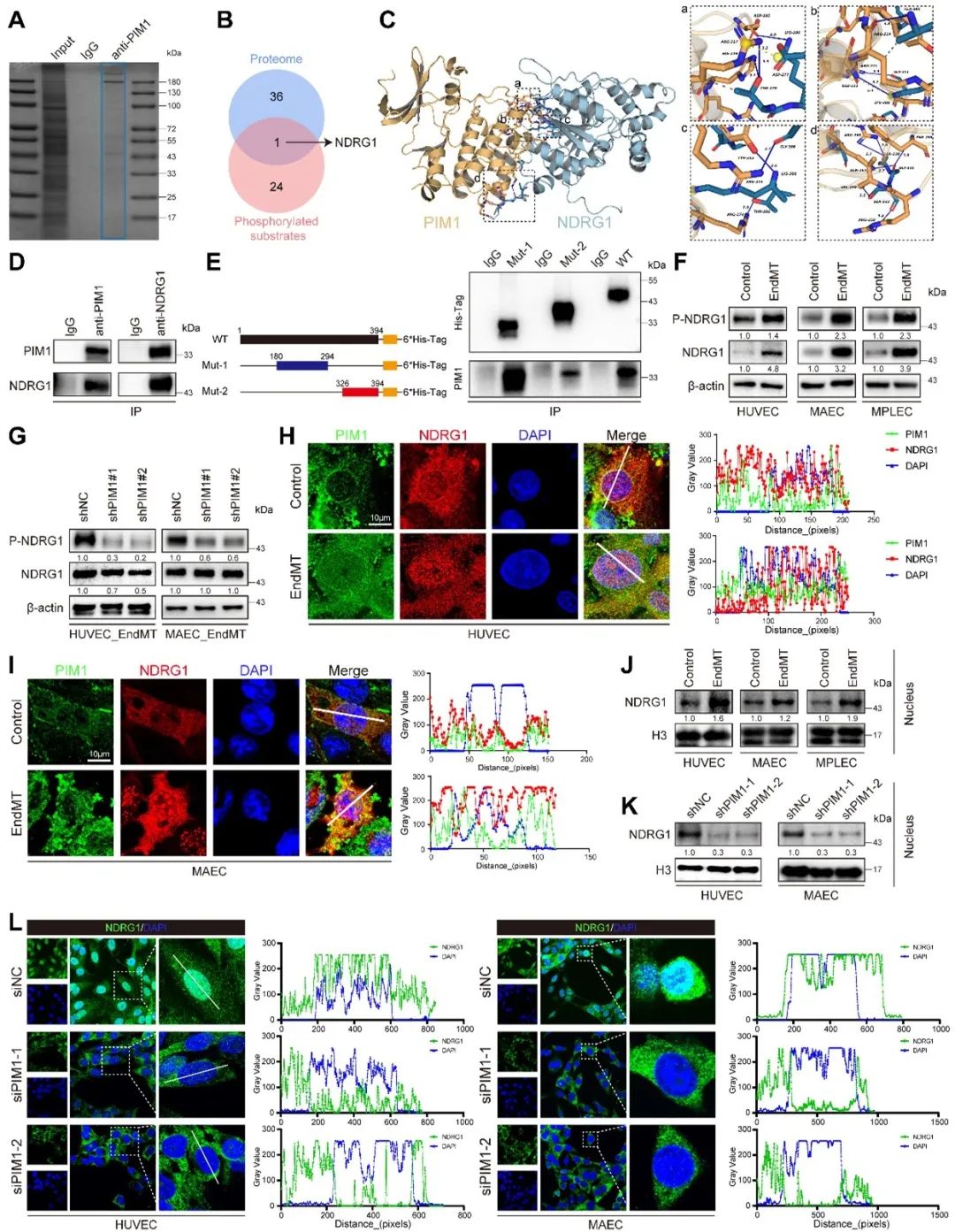
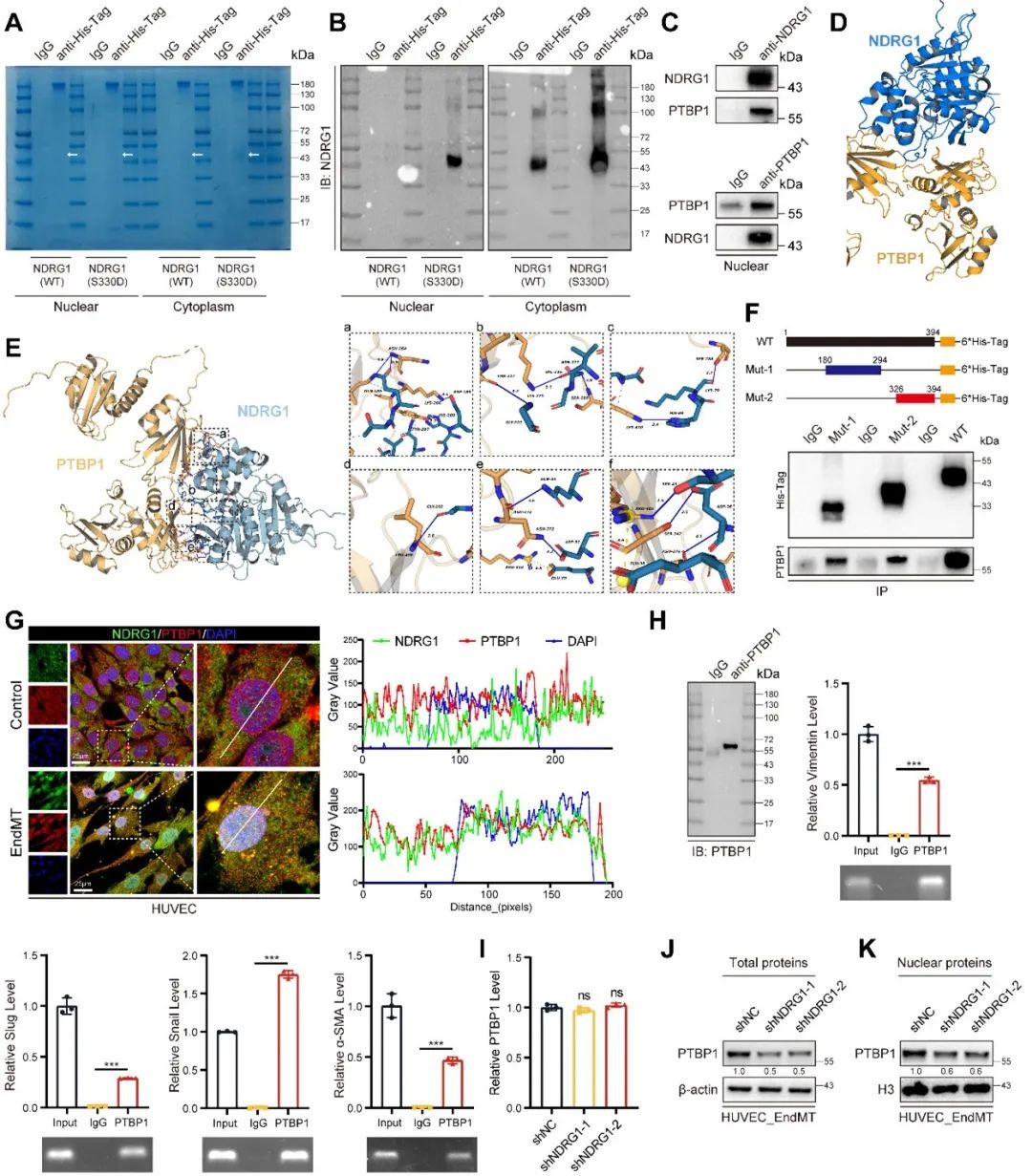
前期研究表明,NDRG1可以促进内皮细胞炎症,但是NDRG1进入细胞核内如何发挥促进EndMT的作用并不明确,因此,研究者进一步提取核蛋白后进行NDRG1的免疫沉淀,随后通过质谱鉴定了53个蛋白。NDRG1能够和PTBP1发生结合。肿瘤相关的研究表明,PTBP1能够促进上皮-间质转分化(EMT),且动脉粥样硬化的相关研究也表明,PTBP1可以通过促进内皮细胞炎症加速动脉粥样硬化的进展。PTBP1作为RNA结合蛋白主要发挥可变剪接以及稳定mRNA的作用。研究者随后进行了RNA结合蛋白免疫沉淀(RIP)实验,结果表明PTBP1可以与Vimentin、Slug、Snail、α-SMA、N-Cadherin、TAGLN和ZEB1 mRNA结合。进一步研究发现,敲低NDRG1会导致细胞内PTBP1蛋白水平的下降,尤其是在细胞核内,但并不影响PTBP1的mRNA水平。这提示NDRG1可能通过增强PTBP1的稳定性来保护其免于降解,有利于其发挥RNA结合作用,进而促进EndMT和动脉粥样硬化的进展。
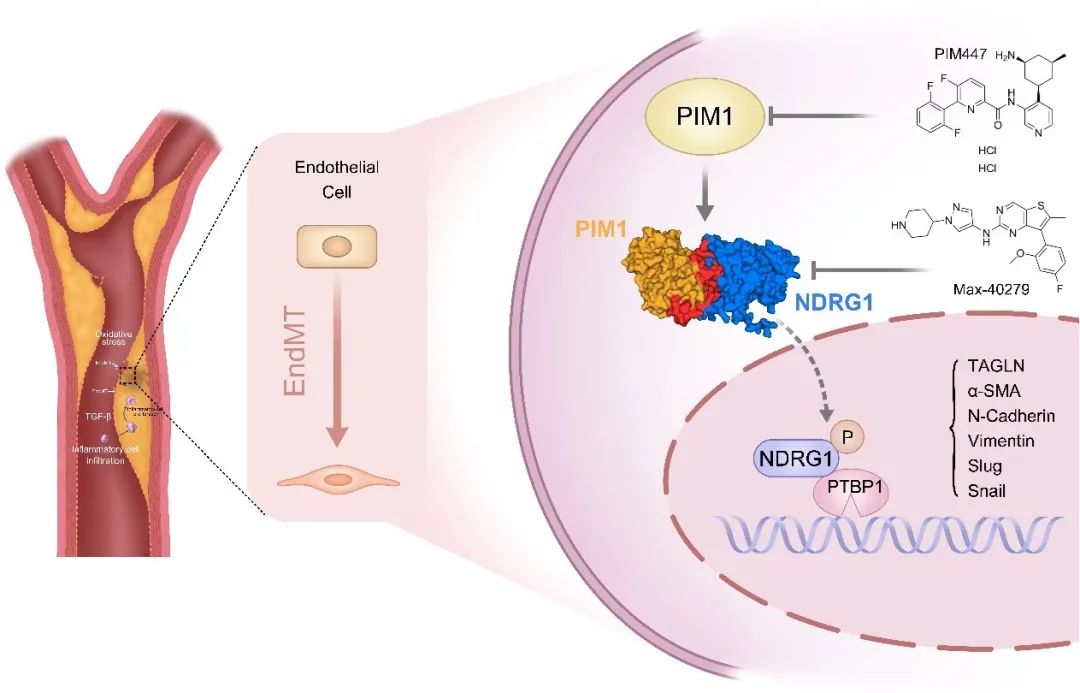
综上所述,在本研究中,研究人员通过对斑块单细胞测序数据的分析,鉴定出PIM1在晚期动脉粥样硬化斑块的内皮细胞中和发生EndMT的内皮细胞中高表达,抑制PIM1的表达可以显著抑制EndMT。分子机制方面,PIM1可以促进NDRG1在Ser330位点的磷酸化,NDRG1磷酸化后入核增加,进入细胞核后可以与PTBP1结合协作发挥RNA结合蛋白的作用,诱导内皮间质转化,进而促进动脉粥样硬化的进展。随后,研究团队通过分子对接筛选的方式挖掘了可以抑制NDRG1磷酸化并促进NDRG1降解的小分子药物Max-40279,其能有效抑制EndMT,有望成为治疗动脉粥样硬化的新的候选药物。
山东大学齐鲁医院神经外科王东海教授、黄斌副研究员、李新钢教授为文章的共同通讯作者,齐鲁医院神经外科博士研究生薛志伟、韩孟桃以及博士后孙滔为文章的共同第一作者。该研究获得了山东省自然科学基金项目(编号: ZR2023MH023, ZR2019ZD33)、泰山学者专项基金(tshw201502056)、济南微生态生物医学省实验室基金项目(SYS202202)、齐鲁医院临床实用新技术发展基金(grant 2019-7)以及横向基金(项目编号: 11691806和6010120062)的支持。
原文链接:
https://www.thno.org/v15p0745.htm


