【衡道丨干货】2024版CSCO神经内分泌肿瘤指南更新
时间:2024-12-15 06:00:47 热度:37.1℃ 作者:网络
神经内分泌肿瘤(Neuroendocrine neoplasms,NENs)是一类起源于肽能神经元和神经内分泌细胞,具有神经内分泌分化并表达神经内分泌标记物的少见肿瘤,可发生于全身各处,以肺及胃肠胰神经内分泌肿瘤(Gastroeneropancrealie neuroendocrine neoplasms,CEP-NENs)最常见。
神经内分泌肿瘤的病理诊断
胃肠胰肝胆神经内分泌肿瘤的命名及分级标准
胃肠胰肝胆神经内分泌肿瘤的分类及分级
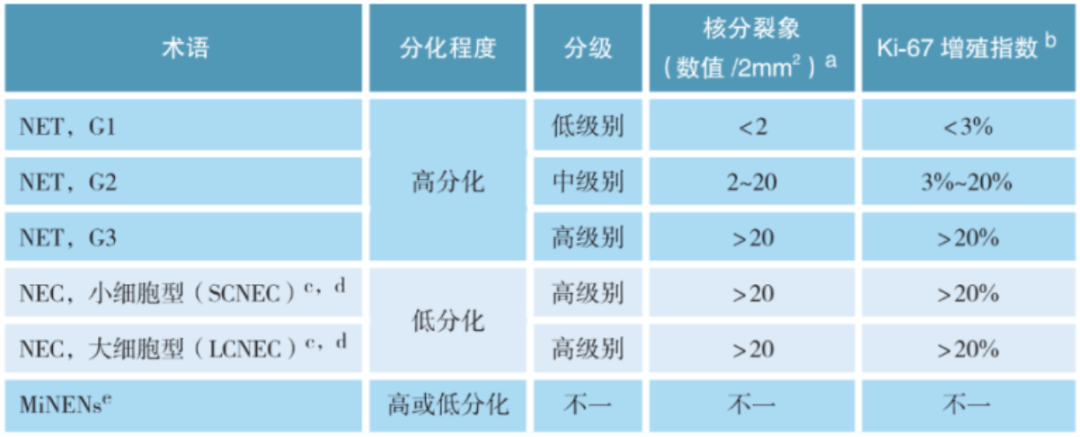
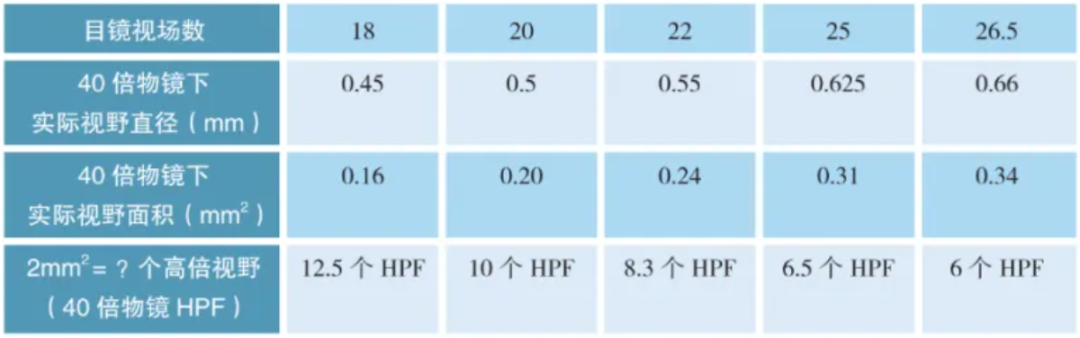
a.核分裂象计数要求:计数2mm2核分裂活跃区的核分裂数。一共计数5组,即总面积为10mm2,然后取平均值。2mm2等于多少个40倍物镜的高倍视野,需要根据个人显微镜的视场数和实际视野直径来换算。
实际视野直径=视场数÷物镜倍率
b.Ki-67增殖指数值:计数热点区域至少500个细胞来确定。当核分裂象计数分级结果与Ki-67分级结果不一致时,分级原则按级别最高者分级。
c.低分化NEC无须再分级,根据定义应被视为高级别,分为小细胞神经内分泌癌(small cell neuroendocrine carcinoma,SCNEC)和大细胞神经内分泌癌(large cell neuroendocrine carcinoma,LCNEC)。
d.NET G3与NEC的鉴别:
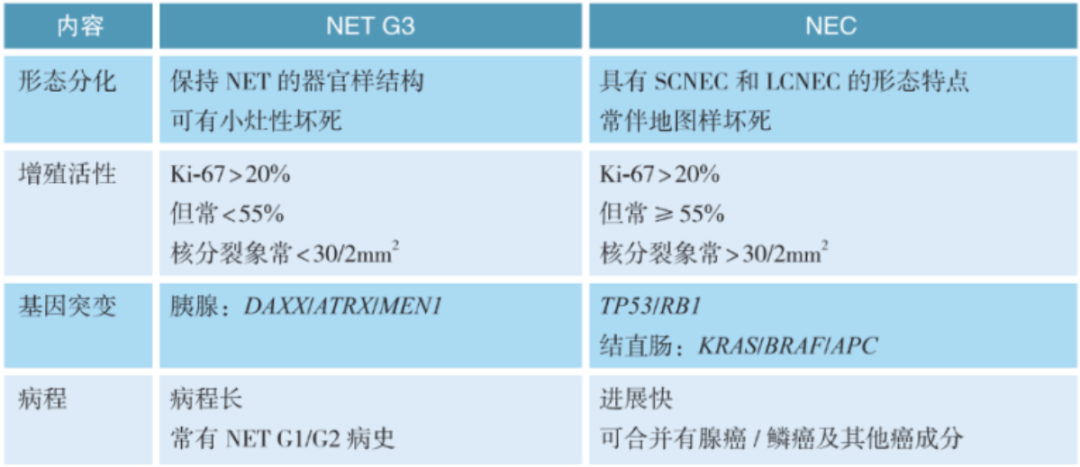
[注:MEN1基因在大约40%的胰腺神经内分泌瘤(pancreatic neuroendocrine tumors,pNETs)中是失活的,此外,约45%的pNETs显示DAXX或ATRX突变。这三个基因的异常是pNETs的分子特征,在蛋白水平上的异常则表现为DAXX/ATRXMEN1免疫组化染色阴性,即表达缺失。因此,DAXX、ATRX和MEN1的表达缺失对NETs和NEC的鉴别有意义。此外,DAXX和ATRX突变与端粒维持的端粒选择性延长(ALT)途径以及染色体不稳定性密切相关。DAXX和ATRX突变及ALT状态是pNETs患者预后不良的重要指标。因此,本指南建议pNETs常规做DAXX和ATRX免疫组化染色]
e.混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-non-neuroendocrine neoplasms,MiNENs)定义:由神经内分泌肿瘤和非神经内分泌肿瘤组成的混合性上皮性肿瘤,每种成分都是形态学和免疫组化可辨识的独立肿瘤,且每种成分占比≥30%。在大多数MiNENs中,两种肿瘤成分的分化都很差,多是器官特异性癌与NEC的混合。但少数情况下也会出现一种或两种成分可能为高分化。因此,每种成分都应单独分级。
以下两种情况不属于MiNENs:
①对于形态学不支持神经内分泌癌,但却表达神经内分泌标志物(Syn/CgA/INSM1)的器官特异性癌(例如腺癌、鳞癌等),应诊断为器官特异性癌(例如腺癌、鳞癌等),伴Syn/CgA/INSM1阳性或伴神经内分泌分化;
②肿瘤细胞同时具有神经内分泌和非神经内分泌标志物双重表达时,称为两性癌。两性癌是一种特殊实体,具有不同于在腺癌或神经内分泌两种肿瘤中观察到的生物学和组织学特征。
胃神经内分泌肿瘤的临床病理分型
胃NENs的命名及分级标准与肠道和胰腺一致,但胃NETs因其独特的生理病理、发病机制分为三个临床病理亚型。病理医生在诊断胃NETs时,不仅要根据Ki-67指数和核分裂象给出明确的病理分级(NET G1/G2/G2),同时还要描述肿瘤周围背景胃黏膜是否正常、是否有萎缩性胃炎或壁细胞增生,以及是否有神经内分泌细胞系列增生等改变,以辅助分型。
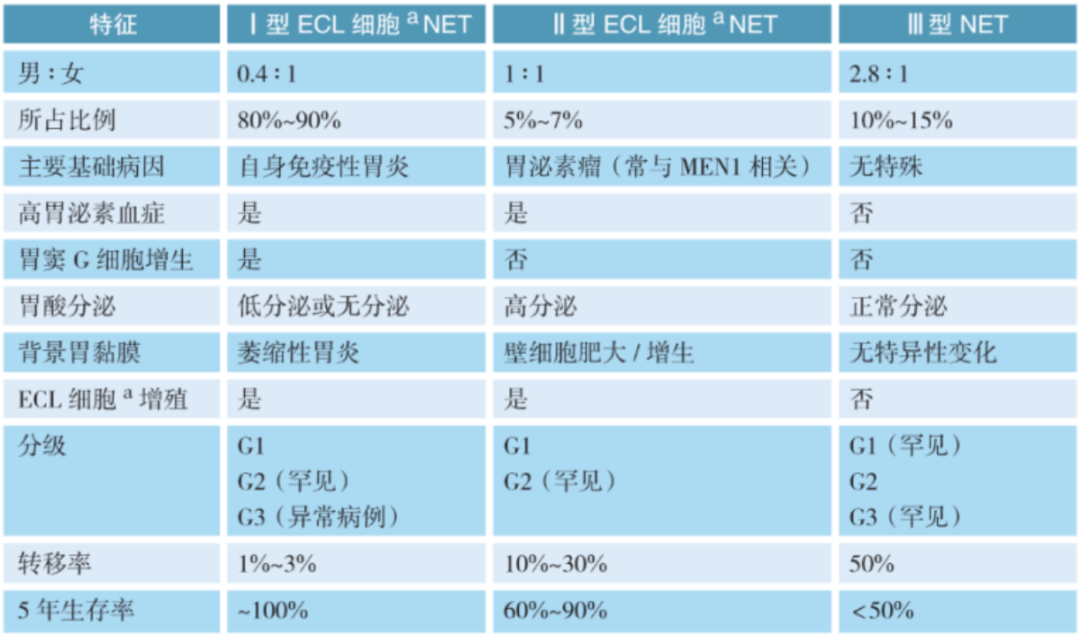
[ECL细胞:肠嗜铬样(enterochromaffin-like,ECL)细胞]
肺和纵隔(胸腺)神经内分泌肿瘤的命名及分级标准
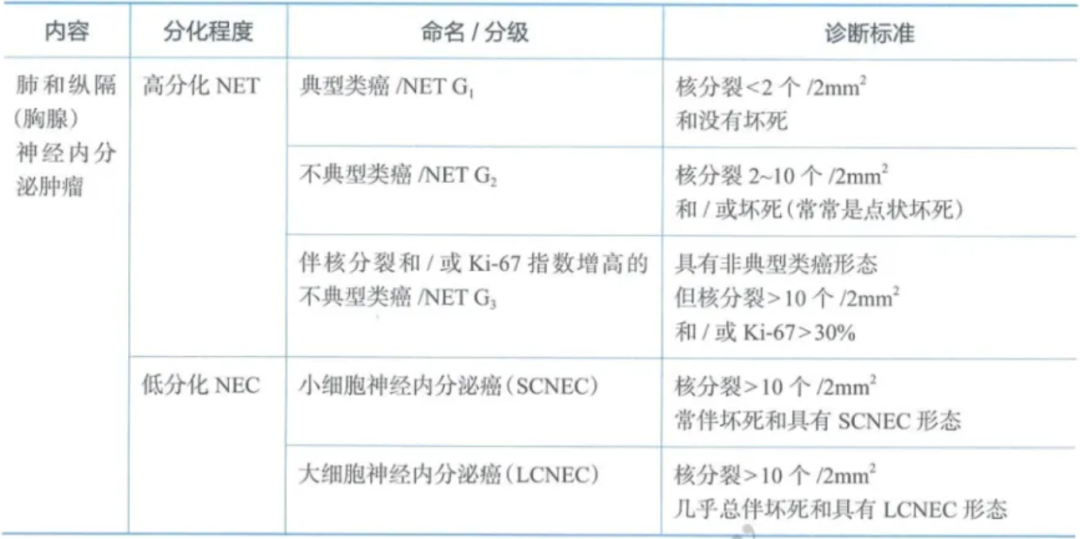
肺和胸腺/纵隔神经内分泌肿瘤诊断注意事项:
a.活检标本组织太少(达不到2mm2)或组织挤压严重或坏死较明显时,难以通过精确的核分裂计数来准确分级。活检标本诊断类癌时,不建议明确区分TC和AC;活检标本中LCNEC和SCC可能受组织挤压或广泛坏死影响难以鉴别时,可诊断为高级别神经内分泌癌,非特指型(not otherwise specified,NOS)。
b.Ki-67指数在肺及胸腺NENs中虽然不作为分级指标,但在活检小标本中,对低中级别类癌与高级别神经内分泌癌鉴别具有可靠价值。Ki-67指数在TC中<5%,AC<30%,而在高级别神经内分泌癌中>30%。
c.具有不典型类癌形态学特点,但核分裂指数>10/2mm2和/或Ki-67>30%NENs,2022年世界卫生组织(WHO)更名为伴有丝分裂计数和/或Ki-67增殖指数升高的不典型类癌/NETs(相当于胃肠胰的NET G3),以便于临床个性化管理。
其他脏器原发神经内分泌肿瘤及来源不明的神经内分泌肿瘤的分类
其他脏器原发NENs仍参见各器官WHO分类标准。来源不明的NENs的分类,可以具体写明肿瘤分化程度、坏死、核分裂象计数及Ki-67指数,分级方案可以备注参考胃肠胰NENs或肺NENs标准。
副神经节瘤/嗜铬细胞瘤病理诊断
副神经节瘤/嗜铬细胞瘤的命名
副神经节系统分为肾上腺髓质副神经节和肾上腺外副神经节两部分。它们发生的肿瘤统称为副神经节瘤。副神经节瘤为神经型神经内分泌肿瘤,它们代表了一组具有极高(约40%)遗传易感性的NENs。副神经节瘤又可进一步分为交感神经副神经节瘤和副交感神经副神经节瘤。发生于肾上腺内的副神经节瘤沿袭传统仍命名为嗜铬细胞瘤,嗜铬细胞瘤属于交感神经副神经节瘤。此外,还有腹腔交感神经副神经节瘤和头颈部交感神经副神经节瘤。副交感神经副神经节瘤主要位于头颈部,根据其起源的解剖部位命名,包括颈动脉体瘤、颈鼓室副神经节瘤、迷走神经副神经节瘤和喉副神经节瘤。
2022年第5版WHO将“马尾副神经节瘤”更名为马尾神经内分泌瘤;将好发于十二指肠的“神经节细胞副神经节瘤”更名为复合神经节细胞瘤/神经瘤和神经内分泌瘤(composite gangliocytoma/neuroma and neuroendocrine tumor,CoGNET)。上述两个肿瘤属于上皮性神经内分泌瘤,不再属于副神经节瘤。
病理形态学
副神经节瘤/嗜铬细胞瘤特征性形态是肿瘤细胞排列呈器官样,即界限清楚的细胞球(Zellballen)。细胞球可大可小,被血管丰富的纤维间隔分开。其他少见的结构包括弥漫性生长、小梁状排列或明显硬化。肿瘤细胞的大小和形状差异很大,具有细颗粒状嗜碱性或嗜双色性胞质,核通常圆形或卵圆形,伴较明显的核仁。
免疫组化染色
神经内分泌标志物INSM1、嗜铬粒蛋白A(CgA)、突触素(Syn)和CD56在副神经节瘤/嗜铬细胞瘤中几乎总是阳性,SSTR2A也阳性。头颈部副交感神经副神经节瘤CgA有时可呈阴性,或仅以核周点状的方式局部阳性。肿瘤细胞球周围的支持细胞呈SOX10和S-100蛋白阳性,但阳性数量不等,侵袭性或转移性肿瘤常显著减少或缺失。细胞角蛋白(CAM5.2和AEl/AE3)通常阴性,偶可局灶阳性。副神经节瘤/嗜铬细胞瘤除了表达转录因子GATA3,还表达儿茶酚胺合成酶,如酪氨酸羟化酶(TH)、多巴胺β-羟化酶(DHB)和苯乙醇胺N-甲基转移酶(PNMT),这些是确认其分化和功能状态的重要标记。头颈部一些副交感神经副神经节瘤表达胆碱乙酰转移酶(ChAT)。SDHB表达缺失是预测副神经节瘤/嗜铬细胞瘤高转移性风险的独立预后指标。Ki-67指数增高与预后相关。
病理分级和转移风险评估
任何副神经节瘤/嗜铬细胞瘤都有转移的潜能,并且没有明确的特征可以预测转移行为。目前文献有PASS、GAPP和COPPS三个病理分级和转移风险评分系统,2022年第5版WHO并不认可这些评分系统,但也不反对使用。
转移的识别也很困难,特别是在有胚系遗传性综合征的患者,多个部位病变可能代表多灶性原发肿瘤,而不是转移扩散;发生于肺、心脏、肝脏等不寻常部位的副神经节瘤多为转移性,罕见原发。正常淋巴结或骨没有副神经节细胞,其内一旦出现副神经节瘤成分视为转移。
肿瘤预后不良因素
预后与遗传谱密切相关,SDHB突变和MAX突变的副神经节瘤具有更高的转移潜能。其他可能与转移潜能相关的因素包括肿瘤体积(较大直径>5cm),初始诊断时患者年龄较大及去甲肾上腺素能生化表型。病理形态学包括肿瘤细胞球增大或不规则(相差10倍以上),细胞密度增加,出现假菊形团或粉刺样坏死,有血管或包膜侵犯,Ki-67指数增高(>3%)和SDHB免疫组化表达缺失、S-100支持细胞消失等。如出现上述预后不良因素,本指南建议在病理诊断报告中备注。
中国肿瘤整合诊治指南(CACA)神经内分泌肿瘤
NENs的病理报告应当详细包含以下内容:
标本类型、肿瘤部位、肿瘤大小和数目、肿瘤浸润深度和范围、脉管和神经累及情况、核分裂象计数[个/2mm2]和(或)Ki-67指数(热点区)、神经内分泌标志物(包括Syn、CgA和INSM1)以及其他标志物情况、切缘情况、淋巴结转移及远处转移情况、肿瘤类型和分级。对于混合性肿瘤,必须明确指出肿瘤的类型以及各种组成成分的占比,以及淋巴结或远处转移的成分。
NENs均具有复发转移的潜能,不同部位(空间)和不同时间点的病灶在病理分化、分级或分子改变方面可能表现不同,最常见的情况是低级别的NENs转变为高级别的NENs。鉴于同一患者在不同时间的复发/转移病灶可能表现出肿瘤进化的现象,建议根据临床需求,对有转移的患者多时多部位进行取材并送病理检查,以明确肿瘤的异质性和进展情况,从而指导治疗方案的调整。
病理分类与分级
NENS在人体各部位均可发生,分类和分级标准会因解剖部位的不同而有所差异。为统一评估标准,2022年世界卫生组织(WHO)发布了上皮型NENs的统一分类分级标准。该标准总体上把神经内分泌肿瘤分为分化好的神经内分泌瘤(NET)与分化差的神经内分泌癌(NEC),而分化好的神经内分泌瘤则根据核分裂象和Ki-67指数分为G1、G2和G3三个不同的级别。该标准特别关注与肿瘤增殖活性相关的三个指标:核分裂象、Ki-67指数和肿瘤性坏死(表25-3-1)。
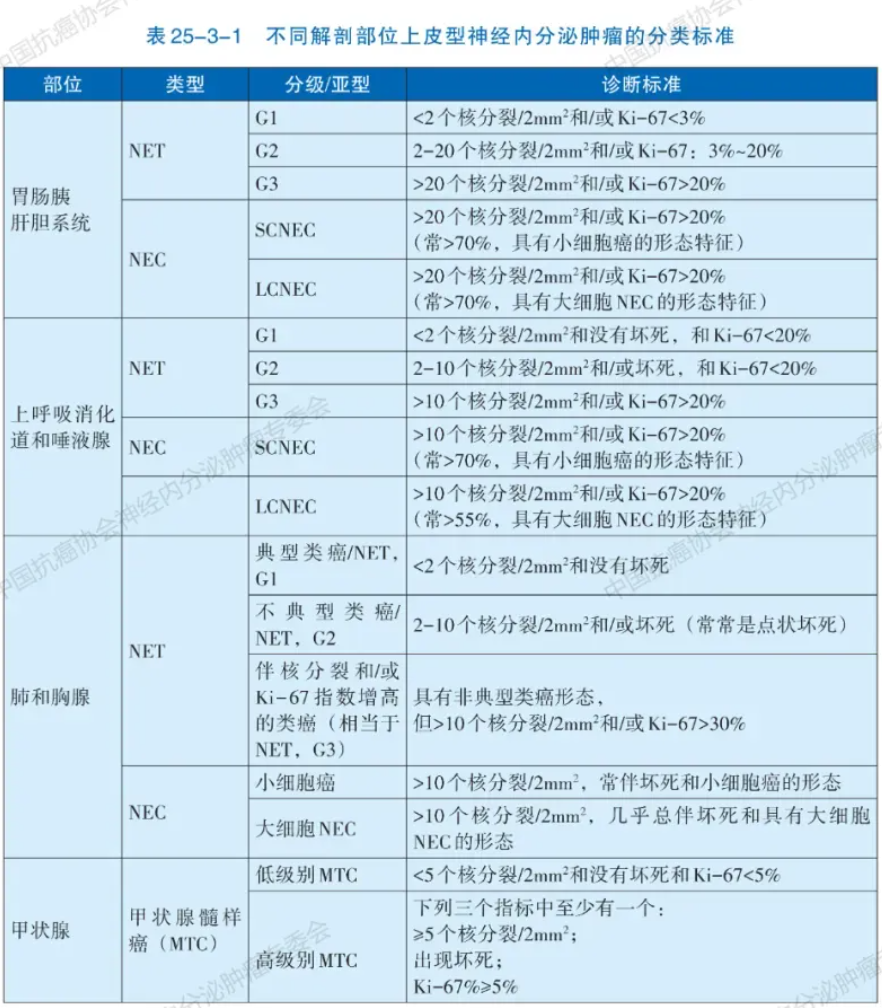
注:NET为神经内分泌瘤;NEC为神经内分泌癌。乳腺NET目前无统一的分级标准,可参见导管癌的诺丁汉标准,其他部位(女性生殖、泌尿系统和男性生殖等)可参考胃肠胰NENs分类分级标准
区分高分化神经内分泌瘤(NET)和低分化神经内分泌癌(NEC)的诊断需从细胞形态、组织结构和免疫组化三方面综合考量。病理形态特征是诊断NENs的关键,高分化的NET常具有特征性“胡椒盐”样染色质和器官样结构,低分化NEC常见为均一的少胞浆(小细胞癌)或显著胞浆(大细胞NEC)。NENs的免疫组化检测也同样重要,要求在形态学基础上利用免疫组化染色确认肿瘤具有神经内分泌分化。推荐应用包括突触素(Synaptophysin,Syn)、嗜铬粒蛋白A(Chromogram A,CgA)和胰岛素瘤相关蛋白1(Insulinoma-associated protein 1,INSM1)在内的多个抗体染色以明确。同时,还需明确NENs表达上皮标记(如CK、CK8/18等)。肿瘤分级依赖于核分裂和Ki-67(MIB-1 clone)指数,推荐在所有NENs进行Ki-67检测。部位特异性转录因子的检测可协助寻找NET转移灶的原发部位(表25-3-2),而NEC则无法通过标记物染色明确组织起源。对F-NENs,推荐特定激素(如胰岛素、生长抑素、胰高血糖素、胃泌素、促肾上腺皮质激素等)免疫组化检测。预后预测和治疗相关标志物检测大多用于NET(表25-3-3)。
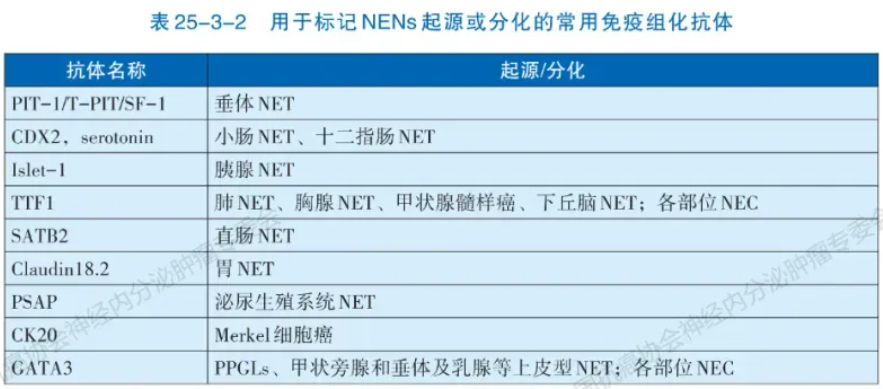
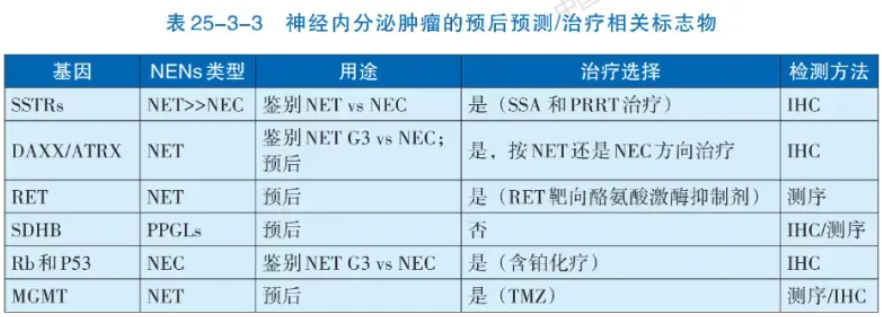
注:SSTRs:生长抑素受体;SSA:生长抑素类似物;PRRT:肽受体放射性核素治疗;IHC:免疫组织化学;TMZ:替莫唑胺;PPGLs:副神经节瘤/嗜铬细胞瘤;MGMT:06-甲基鸟嘌呤-DNA甲基转移酶
对胃NET不仅需要分级,还要提供背景胃黏膜病理信息协助临床分型。胃NET基于临床、实验室检测和病理检测,分为1型、2型和3型。各型NET在肿瘤细胞形态上是相似的,但背景胃黏膜存在差异,这有助胃NET的分型。因此,在进行胃镜活检时,对胃NET患者(特别是临床怀疑为1型或2型)的取材建议是:病变区至少在2个部位各取材2块(推荐采用挖掘式深取材),非病变区的胃体、胃底和胃窦各取2块标本,以全面评估胃黏膜背景病理情况。
混合性神经内分泌-非神经内分泌肿瘤(Mixed neuroendocrine non-neuroendoerine neoplasm,MiNEN)是一种同时含有神经内分泌和非神经内分泌成分的混合型上皮肿瘤,在组织学和免疫组化上两种成分独立,且每种成分至少占30%。这类肿瘤常出现在NENs的好发部位,特别是消化系统。MiNEN的两类成分起源于同一类原始上皮细胞,诊断时需鉴别类似肿瘤,如含有小灶(<30%)的NEN、双向分化的混合性腺癌-神经内分泌癌(两性癌)和碰撞瘤等。MiNEN的治疗选择依赖于详尽的病理信息,包括两类肿瘤的类型、占比、分级和转移灶(含阳性淋巴结)的肿瘤类型。
肺和胸腺NENs的病理诊断
肺(支气管)及胸腺NENs是一个独特的肿瘤亚群,2022(第五版)WHO NENs统一分类框架中虽然将肺(支气管)及胸腺NENs根据核分裂象、Ki-67指数和肿瘤性坏死分为分化好的NET(G1/G2/G3)和分化差的NEC(小细胞癌和大细胞神经内分泌癌),但在其中依然保留了2021(第五版)WHO胸部肿瘤对肺(支气管)及胸腺NENs的命名,包括典型类癌(Typical careinoid,TC)(相当于NET G1)、不典型类癌(Atypical carcinoid,AC)(相当于NET G2)。2021(第五版)WHO胸部肿瘤提出存在一类灰区NENs,其组织学形态类似于不典型类癌,但核分裂数(10/2mm2)和/或Ki-67指数>30%,且分子遗传学更接近于类癌,而不同于大细胞神经内分泌癌/小细胞癌(TP53、RB1共突变)。该类肿瘤在胸腺和肺部均可发生,但其在胸腺更为常见。肺部病例常出现在转移灶,而肺原发灶极为罕见。2022版(第五版)WHO NENs也保留了这类NENs,称为“伴核分裂和/或Ki-67指数增高的类癌”,相当于NET G3.
对于肺(支气管)及胸腺NENs,Ki-67有助于鉴别低级别NET和高级别NEC,尤其是活检小标本。但Ki-67在TC和AC的分类诊断中的作用有限,主要诊断标准还是以2mm2中肿瘤的核分裂象数及是否有坏死灶存在来界定。在非完整切除标本,如穿刺标本(包括转移灶的活检标本),因观察局限,推荐诊断为类癌,非特指(not otherwise specifed,NOS),而不是直接诊断为TC或AC,同时写明核分裂象数(个/2mm2),有无坏死(灶性或广泛),以及Ki-67指数。活检标本中LCNEC和SCEC可能受组织挤压或广泛坏死影响难以鉴别时,可诊断为高级别NEC,NOS。
肺(支气管)及胸腺NENs的神经内分泌标记物包括Syn、CgA和CD56以及INSM1。只有当组织学提示有NENs形态特征时才使用上述标记物进一步证实。TTF-1在肺的NENs常阳性,但在胸腺NENs常阴性。约90%肺小细胞癌表达TTF-1,但TTF-1不能区分肺或肺外小细胞癌。CD56在其他部位是最不特异的神经内分泌标记物,但它是肺小细胞癌中最敏感的神经内分泌标记物。高级别神经内分泌癌(特别是小细胞癌)Rb1免疫组化核表达缺失,p53免疫组化呈表达缺失或弥漫强阳性。近年来小细胞癌分子分型的研究表明,对神经内分泌标志物低表达的小细胞癌,可使用POU2F3辅助诊断。LCNEC或小细胞癌可与任何比例的非神经内分泌癌成分(如癌、鳞癌等)混合(命名为复合性LCNEC或复合性小细胞癌)。诊断时需注明混合癌的类型、占比和分化程度。
PPGLs的病理诊断
PPGLs起源于肽能神经元,被归类为非上皮性NENs(也称为神经型NENs),现统一命名为副神经节瘤(Paragangliomas,PGLs),其中肾上腺嗜铬细胞瘤为原发于肾上腺髓质的PGLs。PGLs有极高的遗传易感性。病理诊断PGLs除了表达神经内分泌标志物如INSM1、Syn和CgA外,通常不表达上皮标记(比如角蛋白),但表达一些高度特异性标志物,如GATA3转录因子和酪氨酸羟化酶等。此外,PGLs内存在表达SOX10和S100阳性的支持细胞网络,但这一特点不再用于鉴别诊断,因为其他上皮性NENs也可能含有支持细胞。由于任何PGLs都有可能发生转移,因此不再将其划为良性或恶性。目前尚无确切临床病理特征能预测PCLs转移的发生。推荐使用Ki67标记检测协助PGLs的预后预测。同时,建议对所有PGLs进行SDHB蛋白的免疫组化检测。如发现细胞质染色缺失,可诊断为“SDHx缺陷的PGLs”,这类PGLs可能存在SDHx基因的胚系、体细胞或表观遗传改变。通过分子基因学检测,可明确与遗传易感性综合征相关的PCLs。
特殊部位神经内分泌肿瘤
垂体神经内分泌肿瘤(PitNET)曾被称为垂体腺瘤。根据新的WHO分类,PitNETs现在根据瘤细胞谱系、细胞类型和相关特征进行组织学亚型分型。为了精确地分型,需行包括垂体转录因子(PIT1、TPIT、SF1、GATA3和ERα)的免疫组化检测。PIT1、TPTT和SF1是PitNETs的主要亚型,具有独特的形态学、分子学和临床特征。部分PitNETs,特别是促性腺激素型PitNETs,可能会表达GATA3同时缺乏上皮标记的表达,故易与PGLs混淆。然而,任何垂体转录因子如PIT1、TPIT和SF1的表达都可明确NENs的腺垂体细胞来源,从而有助鉴别诊断PitNETs与其他NET和PGLs。在一些PitNETs中,可能出现p53异常表达。为避免将其与NEC混淆,建议用“转移性PitNETs”这个术语取代之前所称的“垂体癌”
Merkel细胞癌(MCC)是一种原发于皮肤的神经内分泌癌,与紫外线的暴露和Merkel细胞多瘤病毒(MCPyV)的感染有关。病理学上,MCC具独特临床病理特征,治疗方式与其他NEC存在差异,因此诊断时需将其与其他部位大细胞型和小细胞型NEC区分开来。形态学上,MCC主要由中等大小细胞组成,胞质稀少,核圆形或卵圆形,染色质呈细颗粒状。MCC肿瘤细胞同时表达上皮和神经内分泌标志物。CK20抗体在MCC中的核周点状染色是其特有表现,也是确诊MCC的有效手段。此外,针对MCPyV的免疫组化检测(CM2B4抗体)或分子检测,对MCC的确诊、与其他类型NEC的鉴别以及预后评估都十分有帮助。
参考文献及书籍:
1.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)神经内分泌肿瘤诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.
2.《中国肿瘤整合诊治指南(CACA)神经内分泌肿瘤(2025)》


