Leukemia:儿童癌症循环肿瘤DNA的基因组分析新工具
时间:2024-12-13 16:00:30 热度:37.1℃ 作者:网络
“液体活检”指对来自外周血的无细胞DNA(cfDNA)进行测序分析,具有用于检测癌症和监测治疗反应的非侵入性方法的应用前景。肿瘤衍生的cfDNA,称为循环肿瘤DNA(ctDNA),已在成人多个恶性肿瘤中进行了广泛研究,但儿科癌症中ctDNA检测主要针对实体瘤进行,对脑肿瘤和血液恶性肿瘤的研究报道有限。ctDNA分析的效用尚未被很好地建立用于儿童癌症(尤其是白血病)的疾病检测和监测。
目前,越来越多儿童癌症的特异性拷贝数变异和基因融合等被用于儿童癌症的分子分型并提供预后预测。此外,儿童癌症的基因组异质性特点,以及许多肿瘤类型中复发性致癌驱动因素的低患病率,因此,亟待开发针对儿童恶性肿瘤的诊断方法和预后监测工具。
近日,来自美国圣裘德儿童研究医院的 Charles G. Mullighan 和 Ruth G. Tatevossian 团队在 Leukemia 发表题为 Genomic profiling of circulating tumor DNA for childhood cancers的文章。研究者通过深度测序(PeCan-Seq)开发了儿科癌症基因组分析的新技术,一种针对儿童癌症无细胞样本中不同体细胞基因组变异的深度测序方法,通过比较血浆cfDNA中检测到的基因组变异与来自233名癌症儿童的相应诊断肿瘤样本的DNA,以研究这种方法用于诊断和监测肿瘤治疗反应的潜在效用。结果显示PeCan-Seq能够灵敏地从1 ml血浆中识别出儿童血液恶性肿瘤和一部分实体瘤的异质性ctDNA改变,同时血浆ctDNA基因组图谱与匹配的诊断肿瘤样本显示出强烈的一致性,显示出Pecan-Seq在监测儿科癌症治疗反应方面的巨大潜力。

研究人员从2017年3月至2022年5月期间在圣裘德儿童研究医院接受血浆治疗的儿科癌症患者中选取233位患者纳入研究队列,并在开始治疗前采集了他们的肿瘤活检样本,其中177位患有血液瘤,38位患有实体瘤,18位患者患有脑瘤。
同时,研究人员对228名患者的肿瘤样本进行了临床WGS和/或WES测序。每个肿瘤全基因组的中位测序深度为68倍单倍体覆盖率,每个肿瘤外显子组的中位测序深度为337倍。
首先研究者对所有患者的cfDNA样品进行了靶向富集的PeCan-Seq,使用Illumina NovaSeq 6000系统对样品捕获的文库进行150 bp的双端测序,测序深度为每个诊断样品2.5亿个读数或每个监测样品10亿个读数。并将血浆cfDNA测序数据与正常WGS和/或WES配对,与相应的诊断肿瘤样本的基因组变异进行比较,以调查该方法在诊断和监测疾病反应中的潜在应用。
对于不同类型的变异事件,使用Mutect2和LoFreq软件检测体细胞的单核苷酸变异(SNV)和小插入/缺失(indel)。使用Manta软件识别结构变异(SV)。使用SubChrom分析工具检测拷贝数变异(CNV)和拷贝中性的杂合性缺失(cnLOH)事件。
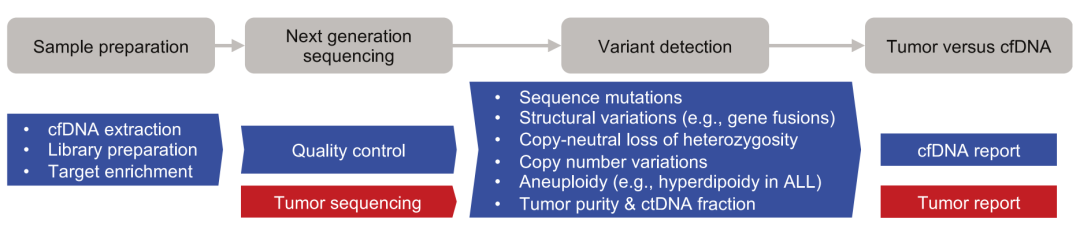
图1 针对儿童癌症患者cfDNA PeCan-Seq和变异检测的工作流程
结果显示,诊断时血液恶性肿瘤的血浆cfDNA产率显著高于实体瘤和脑肿瘤(图2)。此外,为检测cfDNA样品中的CNV和cnLOH事件,研究人员开发了一种分析工具SubChrom,以鉴定体细胞变异并定量PeCan-Seq数据中的ctDNA分数。结果显示,SubChrom成功检测到了患者不同染色体的超二倍体、亚二倍体、cnLOH和局灶性的拷贝数增加与减少。
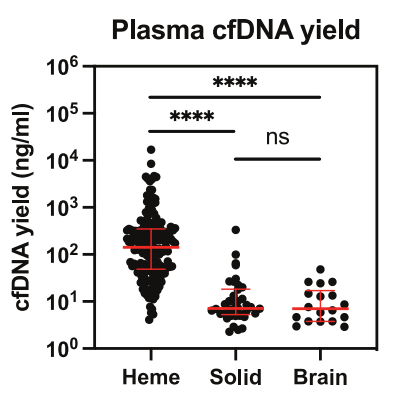
图2 不同癌症类型诊断时的血浆cfDNA产量对比图
研究人员发现,对患有恶性血液瘤的117位患儿,诊断时的血浆cfDNA都有可检测到的体细胞变异。cfDNA中ctDNA分数的中位数为0.77,与测序所得的原发性肿瘤纯度相当(图3A),并观察到原发性肿瘤纯度与ctDNA分数之间存在相关性(图3B)。在研究者测试的789种变异中,PeCan-Seq检测到98%的SNV和indel、100%的ITD(内部串联重复)、95%的局灶性CNV、99%的嵌合基因融合和99%的cfDNA染色体拷贝数畸变,总体检出率为97%。以上结果表明,来自cfDNA PeCan-Seq的突变谱与肿瘤测序结果高度一致。
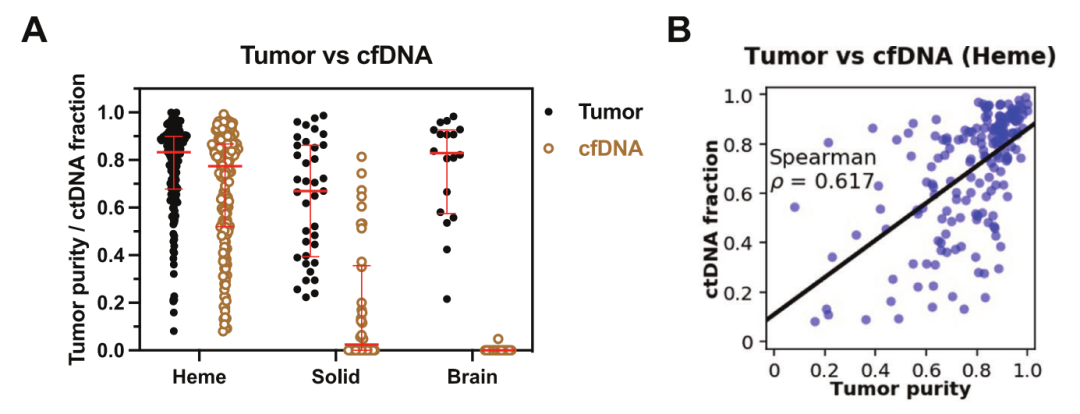
图3 恶性血液病患儿的肿瘤和cfDNA的体细胞改变情况(图A显示了患恶性血液瘤、实体瘤和脑瘤的儿童,其肿瘤纯度和ctDNA分数的定量情况;图B为肿瘤纯度和ctDNA分数的比较)
在38名患有实体瘤的儿童中,PeCan-Seq在19个具有不同ctDNA分数的cfDNA样品中鉴定到了基因组畸变(图3 A),其中ctDNA阳性患者中的cfDNA产率显著高于ctDNA阴性患者。在18名患有脑瘤的儿童中,研究人员鉴定到了一名患有脑瘤儿童的ctDNA(图3 A)。
为了鉴定未被初始基因面板覆盖的变体,研究者评估了12个患者cfDNA 样品的WGS测序情况。结果显示,基因组测序捕获了先前未发现的变异事件,包括序列突变、局灶性拷贝数改变和涉及部分基因的染色体重排。但由于基因组测序的覆盖度与PeCan-Seq相比相对较低(中位数,64对794倍),因此cfDNA中的低VAF变异事件未被基因组测序检出。
MRD(微小残留病灶)指在肿瘤治疗后患者体内剩余的少量肿瘤细胞,由于这些细胞无法通过常规的影像学或病理学方法检测到,因此常通过更敏感的分子生物学技术识别。在儿童肿瘤治疗中,MRD的检测和监测具有重要的预后评估和早期复发预警等临床意义。目前MRD的检测通常依赖于流式细胞术、聚合酶链式反应等传统技术。为准确确定疾病的持续性,目前的技术需对患者进行连续骨髓活检,然而骨髓采集和麻醉的长期使用可能导致大量的长期发病率。
在本研究中,研究人员对14名B-ALL患儿进行了PeCan-Seq,并收集他们在化疗期间的连续血浆样本,将cfDNA PeCan-Seq数据与流式细胞术确定的MRD水平进行比较,期望对现有测定方法进行补充。结果显示,在来自不同患者的cfDNA中均检测到不同类型的变体(图4)。这些变体包括第15天的序列突变、第15天和第22天的结构变异、第15天的CNV和cnLOH。cfDNA分析成功检测到了所有7名流式MRD水平超过1%的B-ALL患者中的体细胞变体,3名流式MRD在0.1%和0.01%之间的患者中的1名,以及4名流式细胞术检测不到MRD的患者中的1名存在体细胞变体。证明对患者cfDNA的PeCan-Seq可有效监测MRD水平。
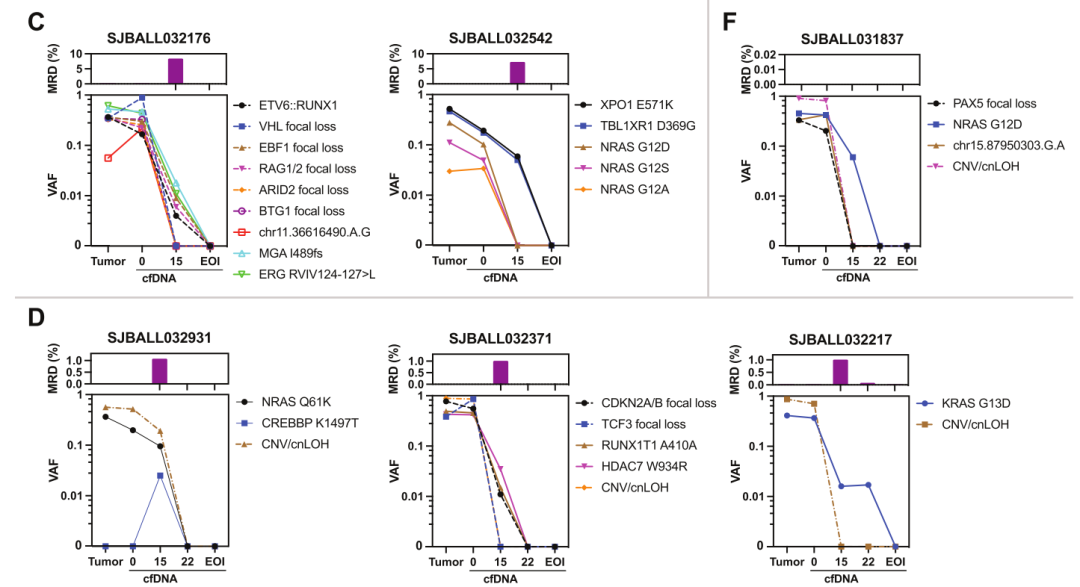
图4 通过PeCan-Seq监测通过流式细胞术确定的具有不同MRD的患者以检测ctDNA。(上图显示了流动MRD水平,下图显示了cfDNA中检测到的体细胞变体的VAF)
此外,在本研究队列中,一名儿童同时被诊断为超二倍体B-ALL和神经母细胞瘤,并在诊断后4个月复发具有独特基因组特征的神经母细胞瘤。研究人员对其诊断前三天收集的血浆cfDNA进行PeCan-Seq和WGS(图5),发现在这名同时患有B-ALL和神经母细胞瘤的儿童的血浆样本中,检测到了来自三种不同肿瘤实体的ctDNA,证明了ctDNA分析具有多肿瘤检测的能力。
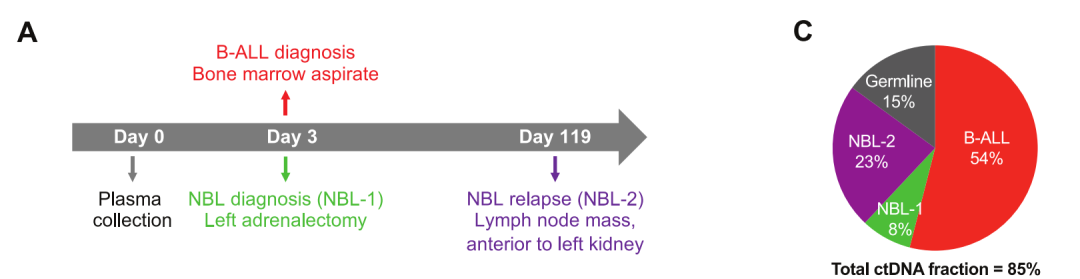
图5 在单个cfDNA样品中检测源自多种肿瘤的ctDNA。其中图A显示了该患者样本采集和肿瘤诊断的时间轴(B-ALL:B细胞急性淋巴母细胞白血病;NB:神经母细胞瘤),图C显示了cfDNA组成和总ctDNA分数的估计(总血浆cfDNA的54%来源于B-ALL,8%来源于诊断时的神经母细胞瘤,23%来源于诊断时存在的神经母细胞瘤的复发性亚克隆,其余来源于非肿瘤细胞)
综合以上研究结果,该研究团队成功开发了PeCan-Seq这一深度测序方法,针对儿童癌症患者血浆中的循环肿瘤DNA(ctDNA)进行基因组分析,以提高肿瘤检测和预后监测的效率。研究显示出PeCan-Seq作为非侵入性检测方法,在儿童血液恶性肿瘤的诊断和疾病监测中具有巨大潜力,同时也显示出该方法在实体瘤和脑瘤中需要进一步提升检测灵敏度。此外,研究还展示了PeCan-Seq在多肿瘤患者样本中检测ctDNA的能力,并显示出该技术在监测微小残留病灶(MRD)方面的应用前景,可作为传统流式细胞术的补充方法推广应用。


