Eur Heart J 华中科技大学夏家红教授团队揭示激动PIEZO1分子治疗马凡综合征胸主动脉瘤的新机制
时间:2024-11-27 21:00:40 热度:37.1℃ 作者:网络
马凡综合征(Marfan syndrome, MFS)是一种基因突变引起的遗传性结缔组织疾病。其主要心血管表现为胸主动脉瘤(TAA),严重时引起夹层破裂可危及生命,且有较高的死亡率。目前缺乏有效的药物治疗,手术治疗仍然是目前唯一的治疗方法。因此,深入探究参与马凡综合征TAA的信号通路和有效治疗靶点对于该疾病的治疗至关重要。
MFS TAA的主要病理变化是血管中层平滑肌细胞(VSMC)的表型转换导致的细胞外基质降解重塑、弹性纤维减少、变形断裂,胶原过度分泌。机械敏感离子通道PIEZO1是机体重要的力感应传感器,分布于血管平滑肌细胞上,调控多种心血管系统生理过程,如血压调节、血管发育等。
2024年11月25日,华中科技大学同济医学院附属协和医院心脏大血管外科夏家红教授和武汉市中心医院叶平教授团队在European Heart Journal杂志在线发表了题为“PIEZO1 attenuates Marfan syndrome aneurysm development through TGF-βsignaling pathway inhibition via TGFBR2”的研究论文。该研究国际上首次揭示了PIEZO1在马凡综合征胸主动脉瘤的作用及详细机制,为未来马凡综合征TAA治疗靶点的探究提供了可能性。

研究团队首次发现PIEZO1在TAA血管组织中表达减少。在马凡模型小鼠中,tamoxifen诱导的平滑肌细胞PIEZO1特异性缺失(Fbn1C1041G/+; Piezo1flox/flox; Sm22-CreERT2)显著促进了动脉瘤的形成和加重疾病严重程度。血管紧张素II诱导的主动脉瘤模型也展现了相同的效果。
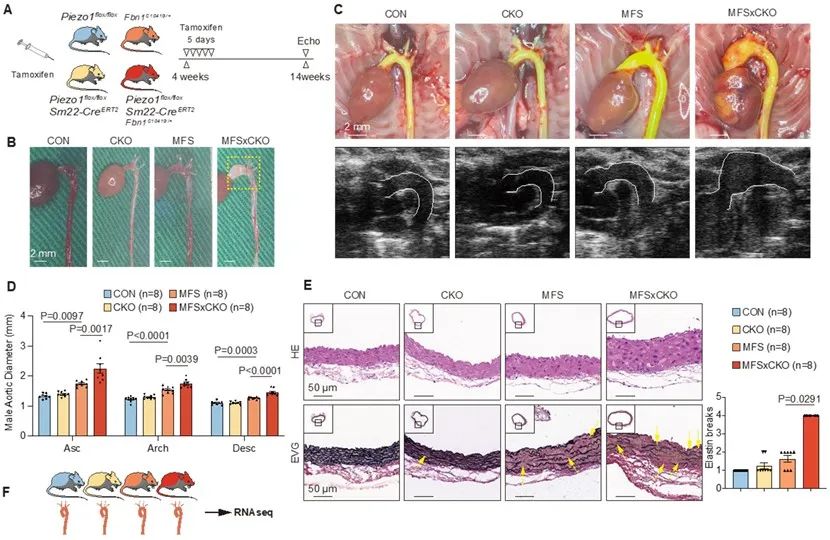
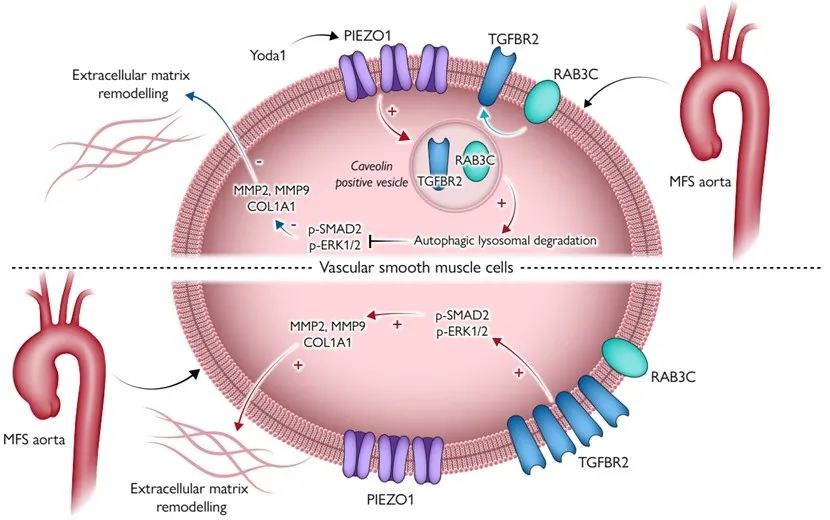
敲除鼠血管组织转录组测序进一步探究分子机制,研究发现PIEZO1缺失导致VSMC中TGF-β通路过度激活,细胞外基质降解重塑。富集分析显示囊泡转运和自噬过程受抑制,转化生长因子受体2 (TGFBR2)是TGF-β通路活化的关键膜蛋白,其内化自噬降解可调控信号通路的活化状态。通过提取分离细胞膜蛋白检测,TGFBR2的膜质转运过程受到抑制,导致TGFBR2在细胞膜表达增强,信号通路激活。
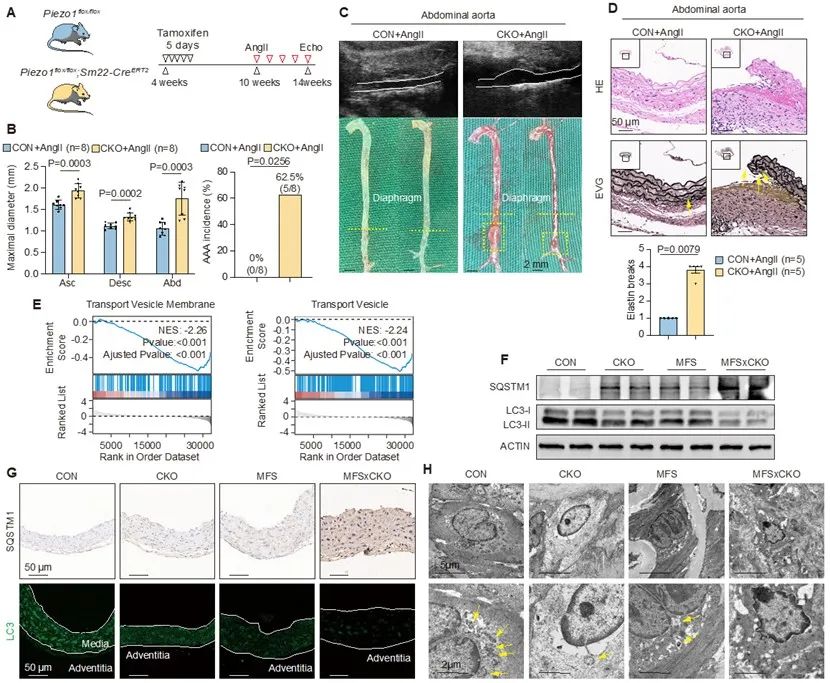
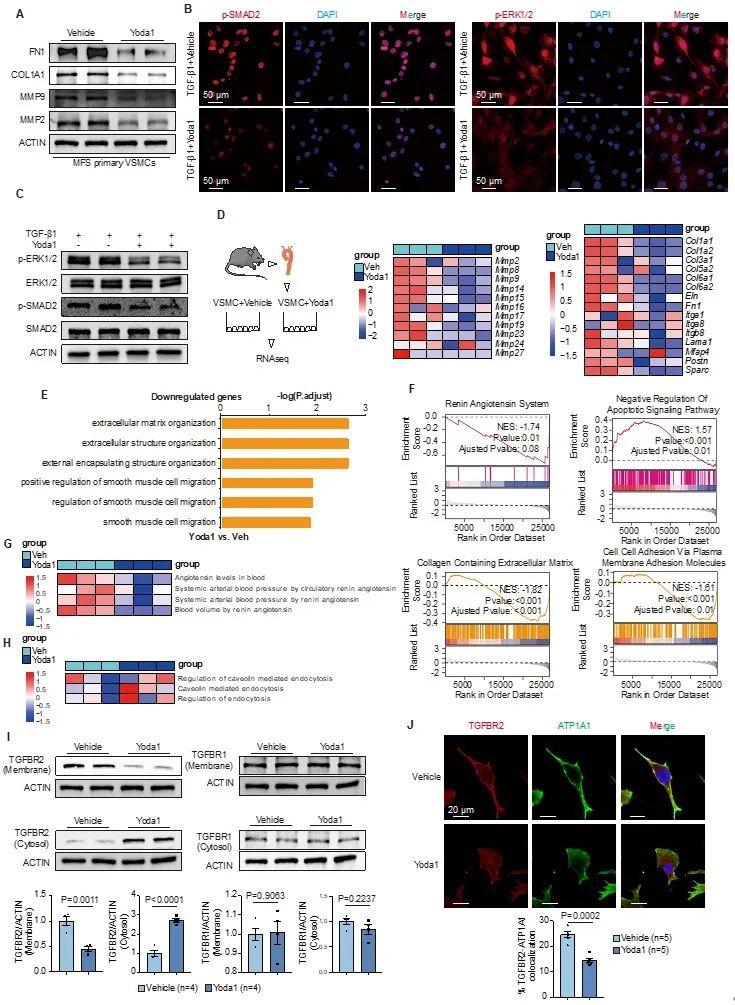
体外试验和转录组测序富集分析表明,Yoda1作为PIEZO1的特异性激动剂可抑制VSMC中TGF-β通路、细胞外基质降解重塑、细胞凋亡、胶原分泌、炎症激活等多种通路,可激活内吞转运、自噬降解等信号通路。此外,主动脉内皮细胞接受Yoda1刺激还可降低黏附分子炎性指标,提高一氧化氮合成酶磷酸化程度。提取分离VSMC细胞膜蛋白和荧光共聚焦显微镜检测显示,Yoda1促进TGFBR2钙离子依赖性从胞膜内吞转运至胞质,且这一过程是由小GTP酶(RAB3C)介导。
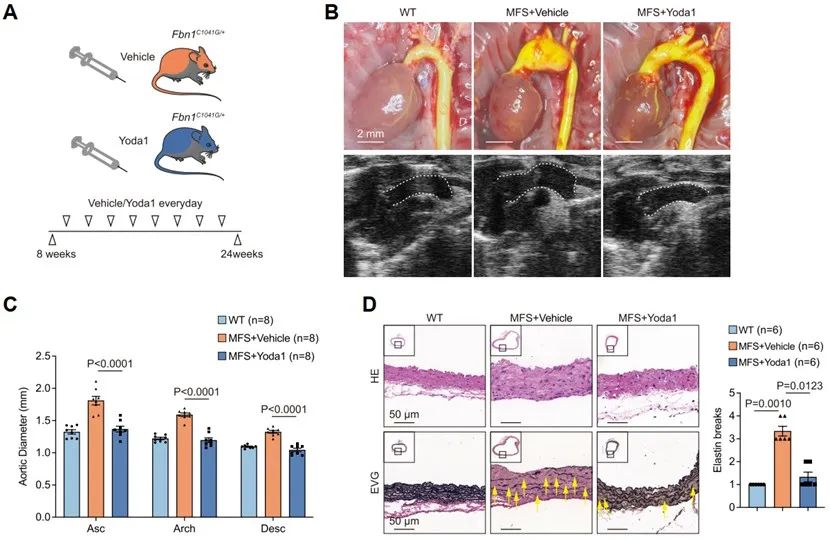
马凡综合征模型小鼠长期注射Yoda1可通过提高细胞膜TGFBR2内吞自噬作用,抑制TGF-β通路,减轻血管中层变性重塑和弹性纤维断裂,显著治疗TAA发生发展。
综上,研究论文揭示了PIEZO1在马凡综合征胸主动脉瘤的作用及详细机制,为其治疗开拓了新的思路,并提供了新的靶点。
华中科技大学同济医学院附属协和医院心外科的杨沛文博士、王诗琳硕士及武汉市中西医结合医院血管外科的刘浩博士为论文的共同第一作者,华中科技大学同济医学院附属协和医院的夏家红教授和武汉市中心医院的叶平教授为论文的共同通讯作者。该工作得到多项国家自然科学基金项目资助。
夏家红教授课题组致力于大血管疾病和移植免疫的基础及临床转化研究,成果显著,近些年来先后在Cell、European Heart Journal、Circulation、Immunity、Science Immunology、Cellular & Molecular Immunology等专业领域权威期刊发表多篇学术论文。
原文链接:
https://doi.org/10.1093/eurheartj/ehae786


