Nature:肠道如何在孕期完成“大变身”?解密母体适应的分子机制
时间:2024-12-09 06:03:21 热度:37.1℃ 作者:网络
引言
怀孕是哺乳动物生命中一个重要而独特的生理阶段,这一过程伴随着一系列复杂的身体和代谢适应,为母体的健康和后代的生长发育提供保障。在怀孕和哺乳期间,母体需要满足急剧增长的营养需求,这促使研究人员深入探索母体消化系统如何通过细胞和分子层面的改造来提升营养吸收效率。然而,对于肠道上皮的结构性变化及其背后的调控机制,仍存在许多未解之谜。
12月4日Nature报道的一项最新的研究“RANK drives structured intestinal epithelial expansion during pregnancy”,揭示了RANK(核因子-κB受体激活因子)及其配体RANKL(TNFSF11编码)的关键作用。研究人员发现,RANK-RANKL信号通路在小肠绒毛扩展中起着核心作用。这种扩展不仅显著增加了肠道的吸收表面积,还通过保护肠道上皮细胞免受凋亡以及调控干细胞微环境(niche)来确保肠道功能的维持。令人惊讶的是,RANK的激活不仅与怀孕和哺乳期的母体适应性肠道改造直接相关,还具有代际影响:缺乏肠道RANK信号的小鼠,其后代在代谢应激下表现出明显的葡萄糖耐受性下降。
这一研究突破性地揭示了肠道上皮细胞在怀孕和哺乳期间的动态重塑过程,阐明了RANK-RANKL信号如何通过骨形态发生蛋白(BMP)通路和抗凋亡基因调控等机制驱动这一现象。同时,该研究还为探索人类肠道适应性变化提供了重要线索。这一发现不仅加深了我们对怀孕期间母体适应机制的理解,也为未来开发针对肠道健康的治疗策略提供了潜在的科学基础。

孕期肠道的秘密改造:揭开母体适应的科学面纱
怀孕是哺乳动物生命中的一场重大变革,它不仅改变了母体的激素环境,也驱动了一系列身体和器官的深刻变化,以确保母亲和后代的健康。然而,在这复杂的生理适应背后,肠道这一消化吸收的重要器官如何高效应对母体营养需求激增的挑战,长期以来却鲜有人知。该研究为我们揭开了孕期肠道适应的秘密,将关注点聚焦在一个重要的生物学现象上:肠道绒毛的扩展。
研究发现,怀孕和哺乳期间,母鼠的小肠发生了显著的形态学变化:肠道绒毛显著拉长,其三维结构体积和表面积大幅增加。这种扩展的结果是显而易见的——母体肠道的营养吸收能力得到了显著提升,以满足胎儿和新生儿快速发育所需的额外营养需求。研究人员通过实验清楚地展示了这一过程:怀孕晚期的小鼠绒毛长度较未怀孕时增长了约30%,而哺乳期的小鼠绒毛表面积增加幅度甚至超过50%。这种肠道的“超级适应”是一种令人叹为观止的自然设计。
更令人好奇的是,这一绒毛扩展过程并不仅仅依赖于食物摄入量的增加或肠道微生物群的变化。研究人员在无菌环境中饲养的小鼠实验表明,即使在完全无菌的条件下,肠道的绒毛扩展依然如期发生,这表明其驱动力主要来源于母体内部的生物信号,而不是外部环境。这一现象的重要触发因素之一便是怀孕和哺乳期的特异性激素,如催乳素(prolactin)和孕激素(progesterone)。
绒毛扩展的幕后主角:RANK-RANKL信号通路的发现
在探讨母体适应机制的过程中,RANK-RANKL信号通路的发现无疑是一个重要的突破。这个由RANK(核因子-κB受体激活因子)及其配体RANKL(由TNFSF11基因编码)组成的分子信号轴,最初被认为主要参与骨骼重塑和免疫系统的调控。然而,该研究揭示了它在怀孕和哺乳期肠道绒毛扩展中的核心作用。
研究人员通过在小鼠体内和体外的实验发现,RANK广泛存在于肠道上皮细胞的表面,从未分化的干细胞到部分分化的吸收细胞,几乎无所不在。当小鼠肠道类器官(organoids)暴露于RANKL刺激下,其体积和表面积显著增加,且伴随着肠道干细胞数量的初期扩增。这一过程中,RANK-RANKL信号通过激活抗凋亡基因(如Bcl2、Birc3)和骨形态发生蛋白(BMP)通路,保护肠道上皮细胞免受凋亡,同时调节肠道干细胞的微环境。
更为重要的是,RANK信号对于绒毛结构的扩展起到了双重作用。短期激活时,它通过促进细胞增殖和维持干细胞存续,驱动肠道表面积的快速增加;但如果持续激活,肠道干细胞的数量将因过度分化而显著下降,从而引发绒毛萎缩。这种“早期利好、后期损耗”的双刃剑效应被实验数据清晰展示:在RANK信号持续激活的小鼠中,绒毛在初期快速增长后逐渐崩解,最终导致消化功能衰退。
此外,实验进一步揭示,RANK-RANKL信号的来源与怀孕和哺乳期的激素变化密切相关,特别是催乳素通过诱导肠道固有层中的细胞分泌RANKL,为绒毛扩展提供了关键驱动力。
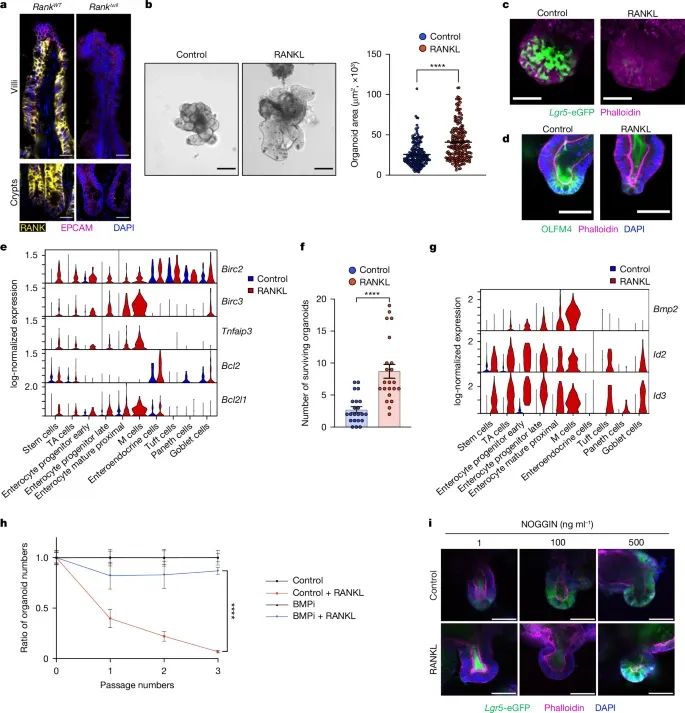
RANK-RANKL信号通路对小鼠肠道类器官(organoids)生长和干细胞耗竭的影响(Credit: Nature)
RANK和EPCAM在肠道上皮细胞的表达(a)
通过对RankWT(正常)和RankΔvil(缺失RANK的)小鼠肠道的免疫染色,研究发现RANK在大部分肠道上皮细胞中表达,而EPCAM作为上皮标记物显示了绒毛的结构。这表明RANK的表达具有广泛性,为后续实验奠定了基础。
RANKL促进类器官生长(b)
在加入重组小鼠RANKL(rmRANKL, 50 ng/ml)培养3天后,类器官的面积显著增加。对比未处理的对照组,RANKL组的类器官展示出明显的体积扩展。这一结果提示RANKL能通过RANK信号通路促进肠道组织的生长。
干细胞标记的变化(c和d)
使用标记Lgr5-eGFP的类器官,3D成像显示,RANKL刺激后类器官的芽数量减少,并表现出异常的形态变化。此外,OLFM4免疫染色显示,RANKL刺激引起了干细胞数量的下降。这说明RANKL在早期促进干细胞活跃,但长期刺激导致干细胞耗竭。
抗凋亡基因的激活(e)
RANKL刺激12小时后,单细胞RNA测序揭示抗凋亡基因(如Birc2、Birc3和Bcl2)的表达显著上调。该结果表明RANKL通过保护肠道细胞免于凋亡支持了组织的初期扩展。
抗损伤能力的提升(f)
RANKL刺激的类器官在经过辐射损伤后存活率高于对照组,进一步验证了RANK信号对肠道细胞的保护作用。
BMP信号的激活(g和h)
单细胞RNA测序显示,RANKL刺激显著上调了BMP2及其靶基因(Id2和Id3)的表达,表明RANK通过激活BMP通路调控类器官的生长。此外,BMP抑制剂LDN193189能够逆转RANKL引起的干细胞耗竭,说明BMP通路在这一过程中发挥了重要作用。
NOGGIN对RANKL效应的抑制(i)
在加入NOGGIN(BMP抑制剂)后,RANKL导致的类器官形态异常被部分抑制,进一步支持了BMP通路在RANKL作用中的关键地位。
从细胞到分子:RANK如何驱动肠道表面积的剧增
首先,在细胞层面,RANK的活性主要集中于肠道上皮细胞,从未分化的干细胞到部分分化的吸收细胞均表达这一受体。当RANKL与RANK结合时,这一信号通路通过激活抗凋亡基因(如Bcl2和Birc3),保护肠道上皮细胞免受凋亡,从而延长细胞寿命。研究显示,在RANK信号刺激下,小鼠肠道类器官(organoids)的存活能力显著增强,即使在受到辐射损伤后仍能维持基本功能。
其次,在干细胞调控方面,RANK信号对肠道干细胞的扩增和分化起到了双向调节作用。实验数据表明,短期RANKL刺激促进干细胞的增殖和功能细胞的分化,使肠道表面积迅速增加。然而,持续的RANKL暴露则导致干细胞数量的减少以及组织结构的紊乱,表现为干细胞标志物(如Lgr5和OLFM4)的表达显著下降,最终影响绒毛的维持和功能。
在分子机制层面,RANK信号通过激活骨形态发生蛋白(BMP)通路,进一步调控肠道干细胞的分化。研究显示,RANK刺激引起的BMP2及其下游基因(如Id2和Id3)的表达上调是关键环节,而BMP抑制剂(如NOGGIN)能够有效逆转这一过程,恢复干细胞的自我更新能力。此外,RANK还通过NF-κB信号通路增强抗凋亡效应,同时间接调控MAPK-ERK等细胞增殖通路,为绒毛扩展提供了多层次保障。
总之,RANK通过调控细胞生存、干细胞行为和分子信号通路,驱动了肠道绒毛的动态扩展,为母体应对怀孕和哺乳的高能量需求提供了一个精密而高效的生物适应系统。
怀孕不仅关乎母亲:肠道适应的代际影响
母体在怀孕和哺乳期间的生理变化不仅关乎自身健康,也深刻地影响着后代的发育和未来的健康状况。该研究显示,肠道的适应性改造通过RANK信号通路在代际健康中扮演了关键角色。
首先,实验表明,如果母鼠缺乏肠道中RANK信号,其后代从胚胎阶段便已显现负面影响。在怀孕的第18.5天,这些后代的体重较正常母鼠的后代显著降低。这种差异在出生后持续存在,尤其是在哺乳期表现尤为突出。这一现象反映了肠道适应对母体提供充足营养的关键作用:RANK驱动的肠道绒毛扩展大幅提高了营养吸收效率,而这一能力的丧失直接限制了母体为胎儿和新生儿提供足够养分的能力。
更为重要的是,这种影响并未随着哺乳期的结束而终止。后代在成年后表现出更高的代谢压力易感性。研究发现,当这些后代被喂以高脂饮食时,与正常母鼠的后代相比,其表现出更严重的葡萄糖耐受不良和胰岛素抵抗。代谢指标的差异通过胰岛素抵抗指数(HOMA-IR)进一步量化,RANK信号缺失母鼠的后代表现出显著的胰岛素敏感性降低。这种代谢缺陷暗示,母体在怀孕和哺乳期间的肠道适应性改造对于后代的长期代谢健康具有不可忽视的影响。
更具体地说,缺乏RANK信号的母鼠,其乳汁中多种营养成分(如脂肪酸、维生素A和乳糖结合免疫球蛋白A)的含量均显著下降。母乳的质量是哺乳期后代健康的决定性因素之一,这些营养成分的减少无疑进一步加重了后代的营养负担和免疫弱势。
该研究清楚地表明,怀孕和哺乳期间肠道适应的意义早已超越了母体本身,而成为下一代健康成长的重要保障机制。RANK信号通路驱动的肠道改造不仅是母体生命智慧的体现,也为后代的生存和健康提供了深远的保护。
意外的双刃剑:RANK持续激活的潜在风险
尽管RANK信号通路在孕期肠道适应中扮演着至关重要的角色,但这一机制并非一味带来好处。当RANK信号被异常持续激活时,其作用却可能演变为一把双刃剑,对肠道健康带来潜在的严重威胁。
研究通过构建持续激活RANK信号的小鼠模型揭示了这一风险。在这些小鼠中,小肠绒毛在初期表现出快速扩展,其长度和表面积显著增加。然而,这种扩展并未持久,随着时间推移,干细胞数量大幅下降,绒毛结构逐渐崩解,最终导致肠道吸收功能的全面退化。数据显示,这些小鼠在断奶后体重快速下降,并因营养不良而被迫提前终止实验。这一结果表明,RANK信号虽然短期内能提升肠道功能,但其长期激活却会引发干细胞枯竭和组织结构紊乱。
深入分析发现,这种“代价”与RANK通过BMP通路对干细胞分化的持续驱动密切相关。当RANK信号过度活跃时,BMP通路中的关键基因(如BMP2及其下游的Id2和Id3)被显著上调,抑制了肠道干细胞的自我更新能力,导致干细胞资源的枯竭。此外,RANK还通过NF-κB通路激活抗凋亡机制,这种看似保护的功能却在持续激活时导致细胞增殖与分化失衡,加速了肠道组织的恶化。
实验进一步发现,RANK的持续激活不仅损害肠道功能,还可能影响整体健康。例如,实验显示这种状态能够抑制由WNT信号驱动的肠道肿瘤形成,尽管这一现象为未来癌症治疗提供了潜在线索,但其带来的系统性健康风险不可忽视。
这一研究也警示我们,RANK信号通路在母体适应中并非绝对的“英雄”。它的作用高度依赖于时间和激活强度的精准调控。适度的激活是保障母体和后代健康的基础,但过度或长期的活跃则可能演变为风险。
从小鼠到人:RANK信号在人类肠道中的潜力
尽管许多关于RANK信号的研究在小鼠模型中取得了突破性进展,但这一通路在人类肠道中的作用是否相似,仍然是研究人员亟需解答的问题。令人兴奋的是,该研究通过人类肠道类器官的实验验证,初步证实了RANK信号在人类肠道中的关键潜力。
研究显示,人类肠道类器官在暴露于RANKL(RANK的配体)后表现出显著的形态变化。与小鼠实验一致,这些类器官的整体生长能力明显增强,绒毛样结构的表面积显著扩大。这一过程同样伴随着抗凋亡基因(如BCL2、BIRC3)的上调和骨形态发生蛋白(BMP)通路的激活。特别是,BMP2及其下游靶基因(如ID2和ID3)的表达增加,为绒毛样结构的扩展提供了强有力的分子支持。
进一步的实验揭示,RANK信号在人类肠道干细胞的调控中扮演了类似的角色。当RANKL持续刺激类器官时,初期干细胞数量有所增加,但随后出现干细胞枯竭和分化异常的现象。这表明,尽管RANK信号对短期内提升肠道吸收能力至关重要,但其长期激活同样可能对肠道组织的稳定性造成威胁。
研究还利用BMP抑制剂(如LDN-193189)和基因敲除手段对这些机制进行了验证。实验发现,抑制BMP信号通路可以完全逆转RANK激活导致的干细胞枯竭,从而为人类肠道疾病的治疗提供了重要线索。这一发现意味着,通过精准调控RANK和BMP信号,人类肠道健康问题(如慢性炎症性肠病或放疗损伤)的治疗或许将迎来新的突破。
从小鼠到人类,RANK信号在人类肠道中的潜力逐步得到验证。其在调控肠道适应性变化中的作用,揭示了一个可能的治疗窗口,为探索肠道疾病的治疗策略提供了科学依据。
如何利用RANK-RANKL探索肠道健康新领域
RANK-RANKL信号通路在怀孕和哺乳期肠道适应中的核心作用为研究人员提供了全新的研究视角。这一信号不仅揭示了母体肠道如何通过动态重塑应对营养需求,也为未来肠道健康的研究和干预开辟了广阔的可能性。
首先,RANK-RANKL在调控肠道干细胞功能中的作用为修复性医学提供了启示。研究表明,RANKL可以通过增强肠道细胞的抗凋亡能力,提高组织对损伤的耐受性。例如,在接受放射治疗后,RANKL刺激的人类肠道类器官表现出更高的存活率。这为开发以RANK信号为靶点的放疗保护剂提供了基础,特别是在癌症治疗引发的肠道损伤修复领域。
其次,RANK信号对骨形态发生蛋白(BMP)通路的调控能力,提示了其在治疗肠道疾病中的潜力。BMP通路的过度激活与干细胞枯竭相关,而通过RANK信号的精准调节或使用BMP抑制剂,可以有效恢复肠道干细胞的功能。这为慢性炎症性肠病、肠道纤维化等疾病提供了新的治疗策略。同时,RANK信号还可能在代谢性疾病的干预中发挥作用,例如通过调控肠道营养吸收效率改善糖尿病或肥胖等问题。
另一个重要领域是癌症研究。实验表明,RANK的持续激活能够抑制由WNT信号驱动的肠道肿瘤形成。尽管这一现象在动物模型中表现复杂,但它提示RANK信号可能在癌症预防中具有重要价值。未来,研究如何平衡RANK信号对健康组织和病变组织的双重作用,将是肠道肿瘤治疗的新方向。
此外,RANK-RANKL信号的可逆性为探索肠道微生物与宿主相互作用提供了新的契机。在怀孕和哺乳期间,这一通路的动态调节似乎主要由母体激素驱动,但它是否与微生物群协同调控,仍是有待解答的问题。
未来,RANK-RANKL信号的研究可能推动精准医学的进一步发展,特别是在肠道健康管理方面。通过深入挖掘这一信号通路的生物学机制,我们有望开发出更加高效、安全的治疗方案。
参考文献
Onji, M., Sigl, V., Lendl, T. et al. RANK drives structured intestinal epithelial expansion during pregnancy. Nature (2024). https://doi.org/10.1038/s41586-024-08284-1


