陆军军医大学江虹/董世武团队《Biomaterals》:“策反”破骨细胞,修复股骨头坏死——科研版“魔丸”打破成见“重塑肉身”
时间:2025-03-30 12:09:43 热度:37.1℃ 作者:网络
电影中,哪吒生来就背负着“魔丸”的命运,但他打破成见,天劫过后重塑肉身,蜕变成东方神话“英雄”。这一情节迎来了科研版演绎——陆军军医大学江虹教授、董世武教授团队从破骨细胞的调控出发,设计出一种负载miRNA纳米载体的可注射水凝胶(AHH/GPC@miR),通过“策反”具有噬骨功能的破骨细胞,提升血管相关性破骨细胞的数量,重建骨内微环境,实现了股骨头坏死修复与再生。该研究打破了破骨细胞“噬骨者”的刻板印象,为再生医学开辟了一条充满东方哲思的新路径。相关工作以“An injectable hydrogel loaded with miRNA nanocarriers promotes vessel-associated osteoclast (VAO)-mediated angiogenesis and bone regeneration in osteonecrosis of the rat femoral head”为题,发表在《Biomaterials》上。

激素、创伤、酒精等因素均可能引起股骨头坏死(osteonecrosis of the femoral head,ONFH),需要在早期制定有效的治疗策略来保护髋关节功能,以防止股骨头塌陷,推迟或避免髋关节置换术。生物医学技术的发展催生出各种类型的骨修复材料,它们虽能提供有效支撑,改善髋关节功能,但对于ONFH的修复和再生效果仍不理想,这很大程度上归因于骨内微环境的破坏。骨骼系统维持骨内微环境的稳定性和功能依赖于骨组织内多种细胞的协同作用。在ONFH中,骨内微环境的动态失衡主要表现为成骨细胞、破骨细胞及血管系统的功能紊乱,进而引发“血管生成-骨吸收-骨形成”网络的紊乱。对于早期ONFH治疗,维持骨内微环境的稳定和功能是其成功的关键。
陆军军医大学江虹教授、董世武教授团队近来研究发现,在ONFH患者的股骨头标本和不同因素诱导的ONFH大鼠模型中,血管相关性破骨细胞(vessel-associated osteoclasts,VAOs)和骨吸收性破骨细胞(bone-associated osteoclasts,BAOs)的数量和分布发生了明显变化,证实VAOs与BAOs失衡参与了ONFH的病理过程。为此,该团队开发了一种可注射的海藻酸盐(ALG)/羟基磷灰石(HA)水凝胶(AHH),负载以氧化石墨烯为基础的miR-7b纳米载体(GPC@miR)用于ONFH治疗。通过系统研究AHH/GPC@miR在ONFH修复中的作用机制,证明了通过调控VAOs和BAOs实现血管生成与骨再生协同调控的可行性与有效性。该研究不仅为ONFH的早期微创治疗提供了新的思路,也为探索破骨细胞异质性及其相关疾病的治疗策略奠定了理论基础。
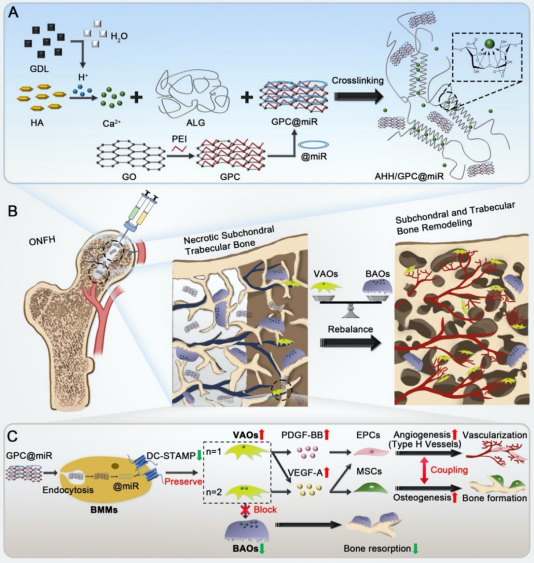
【文章要点】
在该研究中,作者团队利用静电相互作用构建具有低细胞毒性和高转染效率的GPC@miR(图1),再通过D-(+)-葡萄糖酸δ-内酯(GDL)缓慢水解形成弱酸性环境,触发HA释放Ca2+原位交联ALG,制备出均匀的可注射性水凝胶AHH/GPC@miR,并通过调节ALG和GDL的浓度,获得强度和凝胶时间可调的水凝胶,实现了对GPC@miR的稳定可控释放(图2)。
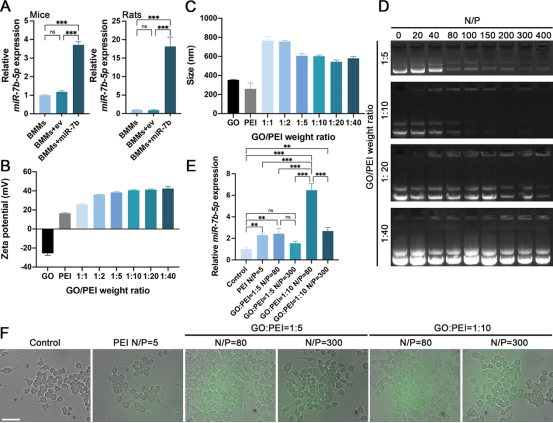
图1. GPC@miR的制备与表征。
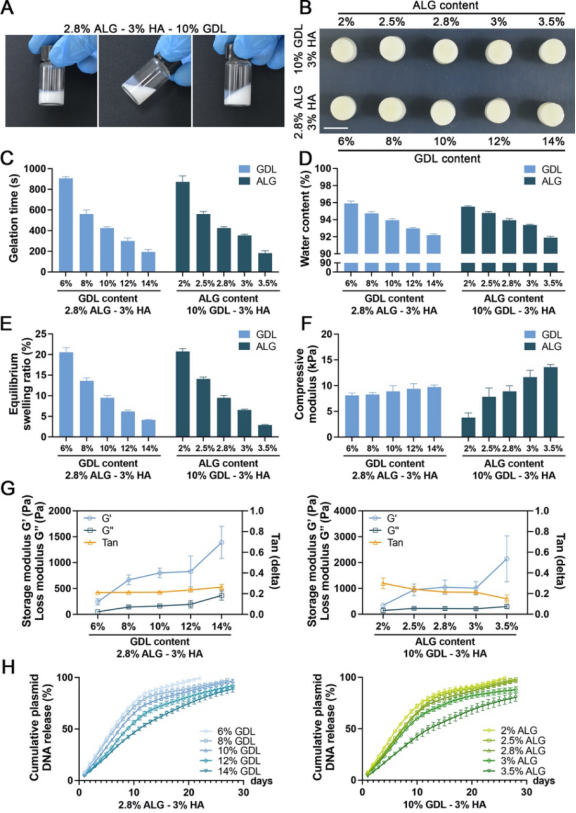
图2. AHH/GPC@miR的制备与表征
在体外实验中,通过M-CSF/RANKL诱导BMMs分化为多核破骨细胞,成功建立了VAO样细胞和BAO样细胞的研究模型,并发现AHH/GPC@miR能够靶向抑制树突状细胞特异性跨膜蛋白(DC-STAMP),有效抑制BAO样细胞的形成,同时保留VAO样细胞的形成并增加其数量(图3)。VAO样细胞与体内的VAOs在形态、功能及分泌特性上具有高度相似性,其通过分泌血小板衍生生长因子-BB(PDGF-BB)和血管内皮生长因子-A(VEGF-A)显著促进了EPCs血管生成和MSCs的骨生成;BAO样细胞在骨吸收功能上则与体内BAOs高度一致,验证了体外模型的可靠性(图4、图5)。
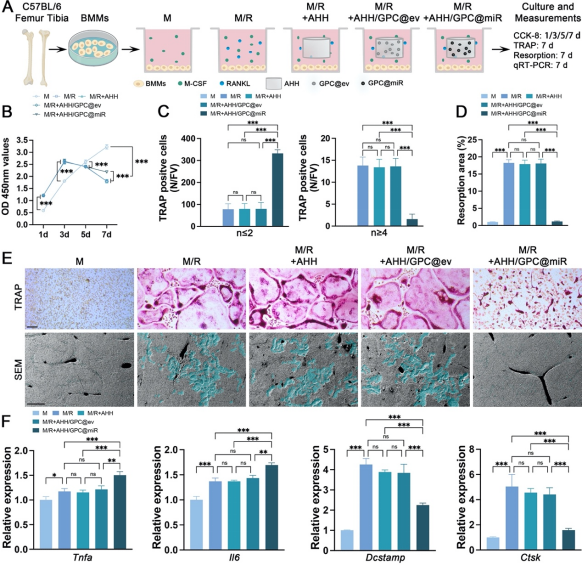
图3.AHH/GPC@miR通过靶向DC-STAMP抑制BAO样细胞并保留VAO样细胞
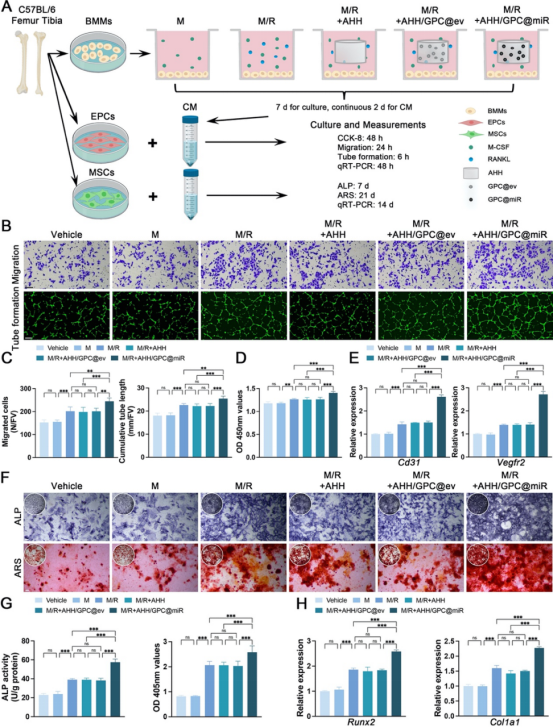
图4. AHH/GPC@miR通过保留VAO样细胞促进EPCs血管生成和MSCs骨生成
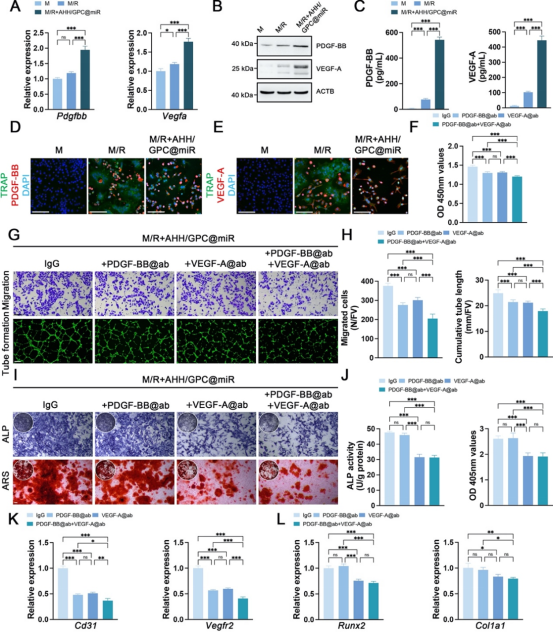
图5. AHH/GPC@miR保留的VAO样细胞通过分泌PDGF-BB和VEGF-A促进血管生成和骨生成
在体内实验中(图6、图7、图8、图9),ONFH大鼠模型的研究进一步验证了AHH/GPC@miR的治疗效果。局部注射AHH/GPC@miR显著减少了BAOs的数量,抑制了过度的骨吸收;同时,保留并增加了VAOs的数量,促进了PDGF-BB和VEGF-A的分泌,显著改善了血管生成和骨形成。影像学和组织学分析表明,AHH/GPC@miR通过逆转VAOs和BAOs失衡,不仅促进了总血管生成和H型血管生成,还显著提升了坏死区的骨形成能力,最终实现了ONFH的修复与再生。
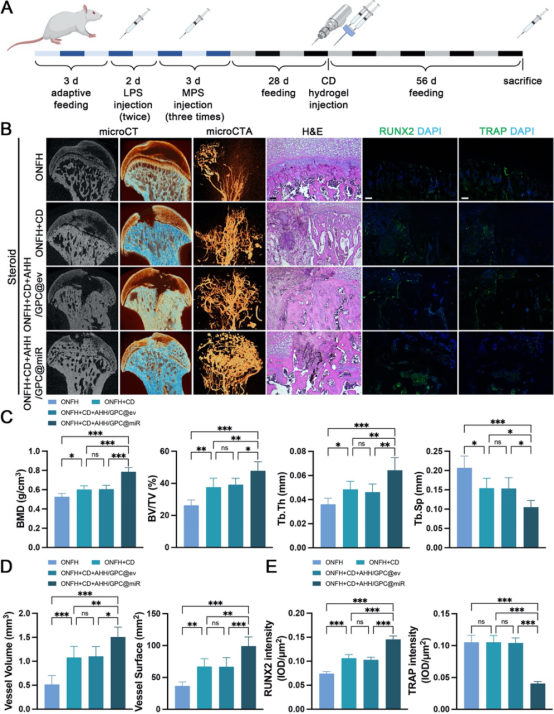
图6. 激素性ONFH大鼠在不同治疗方式下股骨头影像学与病理学改变评价
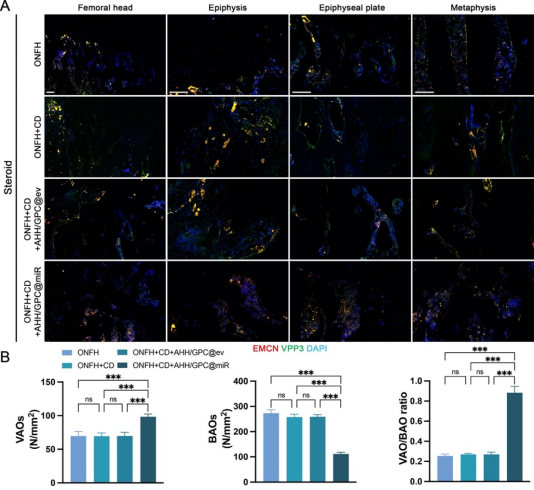
图7. 激素性ONFH大鼠在不同治疗方式下股骨头中VAOs和BAOs评价
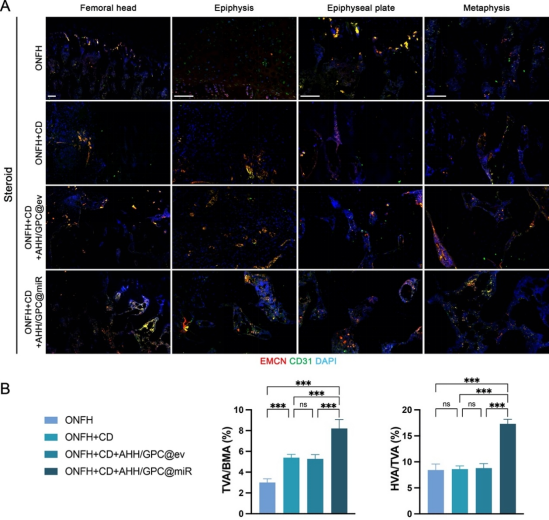
图8. 激素性ONFH大鼠在不同治疗方式下股骨头总血管和H型血管评价
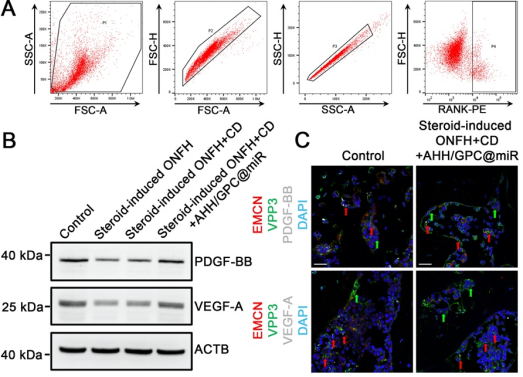
图9.激素性ONFH大鼠在不同治疗方式下股骨头RANK阳性细胞以及切片中PDGF-BB和VEGF-A表达评价
陆军军医大学生物医学工程与影像医学系江虹教授和董世武教授为该论文的共同通讯作者,重庆大学-陆军军医大学联合培养博士全弘宇为该论文的第一作者。该研究受到国家自然科学基金区域创新发展联合基金项目、国家自然科学基金重点项目、国家自然科学基金面上项目、重庆市自然科学基金面上项目等多项课题资助。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0142961225001711?via%3Dihub

