华南理工大学王均、许从飞《Cell》子刊,CAR-T细胞疗法新进展
时间:2025-03-14 12:09:19 热度:37.1℃ 作者:网络
HIV融合技术助力CAR-T细胞疗法
CAR-T细胞疗法在治疗血液系统恶性肿瘤方面展现出显著的疗效,但传统方法依赖于体外病毒介导的CAR基因表达,存在生产流程复杂、成本高昂以及潜在的细胞因子释放综合征(CRS)和肿瘤发生风险。近年来,mRNA疗法作为一种替代方案,能够快速在细胞内表达功能性蛋白且无需基因整合,然而其递送效率受限于T细胞摄取能力差和内质网逃逸效率低。因此,开发一种能够高效、特异性地将CAR mRNA递送至T细胞的新型载体,对于简化CAR-T细胞生产流程、降低成本并提高治疗安全性具有重要意义。
华南理工大学王均、许从飞等人主要探究了如何利用一种模拟HIV融合机制的T细胞特异性融合性病毒样颗粒(T-FVLPmCAR)实现CAR mRNA的高效递送,从而在体内直接生成CAR-T细胞。他们通过设计T-FVLPmCAR,使其表面展示突变的HIV包膜糖蛋白gp160,能够特异性识别并融合T细胞膜,将CAR mRNA直接递送至T细胞的细胞质中。相关内容以“Leveraging T cell-specific fusogenicity of HIV for in vivo mRNA delivery to produce human CAR-T cells”为题发表在《Cell Biomaterials》。

【主要内容】
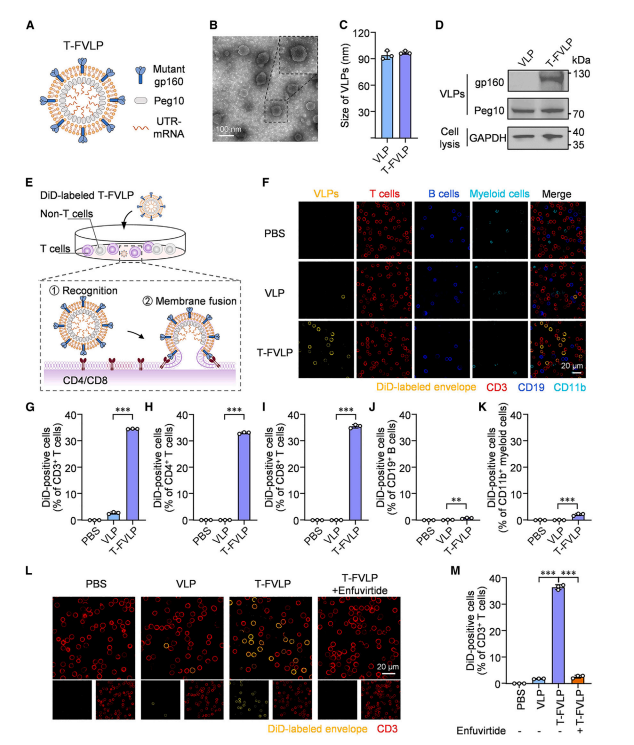
图1 构建具有T细胞特异性膜融合能力的T-FVLP
图中展示了T细胞特异性融合性病毒样颗粒(T-FVLP)的设计与表征。研究人员通过共转染293TB2M⁻/⁻细胞,使其表达突变型gp160包膜糖蛋白和Peg10衣壳蛋白,成功制备了T-FVLP。透射电子显微镜图像显示T-FVLP为直径97.2 nm的球形颗粒,具有良好的单分散性。Western blot分析确认了T-FVLP表面的突变型gp160和Peg10蛋白成分。实验中,T-FVLP与人类PBMCs共孵育后,通过荧光标记和流式细胞术分析发现,T-FVLP能够特异性地与T细胞膜融合,使34.6%的CD3⁺ T细胞表现出融合信号,显著高于对照组(2.7%)。此外,加入gp160抑制剂 enfuvirtide后,融合效率显著降低,证实了突变型gp160在T-FVLP与T细胞膜融合中的关键作用。
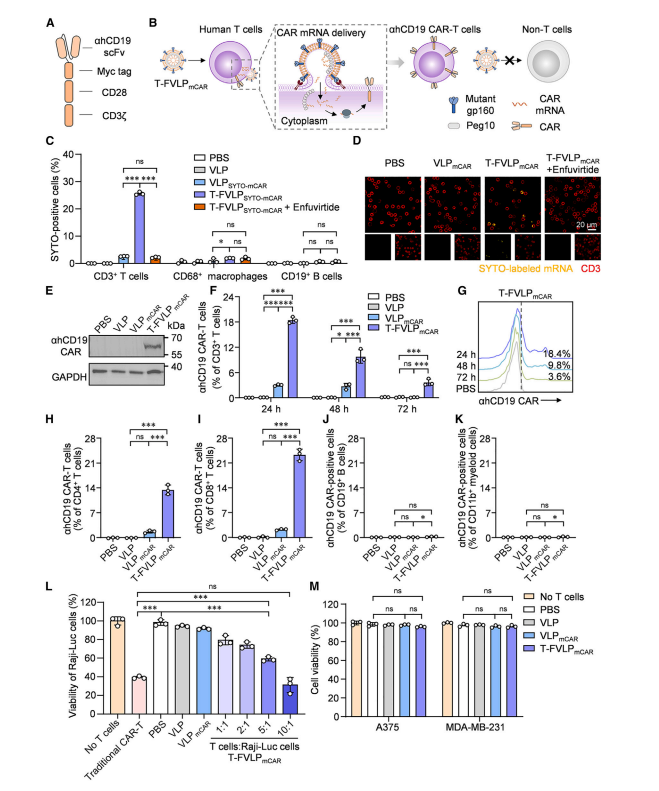
图2 T-FVLPmCAR通过T细胞特异性膜融合产生ahCD19 CAR-T细胞
图中展示了T-FVLPmCAR在体外将人类T细胞重编程为ahCD19 CAR-T细胞的过程。研究人员将ahCD19 CAR mRNA装载到T-FVLP中,通过突变型gp160介导的膜融合,将CAR mRNA高效递送至T细胞的细胞质中。实验结果表明,25.6%的CD3⁺ T细胞在与T-FVLPmCAR共培养后成功表达了CAR蛋白,且CAR-T细胞表现出对CD19⁺肿瘤细胞的特异性杀伤能力。此外,CAR-T细胞的生成具有瞬时性,CAR表达在48小时后显著下降,这有助于降低细胞因子释放综合征(CRS)的风险。
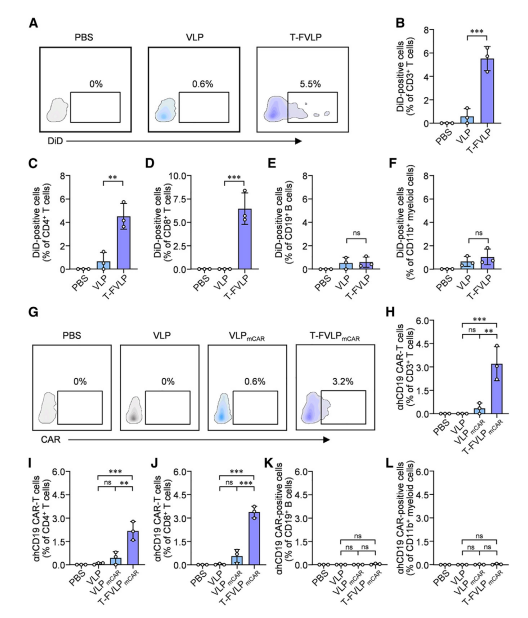
图3 通过T-FVLPmCAR在体内构建ahCD19 CAR-T细胞
图中展示了T-FVLPmCAR在体内生成ahCD19 CAR-T细胞的能力。通过尾静脉注射DiD标记的T-FVLP和T-FVLPmCAR到免疫人源化NCG小鼠体内,研究人员发现T-FVLP能够特异性地与循环T细胞膜融合,使5.5%的CD3⁺ T细胞表现出DiD阳性信号,而B细胞和髓系细胞中几乎未检测到融合信号。进一步实验表明,T-FVLPmCAR能够将3.2%的循环T细胞转化为ahCD19 CAR-T细胞,且在非T细胞中未检测到CAR表达,证实了T-FVLPmCAR在体内生成CAR-T细胞的特异性和高效性。
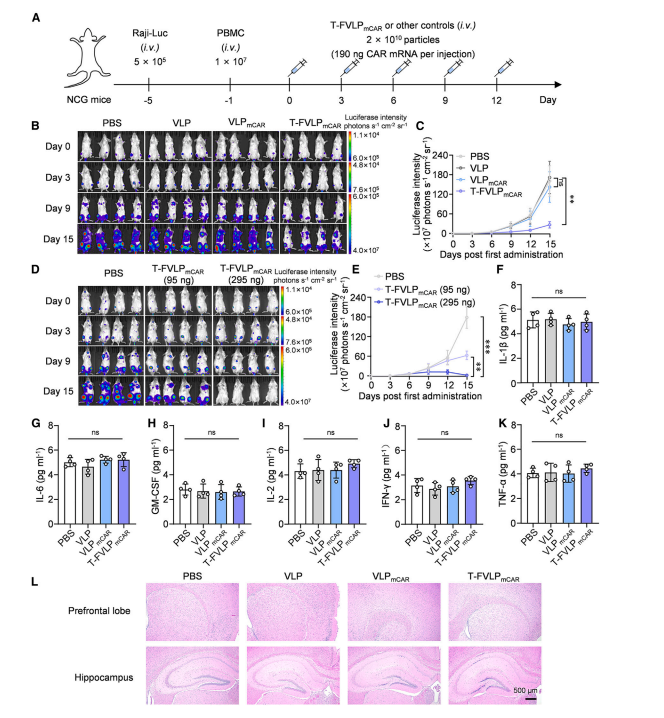
图4 T-FVLPmCAR治疗B细胞淋巴瘤且不引发明显副作用
图中展示了T-FVLPmCAR在体内治疗B细胞淋巴瘤的效果及其安全性。实验中,免疫人源化NCG小鼠被植入Raji-Luc B细胞淋巴瘤后,接受T-FVLPmCAR治疗。结果显示,T-FVLPmCAR显著抑制了肿瘤生长,肿瘤抑制率高达83.5%~99.0%,且在高剂量下部分小鼠实现了完全肿瘤消退。此外,治疗后小鼠血清中炎症细胞因子水平未显著升高,体重无明显变化,组织病理学分析也未发现明显的组织损伤或神经毒性,表明T-FVLPmCAR具有良好的生物相容性和安全性。
【全文总结】
本研究开发了一种模拟HIV融合机制的T细胞特异性融合性病毒样颗粒(T-FVLPmCAR),用于在体内高效递送CAR mRNA以生成人类CAR-T细胞。T-FVLPmCAR通过其表面的突变gp160蛋白特异性识别T细胞,并与T细胞膜融合,直接将CAR mRNA递送至细胞质中,从而在体内外高效生成CAR-T细胞。实验结果表明,T-FVLPmCAR在小鼠模型中能够有效抑制B细胞淋巴瘤生长,肿瘤抑制率高达83.5%~99.0%,且未引发细胞因子释放综合征(CRS)或其他显著副作用。这种基于HIV融合机制的mRNA递送策略不仅提高了CAR-T细胞的生成效率和安全性,还为未来CAR-T细胞疗法的临床应用提供了一种更具可及性和可扩展性的新方法。
原文链接:
https://www.cell.com/cell-biomaterials/fulltext/S3050-5623(25)00002-9

