Nature 孔炜/孙金鹏/姜长涛/郑金刚教授团队研发靶向神经酰胺受体-降胆固醇以外的抗动脉粥样硬化新策略
时间:2025-03-09 12:08:36 热度:37.1℃ 作者:网络
动脉粥样硬化是心血管事件的核心病理基础[1]。当前以他汀类药物为代表的降脂策略仅降低约1/3的心血管不良事件风险,仍有大量患者面临“残余风险”而发生心血管事件[2,3]。尤其是在慢性肾病(CKD)患者中,随着肾功能逐渐下降,胆固醇水平降低带来的心血管疗效也随之减弱,在终末期肾病患者中完全丧失。神经酰胺是由鞘氨醇链和不同长度的脂肪酸链通过酰胺键连接而成的鞘脂。近年临床研究表明,循环血中长链神经酰胺(如C16:0、C18:0和C24:1)的水平可独立于胆固醇预测心血管事件风险,被称为“第二胆固醇”[4,5]。然而,循环中的长链神经酰胺加重动脉粥样硬化性心血管疾病的机制未明。
2025年3月6日,由北京大学医学部基础医学院、血管稳态与重构全国重点实验室孔炜教授团队牵头,联合北京大学医学部基础医学院/山东大学孙金鹏教授团队、北京大学医学部基础医学院姜长涛教授团队、中日友好医院心脏科郑金刚教授团队,在Nature上发表了研究论文“Sensing ceramides by CYSLTR2 and P2RY6 to aggravate atherosclerosis”(加速发表)。该研究团队首次鉴定了神经酰胺的内源性受体CYSLTR2和P2RY6,阐明了神经酰胺加重动脉粥样硬化的作用及分子机制,解析了神经酰胺-CYSLTR2复合物结构。结合临床队列,发现CKD患者血中神经酰胺水平升高,其水平与冠心病严重程度正相关。这一发现为破解脂质残余风险提供了新的路径,靶向神经酰胺受体或将成为破局关键。

在动脉粥样硬化的疾病进程中,巨噬细胞和内皮细胞的炎症小体起到重要介导作用[6,7]。研究团队首先构建了小鼠动脉粥样硬化模型,发现外源给予C16:0神经酰胺促进动脉粥样硬化,此过程依赖炎症小体激活。体外实验表明,C16:0神经酰胺激活内皮细胞和巨噬细胞中NLRP3炎症小体,这一过程可被Gq抑制剂阻断,提示C16:0神经酰胺可能结合Gq偶联的G蛋白偶联受体(GPCR)。结合生物信息学分析和实验筛选,发现神经酰胺C16:0直接激活两种受体,即半胱氨酰白三烯受体2 (cysteinyl leukotriene receptor 2, CYSLTR2)和嘧啶能受体P2Y6 (pyrimidinergic receptor P2Y6, P2RY6)。进一步,不同碳链长度神经酰胺对CYSLTR2和P2RY6激活的选择性和模式不同。
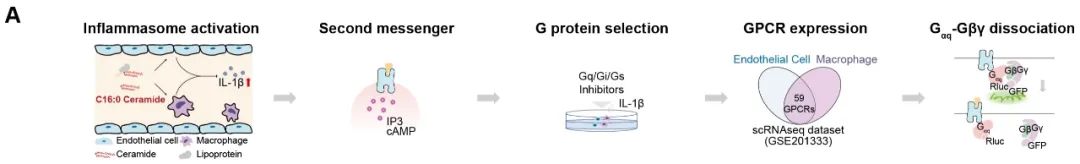
图1. 神经酰胺受体的筛选流程
为了明确CYSLTR2和P2RY6是否介导神经酰胺的致病作用,研究团队通过构建动脉粥样硬化模型,发现Cysltr2-/-小鼠或P2ry6-/-小鼠,虽然血浆胆固醇和神经酰胺的水平无显著变化,但高脂饮食诱导或外源性神经酰胺C16:0回补所加重的动脉粥样硬化均显著减轻,双敲除两个受体效果更显著。
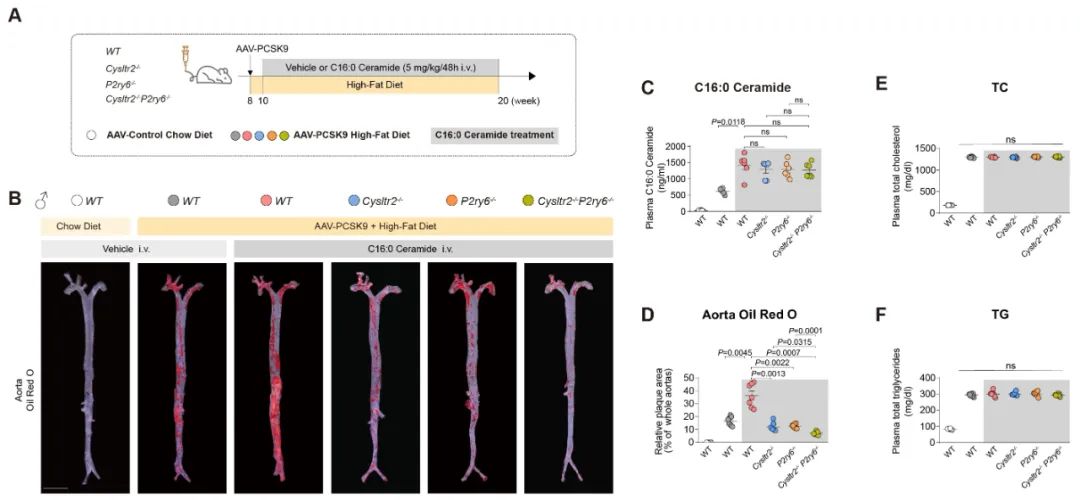
图2. 神经酰胺通过受体加重动脉粥样硬化
慢性肾病(CKD)会加速动脉粥样硬化进程[8]。为了探究神经酰胺在慢性肾病加重动脉粥样硬化中的作用,研究团队收集了284例不同肾功能分期的冠心病患者的血浆样本,发现随着肾功能的下降,神经酰胺的血浆浓度显著增加,神经酰胺的血浆水平与冠心病病变严重程度(Gensini评分)呈显著正相关。即使校正了血脂和其他心血管疾病传统危险因素(如高血压、糖尿病等),相关关系依然显著。这一发现提示长链神经酰胺可能是慢性肾病合并冠心病患者新的独立危险因素。
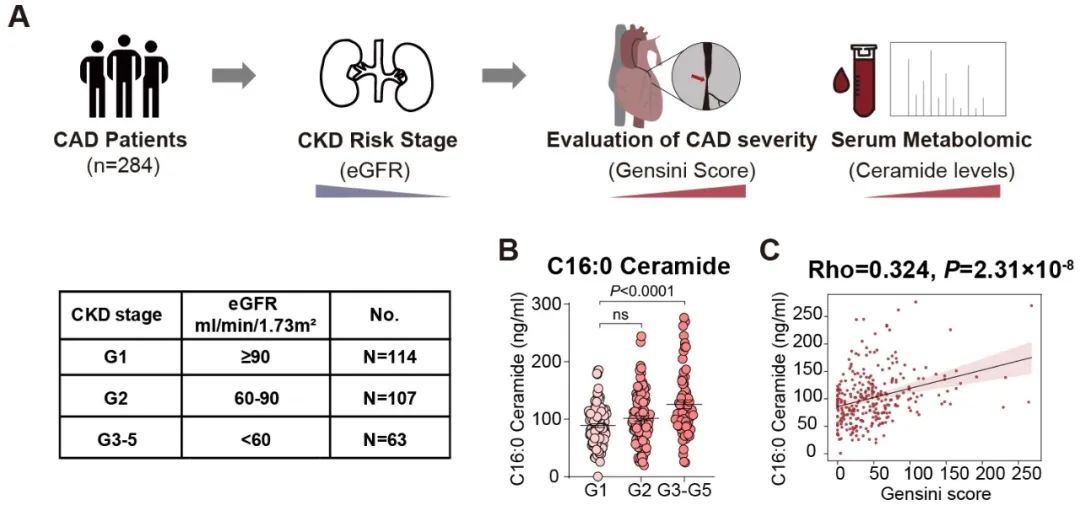
图3. 神经酰胺水平在慢性肾病者血浆中升高
不仅如此,研究团队构建了慢性肾病合并动脉粥样硬化的动物模型。与单纯动脉粥样硬化小鼠相比,慢性肾病合并动脉粥样硬化小鼠血浆神经酰胺水平明显升高。在Cysltr2-/-小鼠和P2ry6-/-小鼠中,或通过使用这两种受体的拮抗剂,在不影响血脂的情况下,均显著减轻慢性肾病加重的动脉粥样硬化。Cysltr2-/- P2ry6-/-双敲除小鼠或者联合使用受体拮抗剂进一步减轻动脉粥样硬化斑块。
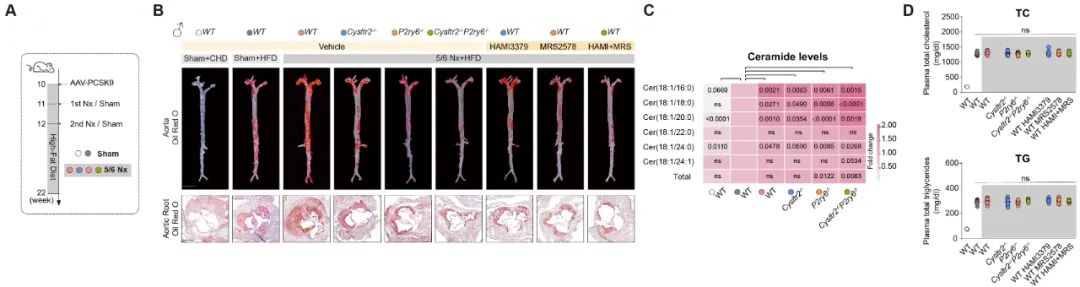
图4. 阻断神经酰胺受体减轻慢性肾病加重的斑块负荷
最后,研究团队解析了“神经酰胺C16:0-CYSLTR2-Gq”复合物的结构,为开发靶向受体的新型药物提供了精准模板。
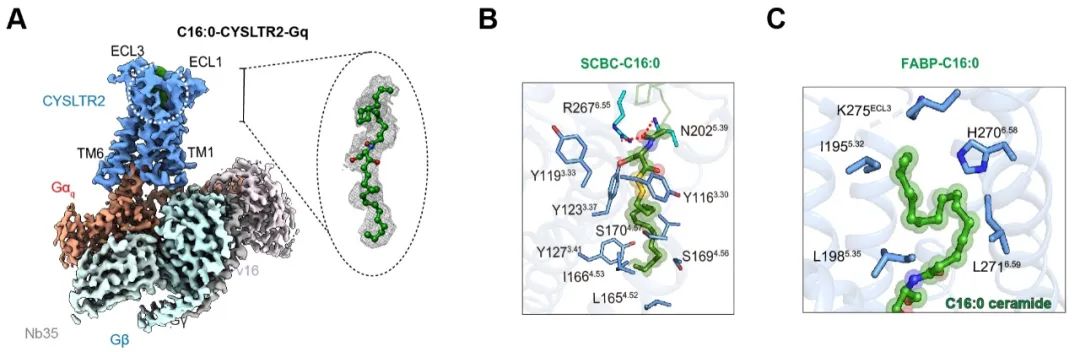
图5. 神经酰胺C16:0-CYSLTR2复合物结构示意图
综上所述,这项研究首次鉴定了神经酰胺的内源性受体CYSLTR2和P2RY6,揭示了神经酰胺通过受体激活炎症小体加重动脉粥样硬化和慢性肾病相关的动脉粥样硬化的分子机制。
目前,包括梅奥诊所和克利夫兰诊所在内的多家知名医疗机构已开始测定患者血浆神经酰胺来评估心血管疾病风险[9]。全球已有数十家药企启动神经酰胺相关靶点药物开发,大多针对神经酰胺的合成或降解酶。但值得注意的是,神经酰胺是细胞膜的重要组成成分,对维持细胞正常生理功能至关重要,靶向其代谢通路可能带来副作用。随着本研究的发表,针对CYSLTR2/P2RY6的小分子抑制剂或抗体药物研发有可能成为新的抗动脉粥样硬化策略。未来,通过检测血液神经酰胺谱与受体基因多态性,临床医生或可实现心血管风险的精准分层,为患者定制个性化治疗方案。
北京大学医学部基础医学院博士生张思婷、山东大学口腔医学院博士后林慧、北京大学医学部基础医学院博士后王佳乐、博士生芮婧钰,山东大学高等医学研究院博士生王腾威、北京大学医学部基础医学院博士后蔡泽宇以及山东大学高等医学研究院副研究员黄深明为本文的共同第一作者。北京大学医学部基础医学院为第一完成单位。
孔炜教授长期以来致力于血管微环境和重大心血管疾病的发病机制研究,揭示了血脂非依赖的动脉粥样硬化新靶点-基质水解酶ADAMTS-7,获得大规模人群研究验证,研发了基于ADAMTS-7的新型动脉粥样硬化疫苗,获得教育部自然科学一等奖和Circulation年度最佳基础/转化奖Joseph Loscalzo Award。应邀在心血管权威杂志上撰写血管基质微环境综述(Nature Review Cardiology, 2025),在European Heart Journal、Circulation、Cell Research等杂志发表文章150余篇。
孙金鹏教授长期致力于膜受体(GPCR等)对微环境的感知、配体发现、信号转导和功能多样性研究。提出了受体信号转导磷酸化编码的笛子模型,为受体功能多样性的机制提供了重要的理论基础;发现了多个受体的内源性配体,揭开了这些类固醇激素快速作用的膜受体疑云;阐明了受体对痒觉和力的感知机制,发现了多种有疾病治疗前景的GPCR人工配体。入选2023年中国十大科技进展,在Nature、Science、Cell等杂志发表文章90余篇。
姜长涛教授从事肠道菌群及其菌源酶与代谢性疾病的研究,形成“肠道菌源酶跨物种调控宿主稳态”新理论,提出“肠道菌源宿主同工酶”新概念,揭示菌源宿主同工酶在调节宿主代谢稳态、介导临床药物响应性方面的新功能;发现菌群与宿主互作的关键信使—胆汁酸的多种全新菌源修饰类型及生物合成通路,是代谢性疾病防治的新策略;揭示神经酰胺是器官间互作的关键介质,阐明多种菌源酶调节神经酰胺的新机制,并进一步揭示神经酰胺的直接作用受体。获2024、2023年度中国生命科学十大进展、2023年度中国高等学校十大科技进展等奖励,近五年在Science、Nature、Cell等期刊发表论文30余篇。
郑金刚主任长期从事冠心病的临床和基础研究,精通冠心病介入治疗, 擅长分叉病变的各项术式,在北京领先开展复杂高危冠心病的介入治疗。首次阐述了中国透析合并冠心病的治疗现状及预后影响因素,聚焦于肾衰患者脂质代谢紊乱特点和冠状动脉钙化的发生发展机制,在Circulation等杂志发表SCI文章50余篇,获批4项国际或国家发明专利。
参考文献:
[1]Björkegren JLM and Lusis AJ. Atherosclerosis: Recent developments. Cell. 2022, 185(10):1630-1645
[2]Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, Hegele RA, Krauss RM, Raal FJ, Schunkert H, Watts GF, Borén J, Fazio S, Horton JD, Masana L, Nicholls SJ, Nordestgaard BG, van de Sluis B, Taskinen MR, Tokgözoglu L, Landmesser U, Laufs U, Wiklund O, Stock JK, Chapman MJ and Catapano AL. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. European heart journal. 2017, 38(32):2459-2472
[3]van der Valk FM, Bekkering S, Kroon J, Yeang C, Van den Bossche J, van Buul JD, Ravandi A, Nederveen AJ, Verberne HJ, Scipione C, Nieuwdorp M, Joosten LA, Netea MG, Koschinsky ML, Witztum JL, Tsimikas S, Riksen NP and Stroes ES. Oxidized Phospholipids on Lipoprotein(a) Elicit Arterial Wall Inflammation and an Inflammatory Monocyte Response in Humans. Circulation. 2016, 134(8):611-624
[4]Laaksonen R, Ekroos K, Sysi-Aho M, Hilvo M, Vihervaara T, Kauhanen D, Suoniemi M, Hurme R, März W, Scharnagl H, Stojakovic T, Vlachopoulou E, Lokki ML, Nieminen MS, Klingenberg R, Matter CM, Hornemann T, Jüni P, Rodondi N, Räber L, Windecker S, Gencer B, Pedersen ER, Tell GS, Nygård O, Mach F, Sinisalo J and Lüscher TF. Plasma ceramides predict cardiovascular death in patients with stable coronary artery disease and acute coronary syndromes beyond LDL-cholesterol. European heart journal. 2016, 37(25):1967-1976
[5]Nwabuo CC, Duncan M, Xanthakis V, Peterson LR, Mitchell GF, McManus D, Cheng S and Vasan RS. Association of Circulating Ceramides With Cardiac Structure and Function in the Community: The Framingham Heart Study. Journal of the American Heart Association. 2019, 8(19):e013050
[6]Sharma BR and Kanneganti TD. NLRP3 inflammasome in cancer and metabolic diseases. Nature immunology. 2021, 22(5):550-559
[7]Orecchioni M, Kobiyama K, Winkels H, Ghosheh Y, McArdle S, Mikulski Z, Kiosses WB, Fan Z, Wen L, Jung Y, Roy P, Ali AJ, Miyamoto Y, Mangan M, Makings J, Wang Z, Denn A, Vallejo J, Owens M, Durant CP, Braumann S, Mader N, Li L, Matsunami H, Eckmann L, Latz E, Wang Z, Hazen SL and Ley K. Olfactory receptor 2 in vascular macrophages drives atherosclerosis by NLRP3-dependent IL-1 production. Science (New York, N.Y.). 2022, 375(6577):214-221
[8]Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, de Jong PE, Coresh J and Gansevoort RT. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet (London, England). 2010, 375(9731):2073-2081
[9]Leslie M. Straight from the heart. Science (New York, N.Y.). 2023, 379(6637):1080-1083
原文链接:
https://www.nature.com/articles/s41586-025-08792-8


