Int J Nanomedicine:载米诺环素的二氧化钛纳米颗粒用于增强协同牙周声动力化学疗法研究
时间:2025-03-17 12:12:26 热度:37.1℃ 作者:网络
牙周炎是一种具有破坏性的慢性炎症性疾病,最初由牙周病原体的定植以及微生物与宿主防御之间的失衡所引发。值得注意的是,流行病学研究的证据表明,牙周病与全身性疾病(如癌症、动脉粥样硬化、糖尿病、慢性支气管炎和类风湿关节炎)的发病风险增加相关。此外,牙周炎正成为一种日益严重的全球性流行病,患病率不断上升,这主要归因于其复杂的病因和颇具挑战性的治疗方法,使其成为全球范围内最常见的口腔疾病。它每年影响着数百万人,并已演变成一个重大的公共卫生问题。据报道,美国42%的成年人患有牙周炎,近7.8%的人存在严重的牙周问题。随着牙周炎的发展,它还会对支持牙齿的软硬组织造成损害,导致牙龈和牙周韧带的破坏,并进而发展为牙槽骨的吸收。最终,在最严重的情况下,牙周病可导致牙齿缺失,并严重降低日常生活质量。

牙周炎的病因是多方面的,但罪魁祸首仍是牙周组织的细菌定植。因此,主要的治疗策略通常集中在抑制细菌并抵消其有害影响上。在临床实践中,基础治疗主要基于机械性表面清创术,通过非手术方式刮除受感染的牙床来去除微生物菌斑。它可以在短期内对牙周炎提供令人满意的控制,但软组织和其他解剖学上难以触及的区域(如根分叉和牙根凹陷处)的病原体无法清除,因此它们不可避免地会再次侵入牙周组织。尽管牙周手术是另一种选择,但由于其带来的疼痛和高昂的费用,大多数患者难以接受。目前,化学疗法与机械治疗相结合以提高治疗效果。然而,应该注意的是,随着抗菌药物的广泛使用,出现了各种各样的问题,包括病原菌的多药耐药性、与抗生素相关的副作用以及具有挑战性的全身管理问题。
抗菌光动力疗法(aPDT)是一种新颖的方法,它利用特定波长的光来刺激光敏剂产生高毒性的活性氧(ROS),通过氧化损伤生物分子(如磷脂、酶、蛋白质和DNA)来杀死病原微生物,并已广泛用于对抗细菌感染。然而,它存在固有的缺陷,例如组织穿透深度低以及全身使用光敏剂后存在严重的光毒性。近年来,研究人员开发了抗菌声动力疗法(aSDT),作为一种源自抗菌光动力疗法的新型无创治疗方式。在这种疗法中,低强度超声与声敏剂相结合产生活性氧来杀死微生物,克服了抗菌光动力疗法中光穿透深度有限的问题。除了产生活性氧外,抗菌声动力疗法还通过空化作用促进机械清创。 抗菌声动力疗法中活性氧和机械空化作用的协同结合不仅会降低细胞膜电位,还会明显破坏细胞膜结构。值得注意的是,抗菌声动力疗法的高安全性、深穿透性和低成本使其成为一种很有前景的牙科抗菌治疗方法。然而,典型声敏剂的固有疏水性导致其在生理条件下分散性差、水溶性低,从而导致活性氧产生量低,目前这限制了其疗效。
近年来,用于药物递送的纳米颗粒的快速发展推动了医学领域的持续创新。金属氧化物纳米颗粒(MONPs)由于其抗菌、抗真菌和光催化活性以及生物安全性和生物相容性,在工业和生物医学领域有着广泛的应用。诸如二氧化钛(TiO₂)和钛酸钡(BTO)等无机纳米颗粒因其固有的声敏剂特性可直接使用。此外,这些无机声敏剂的纳米结构不仅为活性氧的产生提供了更多的成核位点,而且在声动力疗法的应用中表现出更好的稳定性。在此,我们开发了一个主要基于介孔二氧化钛纳米颗粒(MTN)的药物载体平台,介孔二氧化钛纳米颗粒是一种具有良好生物相容性和高稳定性的无机声敏剂。负载抗生素米诺环素(MINO)后,该装置表现出增强的抗菌性能。此外,包裹在纳米颗粒中减弱了米诺环素的药物毒性,有效地减少了对牙周细胞的损伤。值得注意的是,声敏剂在声动力疗法过程中产生活性氧的过程需要氧气的参与。 值得一提的是,在牙周病的情况下,牙周袋中的大气氧含量不到2%,这极大地影响了声动力疗法的抗菌效果。为了解决牙周组织的缺氧状况,血红蛋白(Hb)通过酰化反应结合到纳米颗粒的表面,从而提供额外的氧气,以提高声动力疗法中超声能量的利用效率。基于这种方法,开发了Hb-MTN/MINO纳米颗粒药物递送系统,通过产生的活性氧和负载的米诺环素实现联合抗菌效果,如方案1所示。
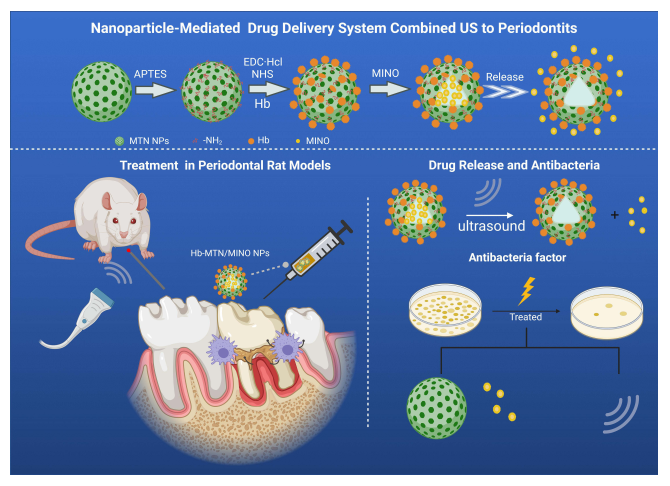
Hb MTN/MINO NP的制备过程示意图(上图)和声动力化疗协同模式的拟议抗菌机制(下图)。
方法与结果:为了解决这些问题,我们通过溶胶-凝胶法成功合成了介孔二氧化钛纳米颗粒(MTN),并用血红蛋白(Hb)对其进行修饰并负载米诺环素(MINO)。所得的Hb-MTN/MINO纳米颗粒粒径为215纳米,ζ电位为−19.8 mV±0.9 mV,形状均匀,多分散指数(PDI)为0.176。血红蛋白(Hb)的修饰为抗菌声动力疗法(aSDT)提供了充足的氧气,有助于在低超声强度下提高活性氧(ROS)的产生。负载米诺环素后,该系统表现出显著的抗菌效果,与对照组相比,细菌数量减少了6个对数级。在牙周病模型大鼠中,从口腔指数、软硬组织方面对Hb-MTN/MINO进行了体内评估,并进行了生物安全性评估。Hb-MTN/MINO显示出令人满意的治疗效果,大鼠的牙周状况比对照组有了更大的改善,并且对血清中炎症因子水平的检测显示,白细胞介素-6(IL-6)和基质金属蛋白酶-9(MMP-9)均显著下调。

(A) 合成MTN-NP的TEM图像;(B) MTN、NH2-MTN、Hb MTN和Hb MTN/MINO的Zeta电位。(C) Hb MTN/MINO的粒径分布和TEM图像。(D) EDS元素图谱图像Hb MTN/MINO NP。
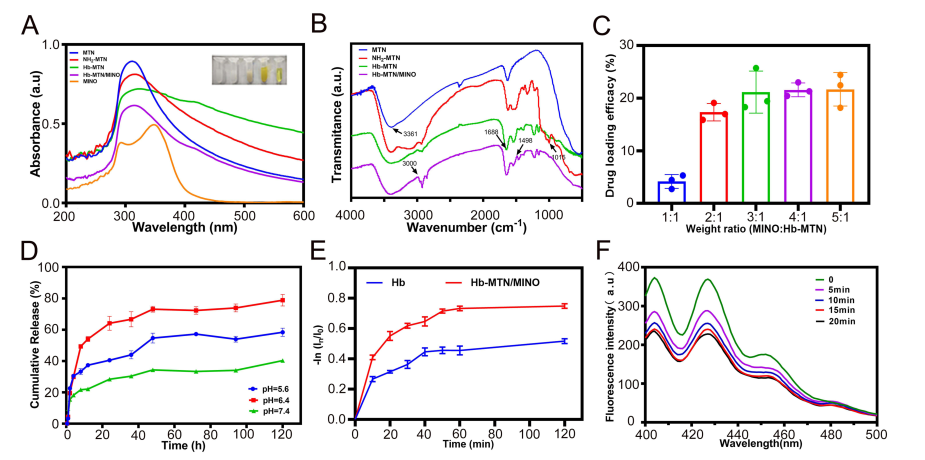
(A) MTN、NH2-MTN、Hb MTN和Hb MTN/MINO的FT-IR光谱。(B) MTN、NH2-MTN、Hb MTN、Hb-MTN/MINO和MINO的紫外-可见光谱。(C) MINO与Hb MTN在不同重量比下的载药效率。(D)Hb MTN/MINO在不同pH值下的体外释药行为;(E) 体外释氧。(F) ABDA与相同浓度的Hb MTN/MINO共孵育不同时间间隔后的荧光光谱。

(A) MINO和Hb MTN/MINO在L929细胞中的细胞毒性;(B) 用MINO和Hb MTN/MINO处理的L929细胞的活/死染色图像。不同处理对悬浮菌的抗菌活性。(C)CFU计数结果。(D) 印版图像。(E) MTT评估对细菌生长的影响。**p<0.01。列内不同字母后的平均值存在显著差异(p<0.05)。
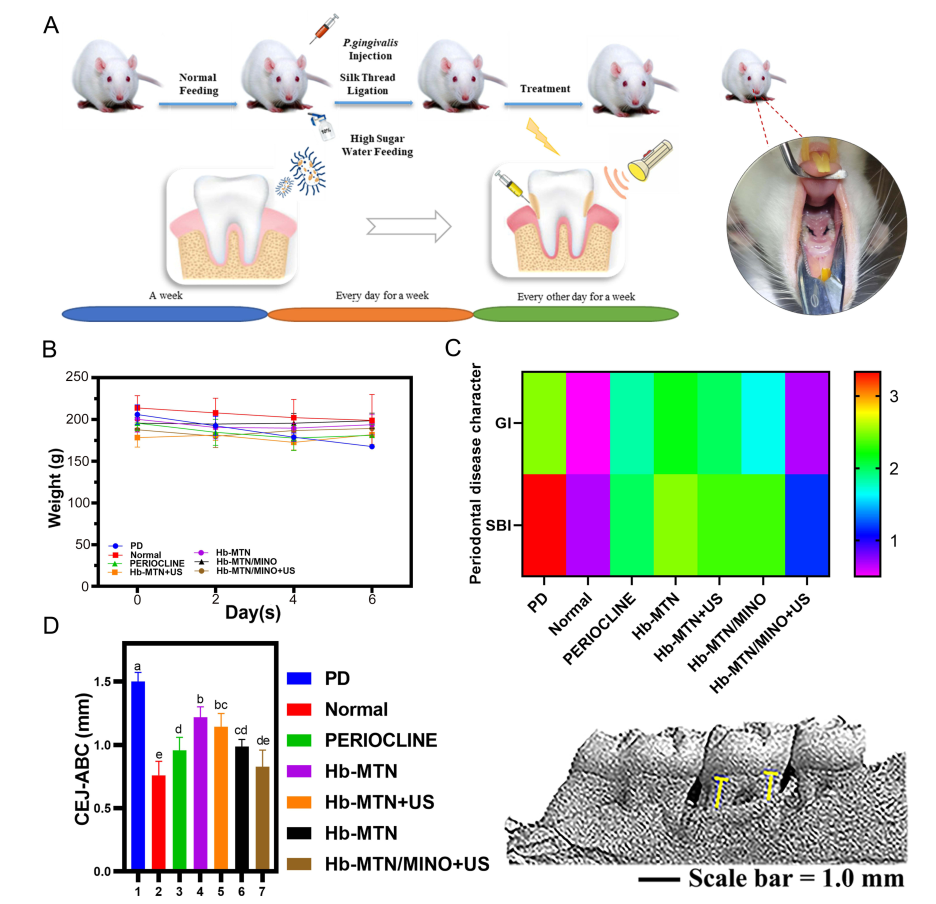
(A) 大鼠上颌第二磨牙牙周炎建模程序。(B) 实验治疗期间大鼠的体重变化。(C) 口腔状况检查(GI和SBI)。(D) CEJ-ABC的距离和微CT图像的三维重建。列内不同字母后的平均值存在显著差异(p<0.05)。

(A) 大鼠第二磨牙牙周组织的H&E染色。(B) 治疗后大鼠的血液生化指标(ALT、AST、TP、AKP、BUN、ALB、CRE)。(C) 治疗后主要器官的H&E染色图像。


