Circ Res 深圳市人民医院郑奇军团队与合作者揭示高表达ACKR1的内皮细胞通过调节巨噬细胞行为促进主动脉夹层进展的新机制
时间:2024-12-22 23:00:16 热度:37.1℃ 作者:网络
A型主动脉夹层(Type A aortic disp, TAAD)是一种严重的心血管疾病,具有复杂的发病机制。当前关于TAAD的研究揭示,其病理发展与主动脉壁的退化性变化及炎症反应等多种复杂生物过程相关。近几年,巨噬细胞的极化和浸润在TAAD中的作用受到广泛的关注,然而其中涉及的具体分子机制仍不完全明了,限制了TAAD高效治疗策略的发展。
2024年12月18日,深圳市人民医院(暨南大学第二临床医学院)郑奇军主任和邹畅教授团队联合复旦大学附属中山医院任骏教授团队在TAAD发病机制领域取得了重要进展,并在美国心脏协会(AHA)主办的国际权威期刊Circulation Research发表了题为“ACKR1hiECs Promote Aortic Disp Through Adjusting Macrophage Behavior”的研究论文,首次揭示了高表达ACKR1 (atypical chemokine receptor 1)的内皮细胞(ACKR1hiECs)通过调节巨噬细胞的迁移和极化促进TAAD进展的新机制。

该研究首先基于单细胞转录组测序技术(scRNA-seq)深入揭示了TAAD的细胞异质性。研究发现,与对照组样本相比,TAAD样本中内皮细胞和白细胞比例显著增加,这些细胞比例的变化表明这两种细胞可能在TAAD发病机制中发挥关键作用。对白细胞进行重聚类和亚群分析发现,巨噬细胞的浸润在TAAD样本中明显增加,特别是IL-1β阳性巨噬细胞亚群(IL1B+Mac)。临床TAAD患者的主动脉组织中也表现出该亚群显著增多。基因功能分析进一步揭示了该亚群与炎症反应密切相关。
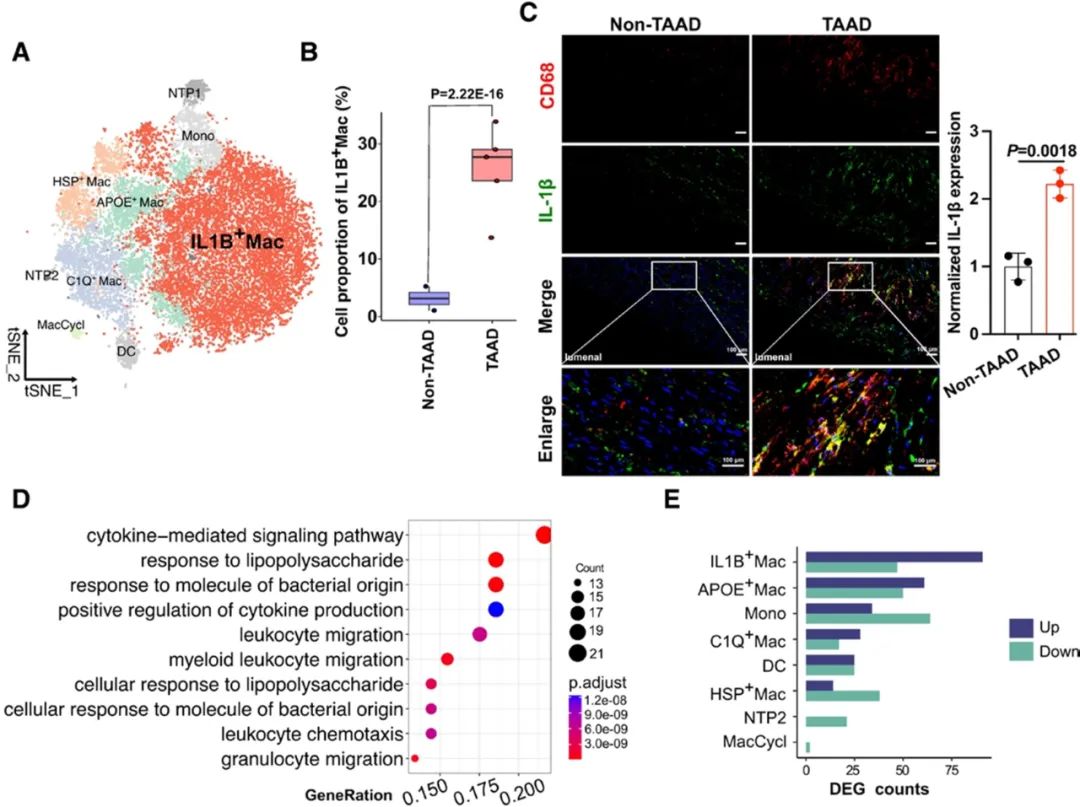
对内皮细胞亚群的进一步分析发现,与对照组样本相比,TAAD样本中ACKR1的表达水平显著增高,且高表达ACKR1的内皮细胞亚群(ACKR1hiECs)在夹层样本中明显增多。临床TAAD样本和TAAD动物模型的主动脉组织及血清均表现出ACKR1表达水平显著增强。ACKR1作为非典型性趋化因子受体蛋白,具有与多种趋化因子结合的独特能力,促进它们的清除或穿胞作用。基因功能分析揭示了ACKR1hiECs对于白细胞跨越血管壁的迁移至关重要,强调了ACKR1在炎症反应中的作用。
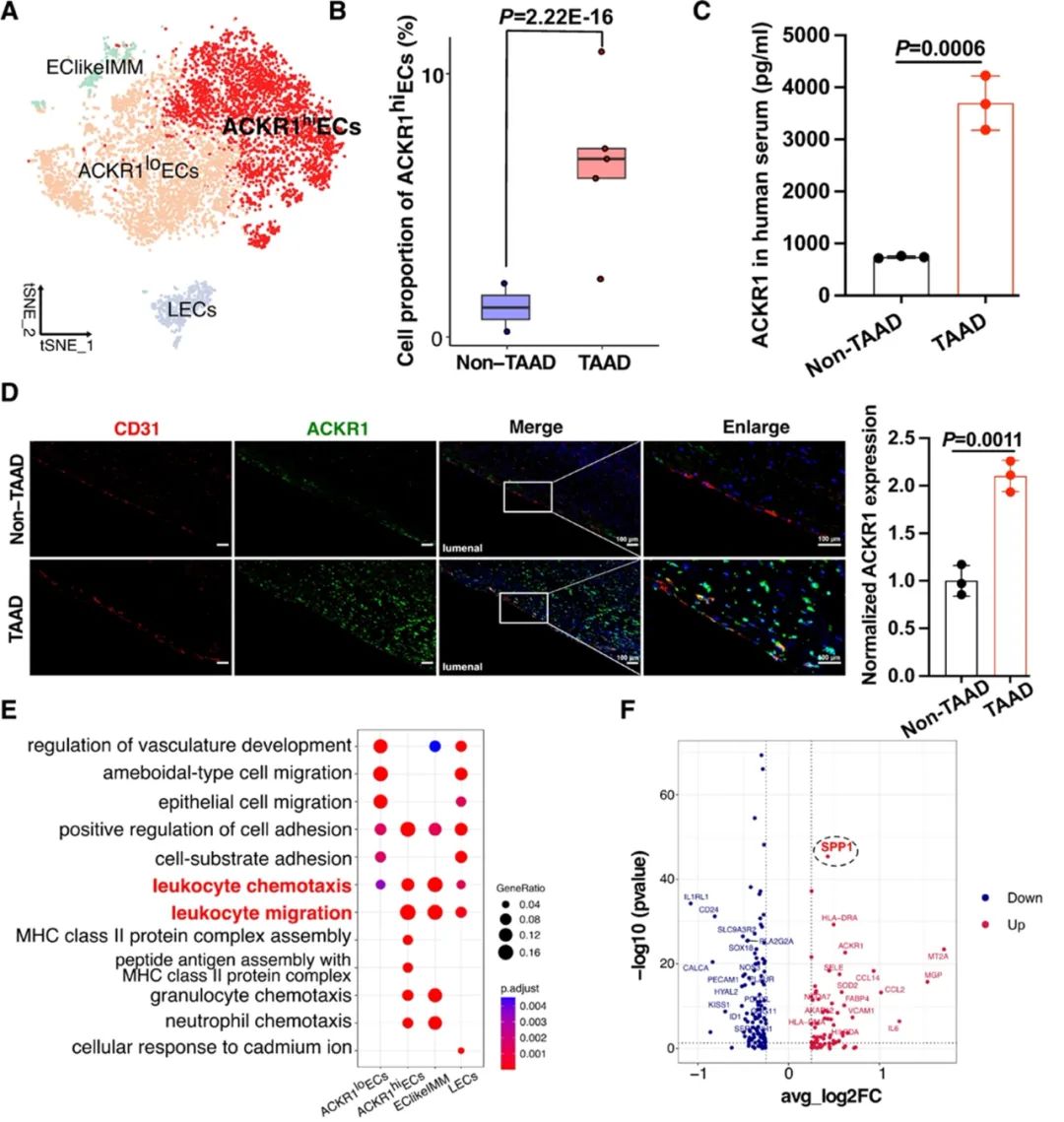
随后,研究者通过细胞通讯分析发现ACKR1hiECs与IL1B+Mac亚群在TAAD的细胞通讯网络中显示出强烈的信号,且两者之间相互作用显著,表明它们在TAAD的病理过程中具有重要的作用。为了进一步探究内皮细胞与巨噬细胞的互作情况,研究者构建了内皮细胞与巨噬细胞的共培养系统,并对内皮细胞中ACKR1的表达进行了调控。细胞迁移和流式细胞术等实验结果表明,ACKR1过表达显著增强巨噬细胞的迁移能力并促进其炎性极化。
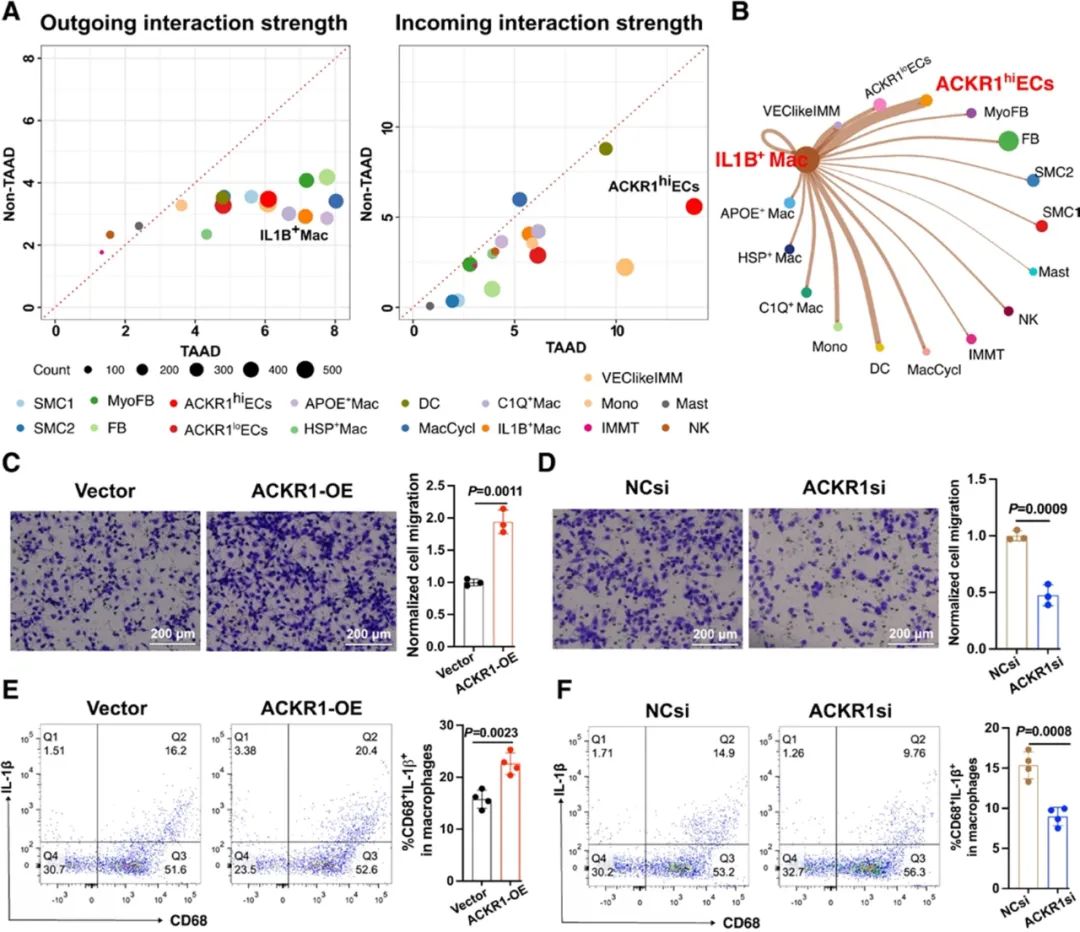
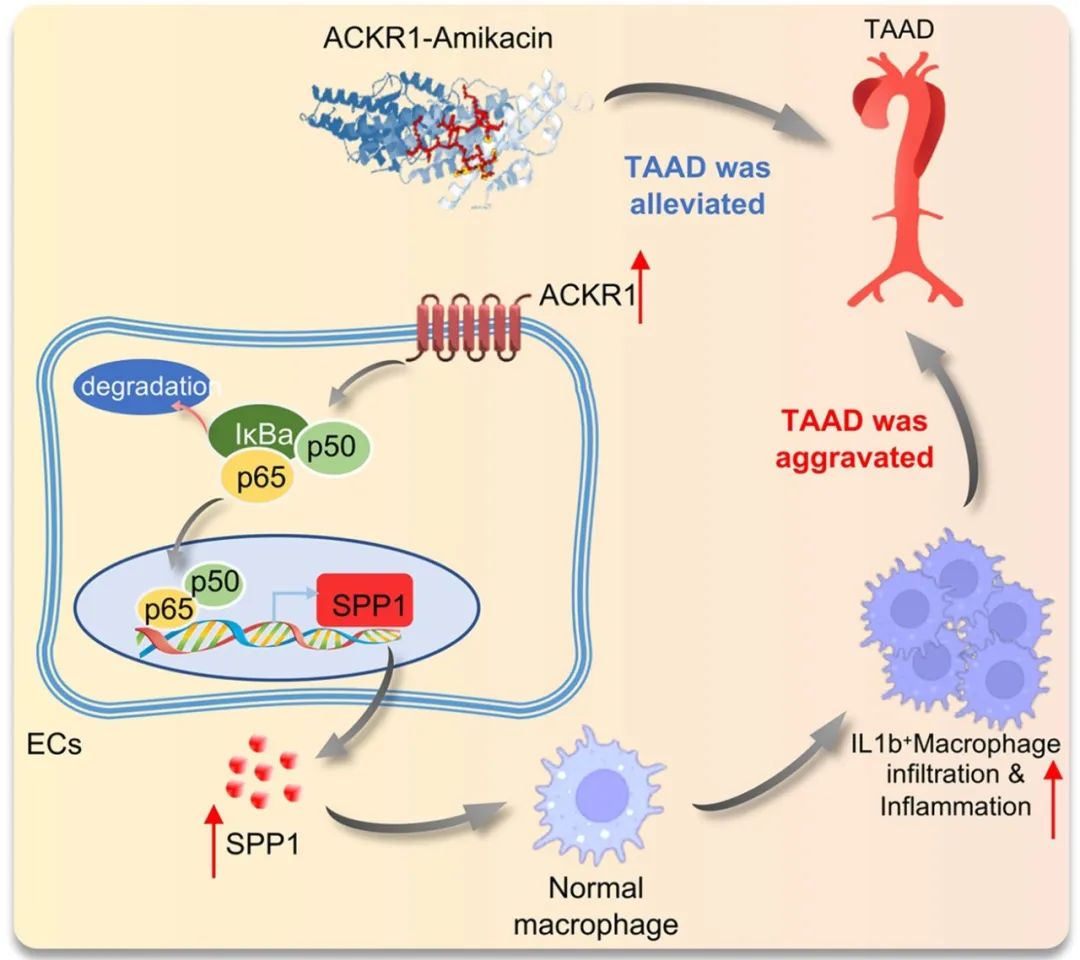
研究者发现,分泌型磷蛋白1 (Secreted phosphoprotein 1, SPP1)在TAAD中表达显著增加,尤其是在ACKR1hiECs中。同时,临床TAAD样本和TAAD动物模型中也观察到了血清SPP1水平的升高。调节内皮细胞中ACKR1的表达发现,ACKR1的过表达显著增加了SPP1的mRNA表达和分泌水平,而其敲低则导致相反的效果。既往研究表明SPP1在免疫调节和组织重塑中具有重要作用,其表达升高可能促进心血管疾病中巨噬细胞的粘附和迁移。因此,研究者假设ACKR1可能通过调控SPP1水平来调节巨噬细胞行为。随后,研究者通过一系列实验验证了这一假设,证明了ACKR1通过调控SPP1的表达水平来影响巨噬细胞的迁移和极化。为了探究ACKR1如何调控SPP1的表达水平,研究者使用JASPAR数据库进行了相互作用网络分析,并结合前文的基因功能富集分析结果,确定了NF-κB信号通路在介导ACKR1对SPP1表达的影响中起着核心作用。随后,研究者进行了一系列的分子生物学实验,明确了ACKR1hiECs通过ACKR1/NF-κB/SPP1信号通路调节巨噬细胞的迁移和促炎极化。
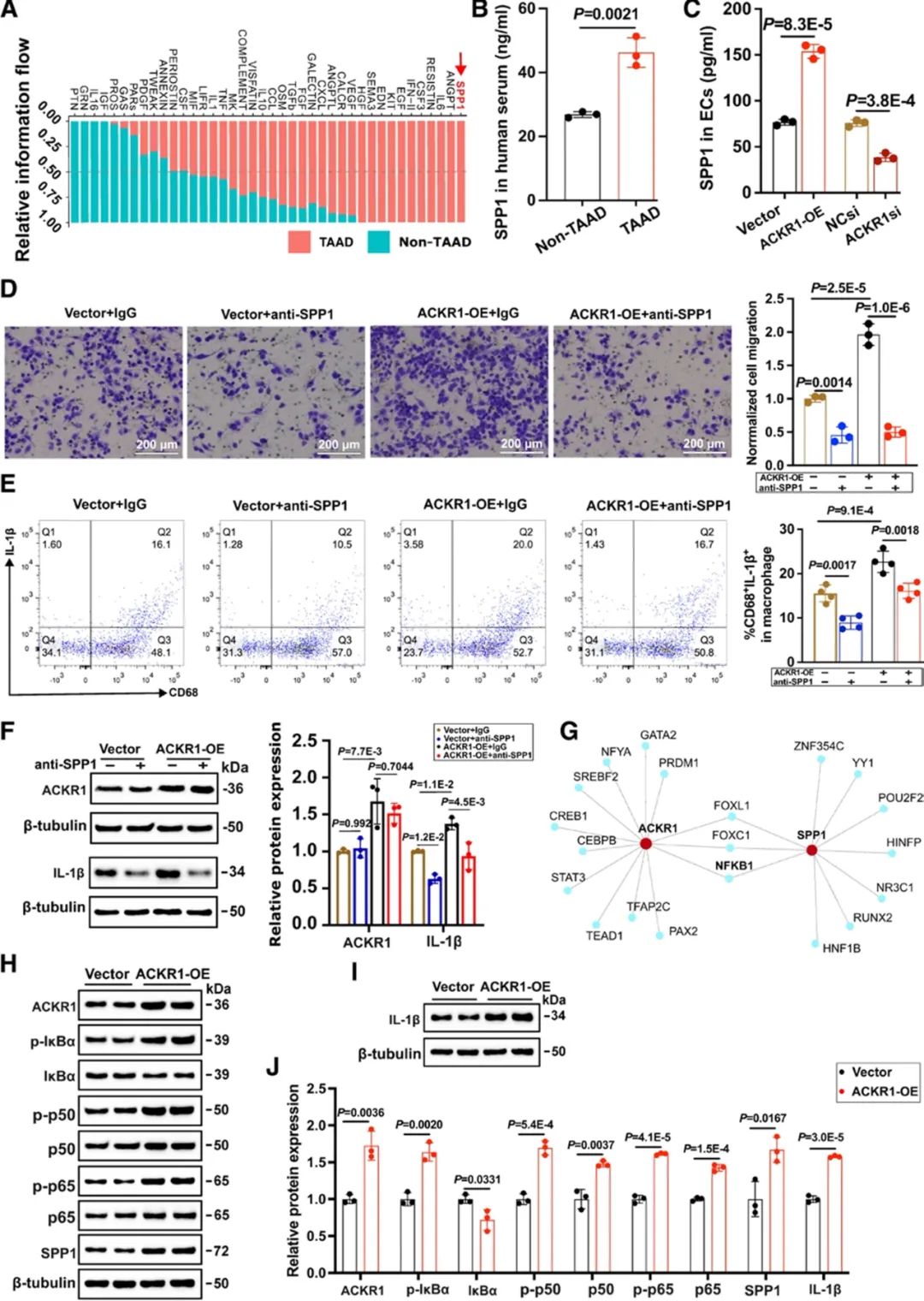
接下来,研究者通过β-氨基丙腈(BAPN)诱导构建TAAD小鼠模型,并使用腺相关病毒(rAAV9-ICAM2-shACKR1)在小鼠内皮细胞中特异性敲低ACKR1,发现该干预可显著降低巨噬细胞的浸润,进而降低了TAAD的发生率及严重程度。此外,体内干预SPP1也能显著减轻小鼠TAAD的严重程度。这些结果进一步支持ACKR1hiECs通过ACKR1/NF-κB/SPP1信号通路调节巨噬细胞的迁移和促炎极化,从而促进TAAD进展的发病机制。
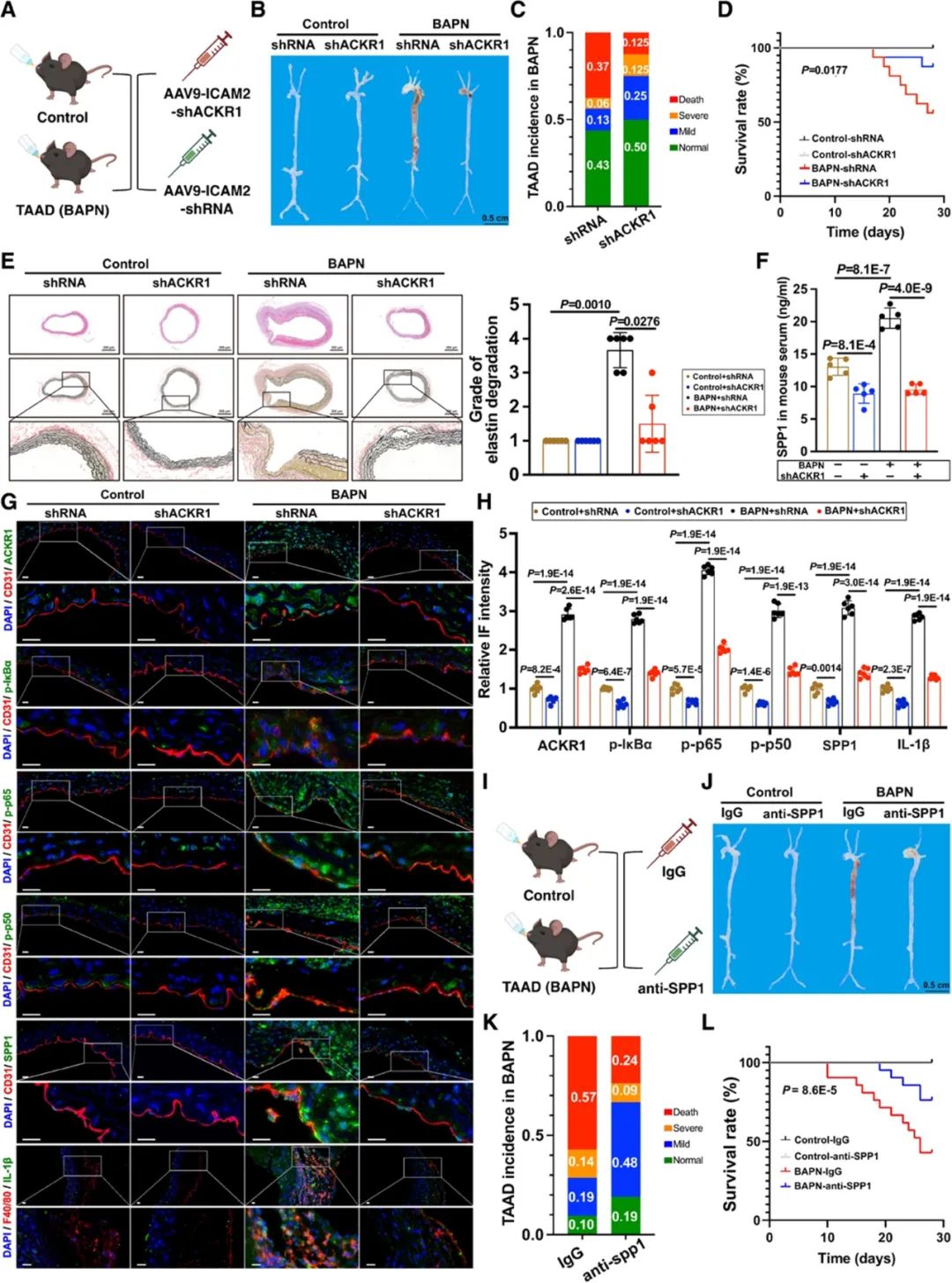
最后,研究者通过AutoDock进行分子对接和综合评估,筛选出阿米卡星作为ACKR1的靶向小分子药物,并使用表面等离子体共振技术(Surface plasmon resonance, SPR)确定了ACKR1与阿米卡星之间的结合力。随后,研究者进行了一系列体外和体内实验,验证了阿米卡星通过调节ACKR1介导的信号传导途径,有效减少了巨噬细胞的浸润和促炎极化,在TAAD的形成和恶化过程中起到关键作用,从而显著降低了TAAD的发生率和严重程度。
综上所述,本研究在单细胞水平上揭示了TAAD的细胞异质性,强调了高表达ACKR1的内皮细胞和促炎巨噬细胞亚群是TAAD疾病进展的关键驱动因素。通过一系列体内外实验,本研究发现了一种新的分子机制,即ACKR1hiECs通过ACKR1/NF-κB/SPP1信号通路调节巨噬细胞迁移和促炎极化,从而促进TAAD的发生与发展。此外,通过功能和药理学方法靶向ACKR1可有效抑制TAAD进展并延长TAAD小鼠的生存期,为临床评估提供了有希望的新型干预策略。
深圳市人民医院(暨南大学第二临床医学院)心脏大血管外科王雅瑜博士后、贾雄博士后和在读博士生张一飞为该论文的共同第一作者;深圳市人民医院(暨南大学第二临床医学院)心脏大血管外科郑奇军教授、临床研究中心邹畅教授和复旦大学附属中山医院心内科任骏教授为论文的共同通讯作者。
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.325458


