Nature Genetics:基因组不稳定性驱动的克隆异质性:破解复杂核型急性髓系白血病(CK-AML)治疗难题的关键
时间:2024-11-27 14:00:26 热度:37.1℃ 作者:网络
引言
急性髓系白血病(Acute Myeloid Leukemia, AML)是一种严重威胁生命的血液系统恶性肿瘤,尤其是复杂核型急性髓系白血病(Complex Karyotype AML, CK-AML)更是众多亚型中预后较差的一种。CK-AML的患者通常面临着复杂的染色体重排和明显的基因组不稳定性,这使得他们对传统治疗方法的反应不佳,生存率低。面对如此严峻的挑战,研究人员正在探索更深层次的细胞和基因组层面的机制,以寻找突破性的治疗策略。11月25日Nature Genetics 的研究报道“Single-cell multiomics analysis reveals dynamic clonal evolution and targetable phenotypes in acute myeloid leukemia with complex karyotype”,通过创新的单细胞多组学技术,从单细胞水平解析了CK-AML的克隆演化过程,并识别出了可以被靶向的治疗窗口。该研究不仅提供了关于肿瘤细胞演化和生存机制的全新视角,还为开发新的、更加精准的靶向治疗手段铺平了道路。通过理解每个克隆的特异性基因表达和染色体结构变化,研究人员希望能够找到克服治疗耐药性和降低复发风险的新方法。

急性髓系白血病(Acute Myeloid Leukemia, AML)是一种侵袭性血液恶性肿瘤,其中复杂核型(Complex Karyotype, CK-AML)约占所有AML病例的10-12%,是预后较差的亚型之一。CK-AML的显著特征是其复杂的染色体异常(通常有三种或以上),导致高度的基因组不稳定性(Genomic Instability),从而引发了显著的肿瘤内部异质性(Intratumoral Heterogeneity, ITH)。这种异质性使得标准治疗对该亚型的疗效显著降低,导致预后极差。
在该研究中,研究人员对CK-AML患者中的染色体异常进行了详尽的量化分析,结果显示,每个单细胞的平均染色体变异数量为18.9(标准差2.9),包括间质结构变异(Interstitial Structural Variants)、端粒增益和丢失(Terminal Gains and Losses)、整条染色体非整倍性(Aneuploidies)、平衡结构变异(Balanced Structural Variants)以及复杂的染色体重排。在患者CK282中,单细胞的染色体变异负担最高,平均每个细胞具有50.3个结构变异(标准差9.3),这突显了其基因组极度的不稳定性。
为了深入探讨这些复杂染色体重排在克隆异质性中的作用,该研究利用了单细胞多组学(Single-cell Multiomics)技术,以在单细胞分辨率下解析CK-AML中的克隆演化模式及其与基因表达的关系,从而为改善该亚型的治疗策略提供新的见解。
研究采用了一种全面的单细胞多组学框架,将单细胞核小体占据测序( single-cell nucleosome occupancy and genetic variation analysis,scNOVA)与细胞索引转录组和表位测序(CITE-seq)相结合,全面获得单细胞的基因组、转录组及表型数据。具体方法包括:
单细胞核小体占据测序(scNOVA):利用Strand-seq技术测定每个单细胞的染色体结构变异(Structural Variant, SV)。这种技术能够精确捕捉染色体重排,同时通过核小体占据(Nucleosome Occupancy)分析揭示基因组的开放区域,反映基因调控状态的变化。
CITE-seq:CITE-seq结合了单细胞转录组测序与细胞表面蛋白的定量分析,使研究人员能够从基因型和表型的角度全面了解每个细胞,揭示克隆特异性基因表达与表面分子特征的关联。
该研究分析了来自8名CK-AML患者的初诊样本和救治样本,收集了542个细胞的Strand-seq数据和35,577个细胞的CITE-seq数据。此外,研究人员还使用了5个患者来源的异种移植模型(Patient-Derived Xenografts, PDX)和2个复发或难治性样本进行进一步验证。
为了确保数据的准确性和全面性,研究人员还使用了基因组光学图谱(Optical Genome Mapping, OGM)与全基因组测序(Whole Genome Sequencing, WGS)来验证染色体变异分析结果。通过这些多技术手段的结合,得以更深入地解析染色体重排对CK-AML克隆演化的影响及其潜在的功能性后果。
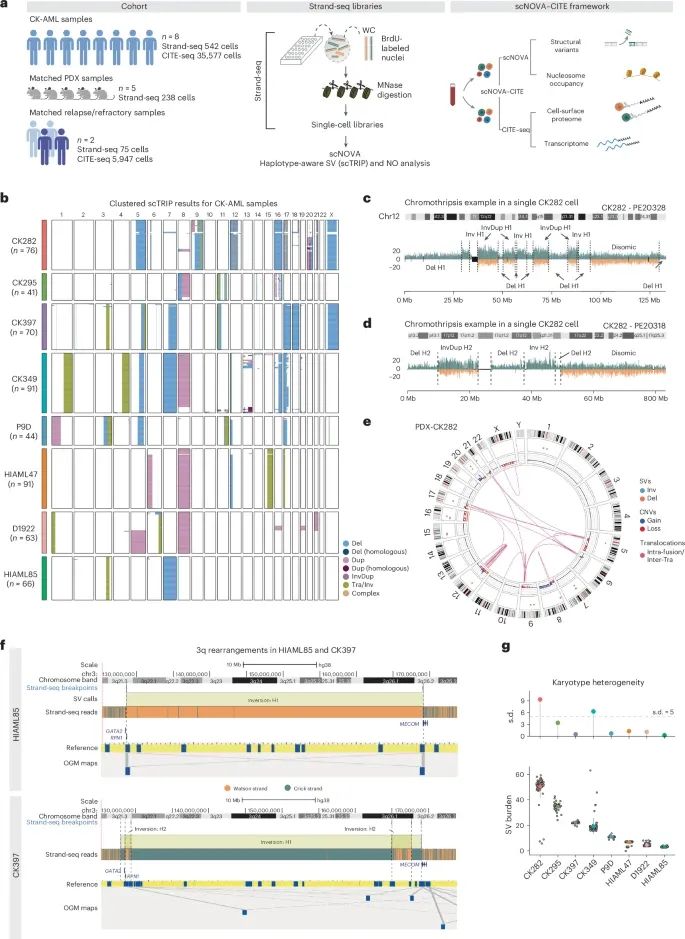
CK-AML中复杂染色体重排的多样性和由此引起的克隆异质性(Credit: Nature Genetics)
a.单细胞多组学分析的研究设计,采用了scNOVA和CITE-seq技术,对来自8名CK-AML患者的初始样本、5个匹配的患者来源异种移植模型(PDX)以及2个匹配的复发或难治性样本进行了分析。scNOVA用于评估结构变异(SV)景观和核小体占据(NO),而CITE-seq用于评估转录组和细胞表面蛋白组。
b.542个单细胞的核型热图,使用Ward方法对8名患者的初始样本中的结构变异基因型进行层次聚类。
c, d.CK282患者的一个代表性单细胞的特定染色体12和染色体17的链特异性读取深度,显示了克隆染色体碎裂(chromothripsis)引起的成簇的缺失、倒置重复和倒位。
e.Circos图评估的CK282患者PDX中的多个染色体之间的复杂重排和易位。图中显示了结构变异、拷贝数变化和易位。
f.HIAML85和CK397患者中Strand-seq和OGM对片段进行映射,显示了跨长臂的倒位情况。
g.8个CK-AML患者样本中的核型异质性,基于结构变异负担单个细胞,不同样本中的异质性情况通过结构变异负担进行量化。
染色体重排的复杂性与克隆异质性
CK-AML中的染色体重排极为复杂,包括线性和环状的断裂-融合-桥(Breakage-Fusion-Bridge, BFB)循环,以及染色体碎裂(Chromothripsis)等事件。例如,在患者CK282中,染色体12和17存在多个缺失和倒位,这些重排通过多重荧光原位杂交(M-FISH)和超长DNA分子光学基因组图谱(OGM)技术得以证实。
染色体碎裂现象尤为显著,研究表明,这些复杂的重排与癌基因的激活和抑癌基因的失活密切相关。例如,在CK397患者中,染色体碎裂导致MECOM基因的过表达,而这与细胞周期的紊乱密切相关。这表明染色体重排不仅是基因组结构的变化,更会深刻影响细胞的基因表达和功能状态,进而推动克隆演化。
在这些复杂染色体重排的基础上,研究人员识别了三种主要的克隆演化模式:单克隆(Monoclonal)、线性克隆(Linear)和分支多克隆(Branched Polyclonal)。在8个患者样本中,有6个样本表现出线性或分支的多克隆演化模式,其中75%的样本中存在多个亚克隆(Subclones)。例如,在CK397患者中,存在两个主要亚克隆的平行演化轨迹,每个亚克隆均表现出不同的染色体结构变异特征,反映了在不同环境压力下的独立演化适应。
通过对单细胞数据的聚类分析,研究人员发现具有不同染色体重排模式的亚克隆在基因表达特征上存在显著差异。例如,CK349患者中,BCL2L1和MCL1基因在高变异负担的亚克隆中显著上调,这些基因与抗凋亡机制密切相关。这意味着这些亚克隆可能通过增强抗凋亡信号来逃避药物诱导的细胞死亡,从而在治疗过程中获得生长优势。

复杂核型急性髓系白血病(CK-AML)中克隆动态模式和持续不稳定性(Credit: Nature Genetics)
亚克隆生长模式(a):初诊时,患者中观察到的亚克隆生长模式存在差异,展示了CK-AML的异质性生长特征。
克隆树(b, c):手动构建了单克隆和线性生长模式的克隆树。每个彩色圆圈代表遗传上相似的亚克隆,圆圈的大小与克隆种群的大小成比例,显示了体内不同亚克隆的层次结构及其在采样时的占比。
染色体特定读取深度(d):来自HIAML47患者的三种代表性单细胞的6号、8号和12号染色体的链特异性读取深度,箭头标记了对应的亚克隆,揭示了染色体特定变异与克隆演化的关系。
分支多克隆生长模式(e):手动构建的克隆树及其对应的染色体异质性,基于结构变异负担(底部)及其标准差(顶部)进行比较。这些结果表明,分支多克隆生长模式下存在多个亚克隆,每个亚克隆在染色体复杂度上存在差异。
克隆不稳定性和不同扩增状态(f):CK349中四个代表性单细胞的链特异性读取深度,表明不同的DNA扩增状态。
克隆扩增的演化模型(g):CK349中的地震式扩增演化模型,这些复杂结构变异最近在实体瘤中被描述,进一步证实了CK-AML中的遗传不稳定性。
染色体11的环状染色体(h):通过双色FISH(荧光原位杂交)分析CK349的PDX样本,使用部分染色体探针标记了染色体11的不同区域,显示了环状染色体的存在,进一步证明了基因组不稳定性和克隆异质性的形成过程。
克隆演化的动态与药物敏感性
通过PDX模型分析,研究人员发现不同的亚克隆在异种移植环境中的生长能力存在显著差异。例如,CK349患者的次要亚克隆(SC3)在PDX中的增殖能力显著增强,其细胞比例在移植后的四周内从初始的5%增加至超过40%。这一现象显示出,在某些环境中,次要克隆可能获得生长优势并成为导致疾病复发的主要因素。
体外药物敏感性测试进一步揭示了不同亚克隆对靶向药物的差异反应。CK282患者的白血病干细胞(Leukemic Stem Cells, LSC)对BCL-xL抑制剂表现出显著的敏感性,其细胞活力降低了68%(p<0.01),尤其是在具有高染色体变异负担的亚克隆中,效果更加显著。这些数据表明,BCL-xL抑制剂在复杂核型AML中具有作为靶向治疗药物的潜力,特别是对于具有复杂染色体重排的亚克隆。
此外,研究人员通过药物组合实验探索了联合靶向治疗的可能性。研究发现,BCL-xL抑制剂与MEK抑制剂联用能够在不同的克隆亚型中显著增加细胞死亡率(p<0.01),这表明多靶点干预可能是克服CK-AML异质性导致的治疗失败的有效策略。这种组合策略可能有效针对不同克隆亚型,减少耐药性并改善治疗效果。
染色质结构与基因表达的联系
在CK397患者中,3q染色体重排导致了RPN1-MECOM融合基因的形成。单细胞转录组分析显示,该融合基因在特定亚克隆中的表达量显著高于其他亚克隆(p<0.05),并且与OXPHOS(氧化磷酸化)相关基因的高表达相关。这一现象表明,染色体重排可以通过影响染色质开放性来直接激活癌基因,进而改变细胞的代谢特征。
此外,通过整合CITE-seq和scNOVA数据,研究人员发现CD34和GPR56在高染色体变异负担的亚克隆中显著上调。这些克隆表现出更强的增殖能力和对化疗的耐受性。这些发现揭示了不同亚克隆在基因表达和功能特性上的显著异质性,这种异质性直接影响了患者的临床预后。
为了更全面地理解染色质结构的改变,研究人员采用了ATAC-seq(Assay for Transposase-Accessible Chromatin using sequencing)技术来评估不同亚克隆的染色质开放性。结果表明,具有高变异负担的亚克隆通常具有较高的染色质开放性,特别是在与增殖和抗凋亡相关的基因启动子区域。进一步分析显示,这些开放的染色质区域与增强子激活密切相关,可能促进癌基因的持续表达和肿瘤的侵袭性特征。
克隆异质性与治疗耐药性
CK-AML的高度克隆异质性是其治疗困难的重要原因之一。该研究表明,CK-AML患者体内同时存在多个基因组特征各异的亚克隆,这些亚克隆在治疗过程中相互竞争并不断演化以应对药物压力,显著降低了治疗效果。例如,PDX模型显示,不同亚克隆在化疗后表现出显著不同的生存能力,其中CK349的次要亚克隆表现出对阿糖胞苷的耐受性,从而增加了治疗的复杂性。
研究数据表明,克隆异质性通过染色体重排和基因表达调控机制影响亚克隆对治疗的敏感性。具有高变异负担的亚克隆表现出更强的抗凋亡信号和更高的增殖速率,使得标准化疗在清除这些克隆方面显得力不从心。为了克服这一问题,靶向抗凋亡信号通路成为一种前景广阔的策略,在药物敏感性分析中得到了初步验证。
靶向治疗的新可能性
该研究的关键发现之一是通过单细胞多组学分析揭示了针对特定亚克隆的靶向治疗策略。BCL-xL抑制剂在CK282患者中表现出对特定亚克隆的显著有效性,尤其是对具有高变异负担的亚克隆,其治疗后亚克隆比例显著下降。此外,通过分析细胞表面蛋白,研究人员发现CD34和GPR56可作为不同亚克隆的潜在靶向标记,这些标记物与特定克隆的药物敏感性密切相关。这些发现为开发精准靶向治疗手段奠定了理论基础。
进一步的研究还表明,联合靶向治疗可能是应对CK-AML克隆异质性的有效手段。例如,BCL-xL抑制剂与PI3K抑制剂联合应用在体外和PDX模型中均表现出显著的协同效果(p<0.001),这种组合治疗能够有效抑制多种克隆亚型的增殖并减少耐药性。考虑到克隆间异质性,采用联合靶向治疗策略可能显著提高治疗效果并延缓疾病复发。
单细胞多组学技术的应用前景
该研究依赖于单细胞多组学技术的进展,这些技术使研究人员能够在单细胞水平解析基因组、转录组和蛋白质组之间的复杂关系,深入理解不同克隆的演化路径和功能特性。通过对CK397患者不同亚克隆的分析,研究人员揭示了染色体重排如何改变染色质结构,进而影响基因表达和细胞功能。
未来,随着单细胞测序技术和数据分析工具的进一步发展,研究人员有望更精确地描绘AML克隆演化的动态过程。例如,实时监测患者不同克隆的演化状态和药物反应可能为个性化治疗提供新的契机。此外,多组学数据的整合将帮助研究人员识别新的治疗靶点,尤其在克服肿瘤异质性方面具有重要的应用潜力。对于CK-AML患者,利用这些技术进行的克隆分辨率分析可以在治疗决策中起到关键作用。
该研究通过对CK-AML患者的单细胞多组学分析,揭示了复杂的克隆演化模式和潜在的靶向治疗策略。研究表明,CK-AML中的高度染色体不稳定性和克隆异质性是导致其治疗困难和预后不良的关键因素之一。通过对不同亚克隆的基因组、表型和药物敏感性进行深入分析,研究人员为未来开发精准且有效的治疗手段提供了新的思路。
参考文献
Leppä, AM., Grimes, K., Jeong, H. et al. Single-cell multiomics analysis reveals dynamic clonal evolution and targetable phenotypes in acute myeloid leukemia with complex karyotype. Nat Genet (2024). https://doi.org/10.1038/s41588-024-01999-x


