危重病人抗生素剂量优化
时间:2025-03-22 12:11:45 热度:37.1℃ 作者:网络

抗生素给药优化意味着什么?
最佳抗生素剂量是指确保在感染部位对病原体的给定易感性进行最佳抗生素暴露的剂量、剂量给药率和给药间隔,最大限度地杀死细菌,同时最大限度地减少毒性和抗生素耐药性的产生。它是抗菌药物管理(AMS)的重要组成部分,应在重症监护病房(ICU)药物优化的总体概念中予以考虑。
危重患者的抗生素药代动力学是否不同?
随着重症监护病房(icu)中出现极端病理生理的患者数量的增加,病原体敏感性下降的变化趋势导致了对“宿主-药物-细菌”三元模型的关注,即重新调整固定抗生素模型和个体化给药方法。考虑宿主因素以最大限度地提高抗生素效率并降低毒性(图1)。通常,推荐的抗生素剂量通常是从健康志愿者或不太剧烈不适的患者的研究中获得的。然而,危重患者则不同,他们有明显的体内平衡紊乱和终末器官功能改变,导致抗生素药代动力学(PKs)扭曲(图1)。具体来说,由于毛细血管渗漏和积极使用复苏液体,以及高动力循环,导致分布体积(Vd)增加,可能导致亲水浓度低于预期抗生素。此外,不同比例的ICU患者(尤其是年轻患者)在ICU入院的第一周内,败血症/感染性休克早期的创伤患者存在多因素病因(肾小球滤过率(GFR) bb0 130 ml/min/1.73m2))的肾清除率(ARC)增强,影响肾脏消除的抗生素并导致抗生素暴露不足(图1)。
另一方面,低灌注和器官衰竭在危重患者中很常见,特别是在老年人中,他们在ICU越来越常见。而且,危重症的病理生理变化是动态的、快速变化的;器官功能正常或ARC的患者可能会出现多器官功能障碍,如果不进行适当的剂量调整,可能会出现毒性(图1)。危重患者的PKs病理生理改变扭曲导致血浆抗生素浓度的巨大变化现在已经得到了很好的描述。并且在特定亚群(ARC、肥胖、烧伤、肾脏替代治疗)中尤为突出。在不考虑重症PK变化影响的情况下给药,几乎不可能实现有效的抗生素暴露,并且存在剂量不足/过量的风险(图1)。
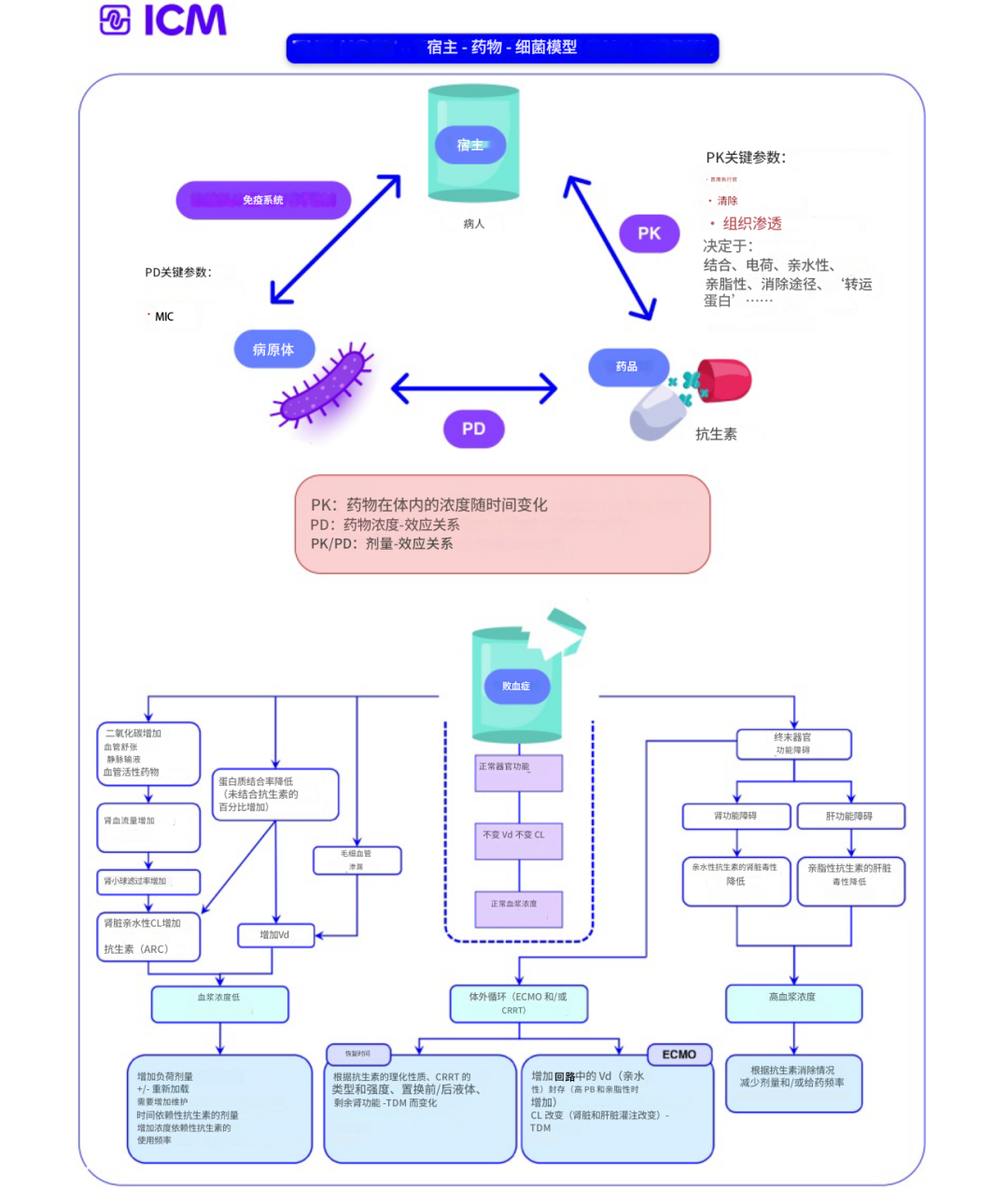
图1药代动力学(PK);PD药效学;分布体积(Vd):含有与血浆中相同浓度的给药总剂量的表观液体体积;清除率(CL):单位时间内清除药物的血容量;增强肾清除率(ARC);心输出量(CO);持续肾替代疗法(CRRT);体外膜氧合(ECMO);肾小球滤过率(GFR);1对于高蛋白结合抗生素(如头孢曲松、头孢唑林、氨曲南、厄他培南n)尤其重要,因为游离药物的清除率增加
优化抗生素给药的策略
解决危重疾病给药复杂性和优化给药的策略包括为危重患者验证的给药图、基于肌酐清除率(来自尿液收集)的肾消除抗生素给药、替代给药方案、基于治疗药物监测(TDM)的给药、以及基于模型的精确给药(MIPD)。
备选给药策略:较高的初始剂量、装载剂量、延长输注时间
替代给药方案已在危重患者中实施,以改善抗生素浓度和暴露时间,并优化其药效学(PD)效果。较高的初始剂量(如氨基糖苷类、万古霉素、粘菌素)和加载剂量(连续输注万古霉素)已被用于快速达到靶浓度并抵消增加的Vd,特别是对于亲水抗生素。基于在败血症/感染性休克早期阶段β -内酰胺亚治疗浓度的证据,也建议β -内酰胺的负荷剂量,特别是在多药耐药(MDR)患病率高的情况下。然而,每种β -内酰胺的最佳负荷剂量仍有待确定。
对于时间依赖性抗生素,已提出延长输注时间(PI)优化抗生素浓度高于MIC (T > MIC)的持续时间,即延长数小时(EI)或连续(CI)。对于具有挑战性PK、高临床失败风险和/或感染具有高mic的病原体的患者,加载剂量后PI更高剂量的β -内酰胺被认为对实现PK/PD目标非常重要。最近的大型BLINGIII研究比较了间歇性给药与连续输注β -内酰胺的负荷剂量,报告死亡率下降1.9%[95%可信区间(CI) - 4.9至1.1%],临床治愈率有5.7%[95%可信区间(CI) 2.4至9.1%]的统计学显著绝对增加CI为。纳入BLINGIII数据的系统评价/荟萃分析(SRMA)显示,与间歇输注组相比,延长输注组在第90天的住院死亡率更低,26名患者需要治疗才能多挽救1个生命。BLINGIII和SRMA的结果很重要,预计将在全球范围内引入从间歇性到长时间β -内酰胺输注的转变。
治疗药物监测(TDM)
替代给药方案可能会改善抗生素暴露,但可能不够精确,无法确保最佳给药。血浆样品的TDM可用于调整药物剂量以达到所需浓度,对于治疗指数较窄的药物尤为重要。除了避免毒性外,TDM还被用于优化PK/PD目标的实现,以提高疗效,提高治疗成功率。TDM应在ams团队管理环境中应用,理想情况下包括临床药师。在ICU环境下,抗生素TDM荐用于氨基糖苷类、β -内酰胺类、利奈唑胺、万古霉素(不易用于粘菌素和多粘菌素B等难以测量的药物)。尽管转向了功效目标的实现,但重要的是不要忘记,TDM对于避免不必要的高浓度具有潜在的有害毒性作用至关重要。对于β -内酰胺类药物,尽管其治疗范围很广,但10-15%的ICU患者可出现毒性,主要是神经毒性,主要是头孢吡肟(特别是老年人、肾功能不全、脑异常)。
其他优化策略包括pk建模给药软件,其中嵌入了考虑患者个体肾功能和体重的共变量,而更先进和复杂的MIPD还考虑了TDM采样结果和病原体的mic。
有效实施TDM所面临的挑战。尽管现有证据表明TDM可以提高目标的实现,但临床试验未能显示出结果一致的益处。一项多中心随机临床试验显示,ICU患者使用MIPD治疗β -内酰胺类药物或环丙沙星无临床效果。在危重患者中,可能影响抗生素暴露的多个变量的快速变化限制了MIPD提供最佳建议的能力。然而,人工智能和机器学习的指数级发展,以及实时TDM与原位生物传感器和床边监视器的发展,有潜力在未来10-15年内,提供克服现有障碍的手段,并最终使剂量优化成为常规。即使对于具有极端和多因子PK变异性的亚种群,也能完全自动化。


