【协和医学杂志】心悸,气促,四肢无力,水肿,喘憋:抗线粒体抗体阳性、合并心脏受累的罕见炎性肌病
时间:2025-03-09 12:09:50 热度:37.1℃ 作者:网络
病例介绍
患者女性,62岁,主诉“心悸、气促2年余,四肢无力6个月,水肿、夜间喘憋2个月”,于2023年12月28日收住北京协和医院老年医学科。
现病史
2021年初,患者无明显诱因出现间断性心悸,伴活动后气促,同期出现饮水、进食硬质食物时间断性呛咳,心悸发作时心电图示房颤,进一步完善24 h动态心电图示阵发性房颤、频发房性心动过速。
于外院完善动脉血气分析(未吸氧时),结果大致正常;24 h 动态心电图:持续性房扑,平均心率99次/min(范围:69~121次/min);超声心动图:双侧心房增大(左心房前后径37 mm);轻度二尖瓣、主动脉瓣及三尖瓣反流;冠状动脉CT:冠状动脉无钙化,未见粥样硬化性狭窄;胸部CT平扫:双下肺间质改变;予利伐沙班(15 mg/d)抗凝、酒石酸美托洛尔(25 mg/次,每12小时口服1次)控制心室率,心悸、活动后气促现象减轻;考虑存在肺间质病变。
为明确病因,进一步查C-反应蛋白(CRP)、红细胞沉降率(ESR)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、肌钙蛋白T(cTn T)、乳酸脱氢酶(LDH)、天门冬氨酸氨基转移酶(AST)均正常;NT-proBNP 1204 ng/L(↑);抗核抗体谱:ANA斑点核膜型1:80(+),抗Jo-1抗体(+++),抗Ro-52抗体(+++),抗PL-7抗体(+++);肺功能:限制性通气功能障碍;胸部CT平扫:双肺可见磨玻璃密度及网格影,以双肺下叶为著,并可见蜂窝影;疑诊“抗合成酶抗体综合征、间质性肺疾病”。
2021年7月9日起予以甲泼尼龙(48 mg/d)、环磷酰胺(100 mg/d)治疗后患者心悸、活动后气促减轻,但饮水及进食呛咳无明显改善。此后甲泼尼龙逐渐减量至8 mg/d,并于2022年11月自行停用上述药物(当时环磷酰胺累计剂量48 g)。
2022年12月患者如厕时突发意识丧失,约20 s后自行苏醒,醒后不能回忆起事件经过,不伴抽搐、大小便失禁。于当地医院查CK 411.1 U/L(↑),LDH 304 U/L(↑),AST 48 U/L(↑),肌钙蛋白Ⅰ(cTn Ⅰ)26.4 ng/L(↑)。24 h动态心电图:平均心率80 次/min(范围:46~143 次/min),未见>2 s的长RR间期;频发房性早搏(共6397次),房性心动过速145阵;室性早搏共87次,室性心动过速1阵。于外院复查CK 636 U/L(↑),CK-MB 7.9 μg/L(↑);超声心动图:左心房增大(左心房前后径37 mm);轻度二尖瓣反流。诊断为“急性冠状动脉综合征”,予阿司匹林、氯吡格雷、比索洛尔、瑞舒伐他汀治疗。
2023年2月11日行冠脉造影:左前降支近段狭窄(最严重处狭窄程度20%,TIMI Ⅲ级),余血管未见狭窄。此后患者再发间断性心悸,自行停用上述药物,改用中药治疗(成分不详)。
2023年6月患者出现四肢无力,蹲下后起立及躺下后坐起困难,无明显肌痛,于当地医院复查CK 1473 U/L(↑),CK-MB 51.9 U/L(↑),LDH 401 U/L(↑)。
2023年10月下旬,患者无明显诱因出现双下肢水肿,伴轻微活动后气促,夜间喘憋,不能平卧,尿量减少。于当地医院住院治疗,动脉血气分析(自然条件下)示PaCO2为60.42 mm Hg(↑,1 mm Hg=0.133 kPa),余指标均正常;肾功能正常;炎症指标:hs-CRP 0.52 mg/L,ESR 34 mm/h(↑);多次复查CK-MB、cTnⅠ均正常;NT-proBNP 3430 ng/L(↑)。
超声心动图:左心室射血分数(LVEF)55%;左心房增大(前后径44 mm);少至中等心包积液。因确诊“冠心病、急性心力衰竭”,予呋塞米(20 mg/d)、螺内酯(20 mg/次,2次/d)治疗后水肿消退,喘憋症状消失。
进一步完善抗核抗体谱:ANA核膜型1:1000(+)、胞浆型1:320(+),抗Ro-52抗体(++)。
胸部CT平扫:双肺下叶后胸壁胸膜下磨玻璃密度影,肺内部分小叶间隔增厚。
肺功能:重度限制性通气功能障碍。
肌电图:上下肢肌源性损伤,感觉及运动神经传导速度正常,重频刺激未见异常。
疑诊为“抗合成酶抗体综合征合并间质性肺疾病”,予甲泼尼龙(24 mg/d)治疗,3周后患者自行减量(12 mg/d)。为进一步诊治,患者于2023年12月4日就诊于北京协和医院。
既往史、个人史、家族史
甲状腺功能减退6年余,目前口服左甲状腺素钠100 μg/d,未规律监测甲状腺功能。2019年行右下肢静脉曲张手术治疗。个人史、婚育史、家族史均无殊。
入院查体
体温36.2 ℃,心率107次/min,呼吸频率26次/min,血压132/80 mm Hg,室温下脉搏血氧饱和度97%,体质量指数21 kg/m2。双手背皮肤粗糙,未见明显“技工手”样皮肤改变及Gottron征(关节处丘疹)。双肺呼吸音稍粗,深快呼吸时可闻及双下肺散在爆裂音。心律不齐,每分钟可闻及5~6次早搏。腹部无压痛、反跳痛、肌紧张,双下肢肌力Ⅳ级,双上肢肌力Ⅴ级,双下肢无水肿。
实验室检查
血气分析:pH 7.41,PaCO2 55 mm Hg (↑),PaO2 87 mm Hg,HCO3- 33.6 mM/L(↑),实际碱剩余(ABE) 7.7 mmol/L(↑),K+ 3.7 mmol/L,Na+ 135 mmol/L(↓),Cl- 101 mmol/L,空腹血糖 10.4 mmol/L(↑),乳酸1.2 mmol/L。
血常规:白细胞6.92×109/L,中性粒细胞百分比 87%,血红蛋白 121 g/L,血小板 155×109/L;血生化未见异常;CK、CK-MB均正常,肌红蛋白 113 μg/L(参考值:≤110 μg/L),高敏心肌肌钙蛋白I(hs-cTnⅠ) 800 ng/L(参考值:≤34 ng/L),NT-proBNP 688 ng/L(参考值:0~125 ng/L)。
甲状腺功能、胆管细胞酶均未见异常。
炎症指标:hs-CRP<0.50 mg/L,ESR 8 mm/h;铁蛋白、免疫球蛋白、补体均正常;抗核抗体谱:ANA 核膜型1:160(+),斑点型1:160(+),抗Ro 52抗体(+),抗线粒体抗体(AMA)-M2(+,327.66 RU/mL)。
老年综合评估
日常生活活动(ADL) 6分(满分6分);工具性日常生活活动(IADL)评分4分(满分8分);营养风险筛查(NRS-2002)评分2分(≥3分示存在营养风险)。优势手握力16 kg,步速0.6 m/s。
辅助检查
心电图:窦性心律、房速交替;左束支传导阻滞。
24 h动态心电图:窦性心律,阵发性房颤;平均心率82次/min(范围:53~143次/min);房性早搏总数24 671次(22.44%),单个房早13 948次,成对房早2153对,房性心动过速1181阵,二联律858阵,三联律249阵;阵发性房颤29阵(心搏总数共17 723次,占比12.50%);室性早搏总数2460次(2.24%),单个室早2431次,成对室早12对,室速1阵。
超声心动图:双侧心房增大(左心房前后径40 mm),轻度二、三尖瓣关闭不全;LVEF(M型) 62%(后降至39%);主动脉瓣退行性变;轻度主动脉瓣关闭不全;左室舒张功能减低(Ⅰ级);少量心包积液。
心肌灌注增强MRI(图1)在4腔心和短轴层面见左心室整体收缩活动减弱,以侧壁为著,同时见左心室侧壁局部明显变薄;室间隔基底段局部稍增厚;少量心包腔积液。
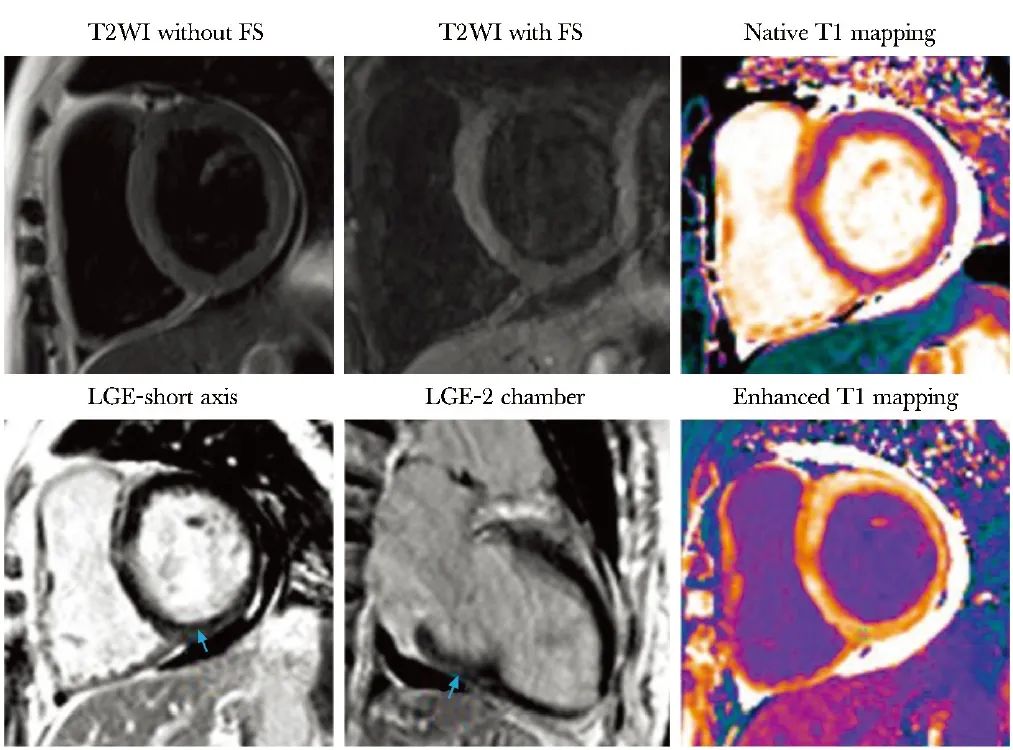
图1 心脏MRI示心肌组织特征(2024-01-10)
抑脂前及抑脂后T2WI见左室心肌信号不均匀,未见明显水肿信号;初始T1 mapping示左心室下壁及室间隔下插入部近基底段见初始T1值升高(均值:1495 ms);短轴及长轴钆延迟强化(LGE)示,相应心肌见条片状延迟强化,心外膜及心肌中层分布,未累及心内膜;增强后T1 mapping示相应心肌的T1值较其他心肌明显减低。
人体成分分析:四肢骨骼肌指数5.3 kg/m2。胸部高分辨CT:左肺上叶、右肺中叶及双肺下叶多发淡片索条影,考虑肺间质改变(图2)。
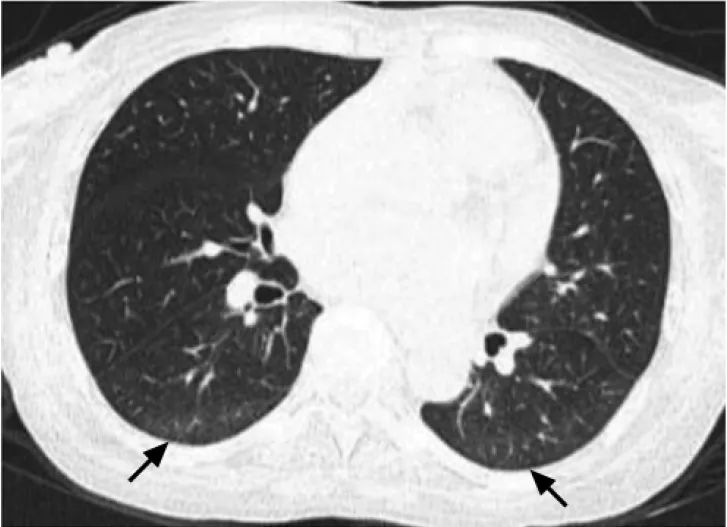
图2 胸部高分辨CT提示“双肺间质性改变可能”(2024-01-12)
诊疗经过
患者疑诊特发性炎性肌病(IIM)、心脏受累不除外。2024年1月4日起加用吗替麦考酚酯(0.75 g/次、2次/d,口服),1月8日起加用酒石酸美托洛尔(6.25 mg/次、2次/d,口服),患者主诉心悸减轻。
第一次多学科讨论(2024年1月17日)
老年医学科
患者老年女性,存在多脏器受累:
1 心脏:①病程中有心衰症状与体征,入院后查hs-cTnⅠ显著升高;②心律失常:24 h动态心电图可见频发房性早搏、阵发性房颤、室性早搏、室速和左束支传导阻滞。
2 呼吸系统:患者病程中查肺部CT可见双下肺以磨玻璃影及网格影为主要表现的肺间质病变,动脉血气分析见二氧化碳潴留,提示存在呼吸肌受累可能。
3 骨骼肌:患者四肢无力,以双下肢为著,间断饮水及进食干硬食物时呛咳,外院肌电图示下肢肌源性损害,病程中肌酶曾显著升高。
4 多种自身抗体阳性,AMA-M2阳性,胆管细胞酶水平正常。
5 老年综合评估提示存在衰弱和肌少症。
6 有晕厥史,现有检查未发现器质性疾病导致晕厥的证据。
结合病史、辅助检查及既往糖皮质激素及环磷酰胺治疗有效,可确诊为IIM。患者突出表现为以房性心律失常为主的多种心律失常,结合AMA-M2亚型高滴度阳性,认为抗线粒体抗体相关炎性肌病(inflammatory myopathy associated with anti-mitochondrial antibodies)可能性大。该病是一种特殊类型的肌炎,表现为慢性骨骼肌受累和严重的心脏受累,包括心肌炎、心律失常和心肌病。
拟通过多学科协作诊疗(MDT)解决以下问题:
1
患者心衰病史、心律失常能否用炎性肌病心脏受累进行解释?下一步针对心脏病变的治疗方案?
2
患者二氧化碳潴留,是否存在呼吸肌受累?
3
炎性肌病的具体类型考虑抗线粒体抗体相关炎性肌病,还需与抗合成酶抗体综合征进行哪些鉴别诊断?下一步针对原发病的治疗方案如何?
4
指导针对患者躯体功能、肺功能、肌力的康复方案。
放射科
入院后胸部高分辨CT示左肺上叶尖后段、右肺中叶、双肺下叶多发淡片索条影,右肺中叶轻微支气管扩张,整体考虑存在肺间质病变。静脉造影剂吞咽造影可见患者第一次吞咽动作时伴抬头,提示口腔运送时间延长,会厌部可见少量对比剂残余,综上患者吞咽造影吞咽困难程度评分2分(存在轻度吞咽困难)。
心肌灌注增强MRI示4腔心及短轴相见左心室整体收缩活动减弱,以侧壁为著,同时可见心左室侧壁局部明显变薄,室间隔基底段局部稍增厚,少量心包腔积液;抑脂前及抑脂后T2WI见左室心肌信号欠均匀,未见明显脂肪浸润;短轴及长轴LGE示侧壁变薄处未见明显异常延迟强化。综上,影像学方面心肌活动性炎症证据不足,不考虑糖皮质激素冲击治疗。
心内科
结合患者临床表现及心脏增强MRI所见,高度支持IIM导致的心肌炎,可完善心肌活检以进一步确诊。患者心脏MRI T1虽无特殊提示,但hs-cTnⅠ显著升高,可考虑完善68Ga-TATE或18F-CXCR4核素显像进一步明确有无心肌内活动性炎症;如存在心肌内活动性炎症的证据,可考虑强化免疫抑制治疗。
心律失常方面,射频消融对炎性肌病引起的各类型房性心律失常效果不佳,建议药物控制心室率。鉴于患者既往有晕厥史,建议进一步完善头颅MRI及MRI脑血管造影,以排查脑血管疾病。
患者有发生恶性室性心律失常的风险,建议3~6个月后评估是否有放置植入型心律转复除颤器的指征。针对心力衰竭,结合心肌MRI所见,考虑为射血分数减低的心力衰竭,建议启动新四联抗心肌重构药物,逐渐滴定至耐受剂量。
风湿免疫科
该患者存在四肢近端对称性肌无力,呼吸肌、吞咽肌、心肌受累;病程中CK显著升高;肌电图示肌源性损害。根据2017年EULAR/ACR特发性炎性肌病分类标准[1],患者年龄≥40岁(2.1分)、有客观存在的对称性上肢近端肌无力(0.7分)和对称性下肢近端肌无力(0.8分)、颈屈肌肌力弱于颈伸肌(1.9分)、下肢近端肌力弱于远端肌力(0.9分)、吞咽困难或食管运动障碍(0.7分)、起病初期血清CK升高(1.3分),总分8.4分,IIM诊断明确(无肌肉活检情况下≥7.5可确诊IIM,诊断特异度≥90%)。
分型方面,患者既往于外院曾疑诊为抗合成酶抗体综合征。抗合成酶抗体包括抗JO-1抗体、抗EJ/OJ/PL-7/PL-12抗体等,临床症状包括发热、雷诺现象、“技工手”、间质性肺炎、肌炎、关节炎,总体预后尚可,但部分患者呈激素依赖型,激素减量后病情易复发。
患者存在间质性肺炎,既往检查示抗合成酶抗体阳性,但激素治疗后肺间质病变现已基本消退,且后续多次复查抗合成酶抗体均为阴性,不符合抗合成酶抗体综合征的临床特点。抗线粒体抗体相关炎性肌病为IIM的罕见亚型,多见于东亚人群,肌肉受累较为隐匿,可以无症状性CK升高起病,病情易慢性化,肌肉病理具备免疫介导的坏死性肌病样慢性肌炎,心脏受累和呼吸肌无力患病率高。
结合该患者ANA核型为斑点、核膜型,AMA-M2高滴度阳性,既往对糖皮质激素、环磷酰胺治疗有效,近期停药后复查仅有轻度肺间质病变,但整个病程心脏受累、尤其是心律失常表现突出,可诊断为抗线粒体抗体相关炎性肌病。治疗方面,现已加用吗替麦考酚酯(0.75 g/次,2次/d)。心脏RMI示心肌炎呈慢性期改变,但hs-cTnⅠ水平仍显著升高,亦建议完善68Ga-TATE或18F-CXCR4核素显像,进一步明确有无心肌内活动性炎症。
呼吸与危重症医学科
患者原发病确诊为IIM,亚型为抗线粒体抗体相关炎性肌病,伴心脏受累,且临床表现和影像学检查结果示存在肺间质病变。肺间质病变是结缔组织病常见的肺部并发症,可见于多种结缔组织病,如系统性硬化症、类风湿关节炎、多发性肌炎/皮肌炎、干燥综合征和系统性红斑狼疮等。结合本次入院时的胸部高分辨CT表现,目前肺间质病变较轻,无法解释高碳酸血症,后者可能与IIM呼吸肌受累有关。必要时可行肌电图、膈肌超声等以明确呼吸肌受累情况。
康复医学科
康复训练主要基于以下3个方面:
1 吞咽功能障碍:患者于2021年初开始出现进食、饮水呛咳,本次入院后吞咽造影示轻度吞咽功能障碍。可指导患者低头吞咽,进行颈部肌肉力量锻炼,饮食以均质为主。
2 四肢、躯干骨骼肌受累:患者合并衰弱状态及肌少症,康复锻炼主要推荐抗阻训练,其对心肺功能的要求低于有氧训练,安全的心率范围为小于120 次/min且较静息状态下升高小于20 次/min。
3 肺功能康复:患者存在限制性通气功能障碍,考虑呼吸肌受累为呼吸功能障碍的主要原因,故康复锻炼的主要目的为恢复呼吸肌功能,从而改善肺通气。
第一次多学科讨论后处理
2024年1月18日起加用螺内酯(10 mg/d)、沙库巴曲缬沙坦(25 mg,每12小时一次,口服),并予达格列净(2.5 mg/d),继续酒石酸美托洛尔(6.25 mg,每12小时一次,口服),拮抗心肌重构及控制心室率治疗。加用上述药物后监测患者血压无下降,无头晕等不耐受表现,2024年1月21日第一次MDT后将沙库巴曲缬沙坦调整为50 mg每12小时口服一次。患者拒绝行心肌活检,进一步完善18F-CXCR4心肌显像,未见左、右心室放射性摄取增高及CXCR4表达,未检出巨噬细胞和T淋巴细胞浸润(图3)。头颅MRI及MRI脑血管造影均未见明显异常。
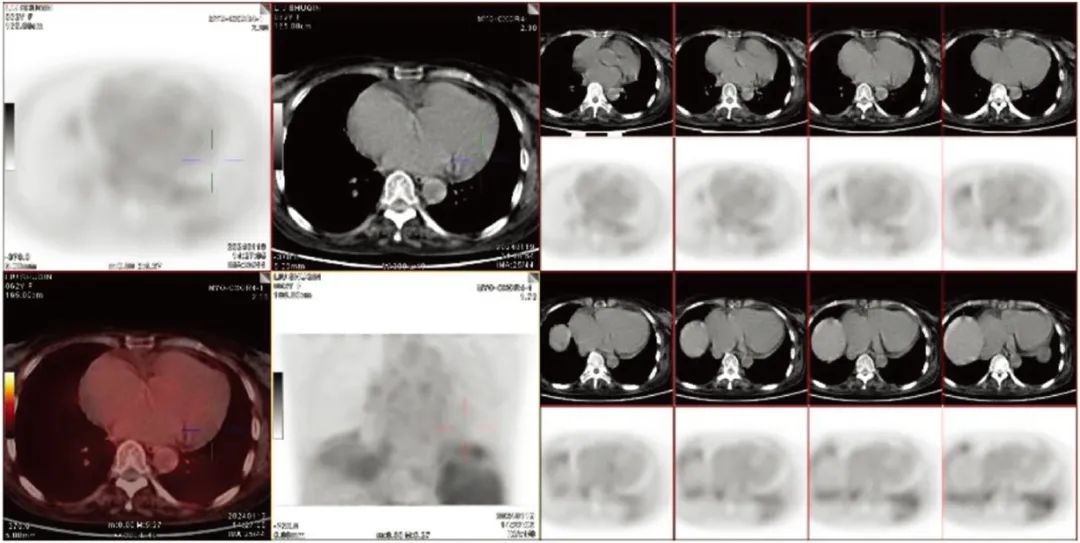
图3 18F-CXCR4显像未见左、右心室明显放射性摄取增高及CXCR4表达(2024-01-25)
第二次多学科讨论(2024年1月21日)
风湿免疫科
患者诊断为IIM(亚型为抗线粒体抗体相关炎性肌病),存在心脏受累。既往无大剂量糖皮质激素治疗史。因患者心肌损伤标志物仍处于较高水平,从恢复重要脏器功能角度,可尝试甲泼尼龙冲击治疗(1 g×3 d),后续剂量调整为50 mg/d、每周减5 mg至30 mg/d维持,并通过门诊复诊指导激素减量方案。如启动冲击治疗,需充分告知患者及家属目前影像学上心肌内活动性炎症证据不足,免疫抑制治疗后续获益可能有限,且大剂量糖皮质激素治疗的副作用不容忽视,建议充分权衡利弊后实现医患共同决策。免疫抑制剂方面,继续吗替麦考酚酯片(0.75 g/次,2次/d)治疗,定期监测血常规、肝肾功能、免疫球蛋白变化。
心内科
患者合并阵发性房颤,存在抗凝指征,建议在启动新四联拮抗心衰重构治疗的同时,启动新型口服抗凝药抗凝治疗。
第二次多学科讨论后处理
同患者及家属召开家庭会议,充分告知当前病情及后续治疗方案,并解释激素冲击治疗的潜在获益与风险。患者家属决定暂不选择糖皮质激素冲击治疗,继续甲泼尼龙(12 mg/d)、吗替麦考酚酯(0.75 g/次,2次/d)治疗。心脏方面,在新四联拮抗心肌重构治疗的基础上,考虑患者高龄、合并衰弱状态,发生药物不良反应(出血)风险较高,予以利伐沙班(10 mg/d)抗凝。患者隔日于康复科治疗室行吞咽训练、四肢及躯干肌力与呼吸功能康复训练。经上述治疗后心悸明显减轻,平卧后可自行缓慢翻身坐起,每日可于病房走廊内缓慢行走约2000步,无活动后胸闷、气促、喘憋。
最终诊断
IIM[抗线粒体抗体相关炎性肌病;肺间质病变;心脏受累(频发房性心动过速,心房扑动,阵发性心房颤动,频发房性早搏,室性早搏,室性心动过速,心肌损伤,射血分数减低型心力衰竭);吞咽肌受累,吞咽困难(轻度);呼吸肌受累可能性大、高碳酸血症];晕厥史;甲状腺功能减低;衰弱状态。
讨论
IIM为自身免疫性疾病,以肌无力、肌力减退、炎症细胞浸润为主要特征,临床表现具有高度异质性,可引起多系统受累。文献报道,IIM患者心脏受累发生率为9%~72%[2]。
一项针对北京协和医院既往存在心脏受累IIM患者的回顾性研究[3-4]显示,IIM心脏受累的主要临床表现为心律失常和心力衰竭,其中房颤、室性心律失常、左室传导系统异常、射血分数减低型心力衰竭(LVEF≤40%)、Q波异常的患病率分别为65.4%、67.3%、67.3%、61.6%和50.5%;中位随访2年,50%的患者因心力衰竭再住院,38.5%的患者发生心源性死亡[3]。
基于中国风湿病数据中心-炎性肌病登记研究(CRDC-MYO)开展多中心横断面调查共入选1946例IIM患者,其中心脏受累者占比5.5%,主要表现为充血性心力衰竭(62%)和严重心律失常(56.5%)[5]。上述研究提示,IIM可引起心脏受累,出现上述典型心脏表现且无明显其他证据时,应注意排查IIM。
AMA通常与原发性胆汁性肝硬化有关,与其他自身免疫性疾病如干燥综合征、硬皮病、自身免疫性甲状腺疾病亦具有一定相关性[6]。AMA阳性在IIM患者中较为罕见,文献显示,AMA阳性约存在于5%的成人肌炎患者和1%的青少年肌炎患者中[7]。AMA成人肌炎患者虚弱发生率较高(90%)[7],AMA-M2阳性的心肌炎患者弥漫性LGE发生率显著升高[8],伴AMA-M2阳性,CK、CRP、肺动脉血压升高的IIM患者更易发生心肌梗死并发症[5]。
一项针对北京协和医院多发性肌炎和皮肌炎伴心肌受累患者的回顾性研究显示,AMA阳性是室性心律失常的独立预测因素[4]。上述研究提示,虽然AMA阳性是IIM的罕见表现,但可能对患者预后产生不利影响,对IIM患者进行AMA抗体检测具有必要性。
早期识别并进行有效干预有助于改善合并心脏受累IIM患者的临床结局,其诊断手段主要包括生物标志物测定及影像学检查。IIM心肌炎患者普遍存在肌钙蛋白水平升高和心电图异常,其中cTn T升高较cTnⅠ升高更为常见,但cTnⅠ对诊断IIM心脏受累更具特异性[9]。Khoo等[10]对无心脏受累症状的IIM患者进行心脏增强MRI检查后发现,47.4%表现出LGE,36.8%可见T1相升高,即在无心脏受累指征的IIM患者中,近半数病例通过心脏MRI可见明显的心脏受累证据。提示,cTnⅠ水平、心脏MRI可为心脏受累IIM患者的早期诊断及亚型确定提供重要参考信息。
本例患者存在明显的心脏受累,主要表现为心力衰竭和以房性心律失常为主的多种类型心律失常,结合年龄、肌力改变、血清CK升高等资料,IIM诊断明确。与既往文献[11]报道IIM患者病例相似,二者均为AMA阳性,心肌、呼吸肌、吞咽肌等多系统肌肉受累,但本例患者曾于外院诊断为抗合成酶抗体综合征,提示应及时进行相关抗体检测,以明确抗合成酶抗体综合征与抗线粒体抗体相关炎性肌病的鉴别诊断。
此外,本例患者甲状腺功能减低,一项系统检索25年内多发性肌炎伴甲状腺疾病文献的回顾性研究[12]发现,所有病例均为女性(甲状腺功能减退症58.8%,甲状腺功能亢进症41.2%),提示对于患有IIM的老年女性,应注意甲状腺功能的评估。本例患者入院后经心脏增强MRI及18F-CXCR4心肌显像检查,均未发现心肌内活动性炎症的证据,但血清hs-cTnⅠ水平显著升高,提示虽经过前期较为充分的糖皮质激素及免疫制剂治疗,仍存在持续性的心肌损伤。是否进行糖皮质激素冲击治疗以减轻心肌损伤,目前尚缺乏充足的循证医学证据。
临床决策通常可分为两类:一类是有效决策(effective decision),是指已达成共识的最佳治疗,有确切证据证明利大于弊;另一类是倾向敏感性决策(preference-sensitive decision),是指尚无足够证据获益与风险的关系,或需要主观权衡,无确切的最佳治疗方案。
老年患者使用大剂量糖皮质激素冲击治疗存在潜在感染、水电解质紊乱风险,且对于治疗的倾向存在较大差异性,此时需医患共同决策以决定后续治疗选择。该患者经老年综合评估提示合并衰弱状态,其是在老化过程中表现为躯体储备功能下降,易导致不良健康结局的一种老年综合征。衰弱患者常合并出现功能退化、肌少症、机体免疫功能下降、神经内分泌调节异常等,可导致包括功能残障、生活质量下降、痴呆、跌倒、住院时间延长及死亡等不良临床结局[13]。对于合并衰弱的老年自身免疫性疾病患者,是否启动糖皮质激素冲击治疗需审慎对待。充分权衡风险与获益,经医患共同决策后,本例患者最终决定维持当前治疗方案,密切随访观察。由于患者AMA-M2阳性、CK曾升高,需警惕心肌梗死,且存在抗心脏重塑治疗、室性心律失常及LVEF减低等危险因素,其远期预后需进一步随访追踪。
专家点评
北京协和医院老年医学科
康 琳 主任
患者老年女性,慢性病程,经MDT讨论最终明确诊断为IIM。患者的心脏受累尤为突出,表现为心力衰竭及多种类型心律失常。回顾整个诊疗历程,需关注的要点包括:
1 注重临床细节,从细微处探寻疾病真相。该患者经利尿、拮抗心肌重构治疗及较为充分的糖皮质激素联合免疫抑制剂治疗后,心力衰竭症状虽明显改善,心脏影像学亦未发现明确心肌内活动性炎症证据,但hs-cTnⅠ水平持续居高不下。此时,临床医师需思考:影像学的阴性结果是否能反映真实的心肌内炎症状态?当前的心脏影像学检查是否对评估心房肌炎症情况存在局限性?
2 重视康复在炎性肌病综合治疗中的价值。在康复师指导下的抗阻运动和针对呼吸功能的康复训练,有助于改善患者的肌肉力量和肺功能,延缓炎症介导及废用性的肌肉萎缩。
3 医患共同决策。老年患者常多病共存,同时合并衰弱、躯体功能下降、易损性增加等共性老年问题。对于病情复杂老年患者的医疗决策,应综合权衡获益与风险,并与患者共同制订个体化方案。
参考文献
[1]Malaviya A N. 2017 EULAR/ACR classification criteria for adult and juvenile idiopathic inflammatory myopathies and their major subgroups: little emphasis on autoantibodies, why?[J]. Ann Rheum Dis, 2018, 77(11): e77.
[2]Zhang L, Wang G C, Ma L, et al. Cardiac involvement in adult polymyositis or dermatomyositis: a systematic review[J]. Clin Cardiol, 2012, 35(11): 686-691.
[3]Liu Y X, Hsu J, Liu X H, et al. Electrophysiological, structural, and functional disorders in patients with inflammatory cardiomyopathy secondary to inflammatory myopathy[J]. Ann Noninvasive Electrocardiol, 2022, 27(4): e12938.
[4]Huang Y F, Liu H Z, Wu C Y, et al. Ventricular arrhythmia predicts poor outcome in polymyositis/dermatomyositis with myocardial involvement[J]. Rheumatology (Oxford), 2021, 60(8): 3809-3816.
[5]Zhang L X, Zhu H Y, Yang P T, et al. Myocardial involvement in idiopathic inflammatory myopathies: a multi-center cross-pal study in the CRDC-MYO registry[J]. Clin Rheumatol, 2021, 40(11): 4597-4608.
[6]Albayda J, Khan A, Casciola-Rosen L, et al. Inflammatory myopathy associated with anti-mitochondrial antibodies: a distinct phenotype with cardiac involvement[J]. Semin Arthritis Rheum, 2018, 47(4): 552-556.
[7]Sabbagh S E, Pinal-Fernandez I, Casal-Dominguez M, et al. Anti-mitochondrial autoantibodies are associated with cardiomyopathy, dysphagia, and features of more severe disease in adult-onset myositis[J]. Clin Rheumatol, 2021, 40(10): 4095-4100.
[8]Liu Y X, Fang L G, Chen W, et al. Identification of characteristics of overt myocarditis in adult patients with idiopathic inflammatory myopathies[J]. Cardiovasc Diagn Ther, 2020, 10(3): 405-420.
[9]Fairley J L, Wicks I, Peters S, et al. Defining cardiac involvement in idiopathic inflammatory myopathies: a systematic review[J]. Rheumatology (Oxford), 2021, 61(1): 103-120.
[10]Khoo T, Stokes M B, Teo K, et al. Cardiac involvement in idiopathic inflammatory myopathies detected by cardiac magnetic resonance imaging[J]. Clin Rheumatol, 2019, 38(12): 3471-3476.
[11]路菲, 张宁, 康琳, 等. 肌力下降、呼吸衰竭、心力衰竭、抗线粒体抗体阳性:罕见炎性肌病的不典型表现[J]. 协和医学杂志, 2022, 13(1): 138-146.
[12]Wang H, Li H, Kai C, Deng J. Polymyositis associated with hypothyroidism or hyperthyroidism: two cases and review of the literature[J]. Clin Rheumatol, 2011, 30(4):449-458.
[13]刘晓红, 康琳. 老年医学诊疗常规[M]. 北京: 中国医药科技出版社, 2017: 91-97.


