NCB:李磊/甘波谊/魏文毅发现PRMT5介导的精氨酸甲基化稳定GPX4以抑制癌症中的铁死亡!
时间:2025-03-06 12:12:11 热度:37.1℃ 作者:网络
从非常规的角度来看,铁死亡的激活显示了癌症治疗的巨大潜力,但是揭示抑制肿瘤固有的铁死亡以促进肿瘤发生的潜在机制仍然是一项具有挑战性的任务。
2024年3月3日,西安交通大学李磊、德克萨斯大学甘波谊、哈佛医学院魏文毅共同通讯Nature Cell Biology在线发表题为“PRMT5-mediated arginine methylation stabilizes GPX4 to suppress ferroptosis in cancer”的研究论文,该研究表明PRMT5介导的精氨酸甲基化稳定GPX4以抑制癌症中的铁死亡。该研究报道了甲硫氨酸被代谢为S-腺苷甲硫氨酸,S-腺苷甲硫氨酸作为甲基供体触发谷胱甘肽过氧化物酶4 (GPX4)在保守的精氨酸152 (R152)残基的对称二甲基化,同时延长GPX4的半衰期。
抑制催化GPX4甲基化的蛋白质精氨酸甲基转移酶5 (PRMT5 ),通过抑制GPX4甲基化和增加体内外铁死亡诱导剂敏感性来降低GPX4蛋白水平。这种甲基化阻止了Cullin1-FBW7 E3连接酶与GPX4的结合,从而消除了泛素化介导的GPX4降解。值得注意的是,在小鼠肿瘤模型中,将PRMT5抑制剂治疗与高铁疗法相结合显著抑制了肿瘤进展。此外,GPX4水平与FBW7水平和人类癌症患者的不良预后呈负相关。总之,该研究发现PRMT5通过PRMT5增强的GPX4稳定性来减少肿瘤细胞对铁死亡的抵抗,从而作为改善癌症治疗效果的靶标。

当过量的活性氧(ROS)引发铁依赖的磷脂过氧化时,就会引发铁死亡,最终导致细胞膜破裂。由于肿瘤细胞过度增殖引起的过量ROS,铁死亡已成为癌症治疗的有希望的靶点。然而,癌细胞已经发展了过多的分子改变和代谢重编程机制,以避免铁死亡。调节铁死亡的机制涉及细胞氧化还原状态、氨基酸、铁丰度和脂质代谢。其中最有效的涉及胞囊(e)ine/谷胱甘肽(GSH)/GPX4轴,其作为铁死亡的中央调节物发挥作用。其他铁死亡调节因子,如铁死亡抑制蛋白(FSP1)、二氢乳清酸脱氢酶(DHODH)-DHC还原酶(DHCR7)和GTP环化水解酶1 (GCH1),主要通过以辅助方式再生自由基捕获抗氧化剂(RTAs)或其自由基捕获活性来终止铁死亡。同时,GPX4使用GSH作为辅因子,将有毒的脂质氢过氧化物(L-OOH)转化为无毒的脂质醇(L-OH),防止脂质过氧化。
已经确定溶酶体依赖的GPX4通过肌酸激酶B (CKB)介导的丝氨酸104残基磷酸化的蛋白质降解途径。然而,互补蛋白降解途径,泛素-蛋白酶体途径介导的GPX4降解,仅在特定的癌症背景下进行了检查。翻译后修饰(PTM)调整蛋白质状态,以匹配不断变化的细胞代谢。考虑到GPX4泛素化缺乏泛癌治疗的药物靶点,为寻找影响GPX4泛素化的PTMs留下了缺口。
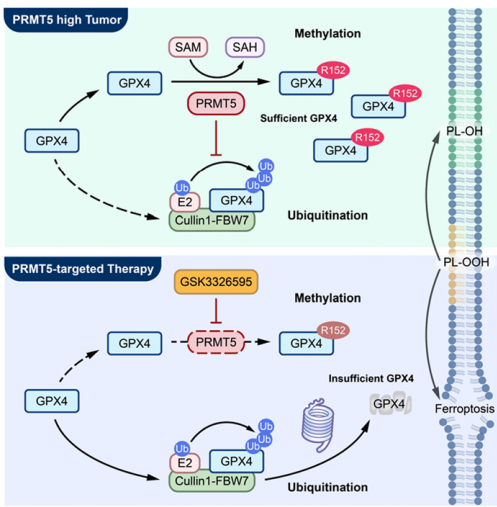
机理模式图(图源自Nature Cell Biology)
在该研究中,研究人员证明了肿瘤细胞通过稳定GPX4来提高甲硫氨酸代谢,从而发挥抗铁死亡作用。蛋白质精氨酸甲基转移酶5 (PRMT5)在甲硫氨酸衍生的S-腺苷甲硫氨酸(SAM)的帮助下,在保守的精氨酸152残基甲基化GPX4,从而防止GPX4降解和抵消铁死亡。将PRMT5抑制剂与铁死亡诱导剂组合在体外和体内限制肿瘤进展。这些发现提供了对代谢重编程诱导的铁死亡抗性的见解,并表明了用于抗癌的潜在操作策略。
原文链接:
https://www.nature.com/articles/s41556-025-01610-3#Sec34


