【Cancer Lett】综述:血液恶性肿瘤患者生育力的评估和保存
时间:2025-03-06 12:11:27 热度:37.1℃ 作者:网络
生育力
对于血液系统恶性肿瘤患者,免疫治疗和靶向治疗等新型治疗策略提供了获得完全临床缓解和长期生存的潜力,但生育力下降也成为部分患者的重大问题,影响长期生活质量。对于男性,强化治疗会对精子发生产生不利影响,导致精子数量低、形态异常和运动能力降低;对于女性,这些治疗与卵巢功能不全(POI)的风险增加有关,可够降低卵巢储备。此外,这些治疗会损害生殖系统,包括子宫和阴道,从而对妊娠结局产生负面影响。在治疗前或治疗期间保留生育力对于有不孕风险的血液恶性肿瘤患者至关重要。
已知常规大剂量化疗和放疗可降低生育力或引起不孕,而较新疗法(如(CAR-T 细胞治疗)对生育力影响的临床数据有限。此外,尚无保留这些患者生育力的标准方法。男性患者可以选择精子冷冻保存,而女性患者可以通过胚胎、卵母细胞或卵巢组织冷冻保存来保存生育力。然而,保留青春期前患者的生育力仍存在重大挑战。因此,血液科医生必须教育患者肿瘤治疗的潜在性腺毒性,并提供最合适的生育力保存选择。
《Cancer Letters》近日发表综述,评估了血液恶性肿瘤患者常用治疗方案(化疗、放疗、靶向治疗和免疫治疗)的潜在性腺毒性,并提出在这一人群中保留生育力的当前选择,通讯作者为新桥医院张曦教授和王筱淇教授。

生育力评估
对青少年和年轻成年人来说,评估肿瘤治疗后的生育力至关重要。精液分析(评估浓度、活动力和形态)是评估成年男性生育力的标准方法,睾丸活检和血清标志物是可用于青春期前男孩的替代评估方法。女性生育力评估通常依赖于窦卵泡计数(AFC)和生化分析,AFC通过超声波在卵巢窦中计数窦卵泡,可显示女性的卵巢储备情况。
生物标志物已经成为预测生育力很有前途的工具。在男性中,与精子形成相关的抑制素 B 可以指示性腺损伤,但不能替代常规检查。此外,基于组学的精子和精浆中的分子生物标志物可能有助于识别潜在问题,例如 DNA 完整性、基因组、表观基因组、代谢组、蛋白质组和转录组的变化。例如,尽管大多数血液系统恶性肿瘤患者在治疗前评估时精液参数正常,但蛋白质组学研究表明肿瘤可导致与精子生育力和活动力相关的关键蛋白失调(如 PRDX 2、SERPIN A5、转铁蛋白、NADH、超氧化物歧化酶 1 和细胞色素 b-c1 复合物亚基 2)。此外,霍奇金淋巴瘤(HL)患者的 DNA 片段化指数(DFI)降低。
在女性中,评估卵巢储备和预测未来生育力是主要关注点,常见的生物标志物包括血清促卵泡激素(FSH)、抗缪勒管激素(AMH)和尿 FSH 水平。AMH 由生长中的卵巢卵泡的颗粒细胞产生,可反映原始卵泡的储备情况,并且不受月经周期阶段、激素避孕使用或怀孕的影响而保持稳定。肿瘤治疗后AMH 水平通常会显著下降,并可能在 1-2 年内部分恢复。尽管 AMH 水平与卵巢功能不全(POI)的临床数据有限,但 AMH 是卵巢储备的重要标志物。关于 AMH 水平与生殖寿命或 POI 发生时间之间关系的数据也有限。蛋白质组学分析的进展可以进一步完善生育力生物标志物,有助于女性生育力的评估和保护。表 1 列出了临床上常用的生育力评估方法和几种潜在生物标志物。

化疗和放疗
化疗药物通常与性腺毒性有关,包括烷化剂、铂类复合物和蒽环类药物。
单药治疗很少用于血液系统恶性肿瘤,需要分析常见治疗方案对霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)患者性腺功能的影响。对于经典型霍奇金淋巴瘤(cHL)患者,ABVD(阿霉素、博莱霉素、长春花碱和达卡巴嗪)方案的性腺毒性低于包含丙卡巴肼和环磷酰胺的MOPP(氮芥、长春新碱、丙卡巴肼和泼尼松)和COPP(环磷酰胺、长春新碱、泼尼松和丙卡巴肼)方案。ABVD可暂时影响卵巢功能、激素(AMH和FSH)水平以及卵巢和子宫组织形态,通常在1-2年内恢复。Antoine Machet等人报道,ABVD组与对照组在怀孕率、生育结果或产科并发症方面没有显著差异。对于男性患者,ABVD治疗后6个月精子计数和活动力通常会下降,随后逐渐恢复。
对于进展期HL患者,BEACOPP(博莱霉素、依托泊苷、多柔比星、环磷酰胺、长春新碱、丙卡巴肼和泼尼松龙)与较高的性腺毒性有关。与6周期BEACOPP相比,早期反应者从BEACOPP升级切换到ABVD的PET驱动策略可降低性腺功能障碍的风险。对于男性,BEACOPP与少精症的高风险有关,超过6周期可能导致不可逆的无精症。
对于侵袭性NHL患者,标准治疗包括CHOP(环磷酰胺、多柔比星、长春新碱和泼尼松)、CHOP+依托泊苷(CHOEP)或CHOEP+利妥昔单抗。化疗期间的性腺功能障碍通常可逆,尤其是对于35岁以下的患者,卵巢功能通常可在治疗后恢复。
接受造血干细胞移植(HSCT)的患者通常在HSCT前接受化疗和桥接治疗以实现缓解。幸运的是,血液系统恶性肿瘤的初始治疗通常避免使用烷化剂,对性腺的毒性影响较小。
对于接受预处理的患者,环磷酰胺与异常精子特征的高风险有关。减低强度预处理(RIC)方案的进展导致了研究对清髓性预处理(MAC)和RIC之间性腺毒性进行比较,然而接受RIC治疗的男性患者并没有显著受益。Alison Leiper等人发现,接受他莫昔芬为基础的方案的患者抑制素B水平较高,表明性腺储备更好。
与男性患者相比,女性患者通常从RIC方案中获益更多。Jonathan D. Bender 等人报告称,接受 RIC 的患者发生POI的情况比接受MAC的患者少见(0% vs 53.3%;P=0.02)。Nathalie Forgeard 等人报告称,接受 RIC 的患者 POI 的发生率比接受 MAC 的患者低(43% vs 95%,p<0.001)。尽管 RIC 的性腺毒性有所降低,但患者仍有不孕的风险。即使使用 RIC 方案,密切监测卵巢储备和生育潜力也很重要。
放疗会直接影响性腺功能和下丘脑-垂体-性腺轴。Wallace 等人提出了一个预测放疗后卵巢衰竭的模型。导致 50% 卵子死亡的剂量(LD50)为<2 Gy。10 到 30 Gy 的辐射剂量与儿童和青少年急性卵巢衰竭(AOF)密切相关。与单独化疗相比,化疗联合放疗增加HL女性患者 POI 的风险(aRR 2.81;95% CI 2.16 至 3.65)。Johannes Rosenbrock 等人比较了受累野放疗(IFRT)和受累部位放疗(ISRT)对 13 例 HL 患者生育力的影响;ISRT 显著降低卵巢的平均辐射剂量(7.44 Gy vs 15.13 Gy)和子宫的平均辐射剂量(8.94 Gy vs 14.51 Gy),增加存活的非生长卵泡的比例(24.48% vs 11.87%)。在男性中,低至 0.1–0.2 Gy 的辐射剂量会对生精过程产生不利影响,2–3 Gy 的辐射剂量可能导致长期无精症,而超过 6 Gy 的剂量可能导致不可逆的无精症。Sidsel Mathiesen 等人观察到,所有接受超过 12 Gy 睾丸照射的患者都出现无精症,而接受超过 16Gy 照射的患者需要睾酮替代治疗。此外,中性粒细胞减少症、感染、心脏并发症、呕吐、发热和肾损伤也是放疗的常见并发症。
造血干细胞移植
造血干细胞移植(HSCT)是血液系统恶性肿瘤和非恶性造血疾病的一种根治方法。尽管患者的长期生存率有所提高,但不孕仍是治疗的一个重要长期后果。HSCT 通过四个因素影响生育力:血液系统恶性肿瘤、初始化疗、预处理方案和移植后并发症(图 1)。
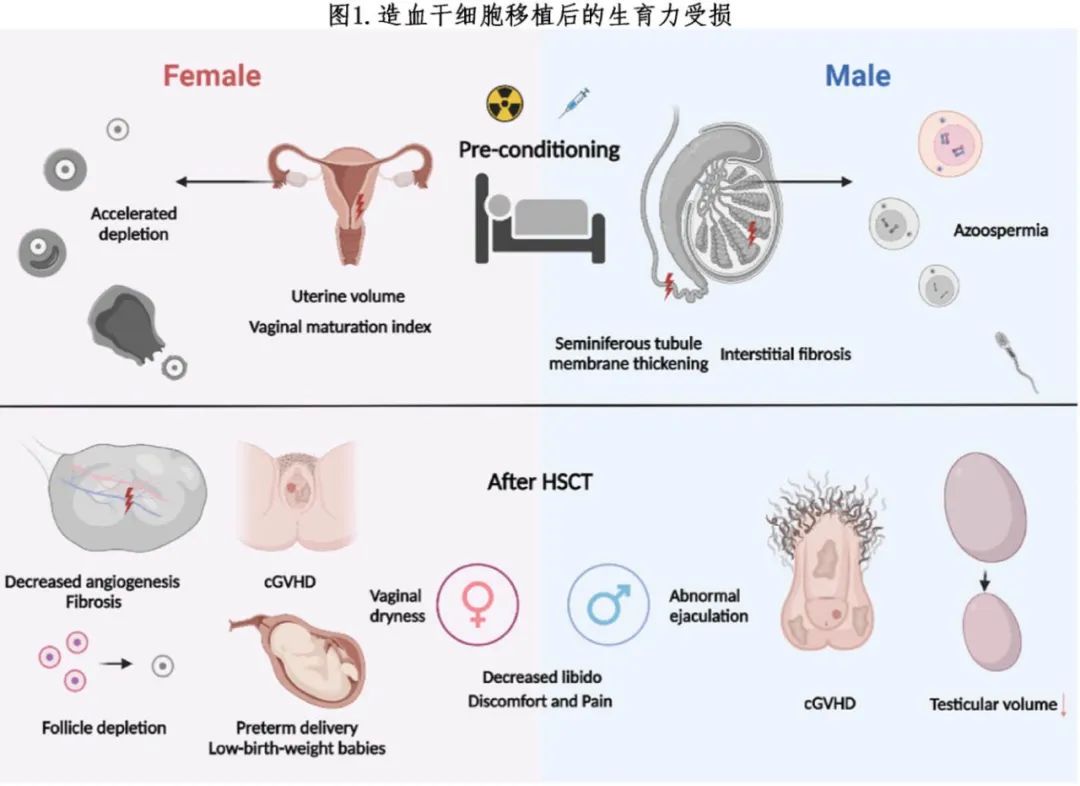
N. Salooja 等人报告称,只有 0.6% 的患者在接受 HSCT 后怀孕。此外,接受异基因 HSCT(allo-HSCT)的患者更容易出现妊娠并发症,如早产、剖宫产和低出生体重婴儿。预处理方案对性腺毒性构成重大风险。在男性中,移植后无精症的发生率在 25% 到 72% 之间,具体取决于预处理方案和精液分析的时间。HSCT 后几年,生精功能可能会逐渐恢复。Alicia Rovó 报道,持续的慢性移植物抗宿主病(cGVHD)是未接受全身照射(TBI)治疗的患者精子恢复的主要抑制因素(RR 3.11;95% CI:1.02–9.47;p=0.045)。
移植物抗宿主病(GVHD)是 HSCT 的常见并发症。根据发病时间分为两种类型:急性 GVHD(aGVHD)和 cGVHD。在未使用免疫抑制剂治疗的小鼠模型中,发现 aGVHD 会靶向卵巢,致使靠近浸润的供者T细胞处形成凋亡的颗粒细胞。此外,GVHD 可以独立于预处理方案而损害卵巢功能,导致血清抗缪勒管激素(AMH)水平显著降低。aGVHD 还会影响男性的睾丸,由于供者T 细胞浸润及生成干扰素-γ 和肿瘤坏死因子而导致Leydig细胞受损。然而,尽管在小鼠中观察到 aGVHD 对生殖器官的损伤,但其对生育力的影响通常比临床病例中的预处理毒性要轻。
女性生殖器 cGVHD 最早由 Stephen Corson 等人在 1982 年描述,其发生率在 24.9% 到 69% 之间,具体取决于诊断标准和研究队列。HSCT 后生殖器 cGVHD 的中位发病时间为 8.7-10 个月,但也有少数病例在移植后 100 天内发病。常见的自我报告症状包括干燥和瘙痒,部分患者最初可能无症状。根据 2014 年NIH指南,生殖器 cGVHD 的严重程度通过监测诊断体征来评估,如扁平苔藓样特征、硬化性苔藓样特征和阴道瘢痕。生殖器 cGVHD 通常与其他器官(特别是口腔和皮肤)的广泛性 cGVHD 同时出现。研究表明,生殖器 cGVHD 的症状通常持续存在且无改善。如果不进行治疗,可能会出现阴道狭窄、粘连甚至阴道梗阻等并发症。
男性生殖器 cGVHD 的发生率在 5% 到 20% 之间,具体取决于研究人群,常见的报告症状包括性交疼痛和烧灼感。根据 2014 年 NIH 共识,诊断体征包括硬化性苔藓样特征、扁平苔藓样特征、包皮过紧和尿道外口瘢痕或狭窄。
靶向治疗
酪氨酸激酶抑制剂
酪氨酸激酶抑制剂(TKI),如伊马替尼、达沙替尼和尼洛替尼,是慢性髓性白血病(CML)的一线治疗药物。尽管 CML 发病的中位年龄为 67 岁,但在亚洲可低至 38.3 岁。大约 36.5% 的欧洲患者在诊断时处于生育年龄,因此 TKI 对生育力的潜在影响成为一个重要关注点。
在男性中,临床前研究表明 TKIs可能会诱导精原细胞凋亡,并降低精子密度和活动力,但似乎并不会导致大多数患者不育。J. T. Tauer 等人发现,接受长期伊马替尼治疗的 CML 男孩的睾酮和抑制素 B 水平在与年龄相关的正常范围内。Jorge E. Cortes 等人也报告称,接受达沙替尼治疗的男性患者所生育的的后代中91%健康状况良好。
在女性中,由于 TKI 的非靶向作用,其对生育力的影响更为复杂。TKI可能会损害胎盘形成和胚胎存活,而长期使用可能会降低卵巢储备功能。Anupama Rambhatla 等人观察到,在 CML 女性患者(n=361)中,只有 51% 的妊娠结果为健康婴儿;与男性患者相比,女性患者的流产率、畸形率和并发症发生率更高。因此,计划怀孕的女性建议在达到持久深度分子学反应(DMR)后停用 TKI。然而停用 TKI 治疗的患者中约 51% 会复发,其中超过 80% 的复发发生在停药后的前 6-8 个月内,从而强调了把握生育窗口期以及在治疗停止后密切监测患者的重要性。如果 BCR-ABL 水平在国际标准(IS)下上升超过 1.0%,则应恢复治疗。幸运的是,伊马替尼已在妊娠的第二和第三孕期安全使用,而对于在妊娠期间诊断为 CML 的女性,干扰素可作为替代选择。
单克隆抗体
近年来,单克隆抗体领域的进展显著提高了患者的缓解率和生存率,尤其是在晚期疾病患者中。理论上,如果这些药物不是特异性地靶向卵巢或睾丸,则不太可能引起性腺损伤或增加不孕的风险。例如,利妥昔单抗是抗CD20单克隆抗体,广泛用于治疗弥漫大B细胞淋巴瘤(NHL)、滤泡性淋巴瘤和结节性淋巴细胞为主型霍奇金淋巴瘤(HL),它通常被认为是孕妇和有生育问题的患者的安全选择。
然而,尽管临床数据有限,也有部分单克隆抗体在动物模型中显示出性腺毒性。维布妥昔单抗(BV)是一种用于治疗高危HL和某些类型NHL的CD30抗体-药物偶联物,已发现具有胚胎毒性。奥加伊妥珠单抗(IO)是一种用于联合化疗治疗费城染色体阴性急性淋巴细胞白血病的CD22单克隆抗体偶联物,在动物模型中与卵泡颗粒细胞或卵母细胞损伤及卵巢萎缩均有关。Sumiko Maristany等人报告了一例23岁的患者在接受IO治疗后出现快速发作的POI。
检查点抑制剂
检查点抑制剂(ICI)通过阻断关键的免疫调节通路来实现免疫反应,但在血液系统恶性肿瘤患者中效果有限。尽管如此,新兴的临床研究正在探索联合治疗策略,不断拓展这些药物的应用潜力。临床前证据表明,免疫检查点抑制剂(ICI)可诱导卵巢免疫病理学变化,其特征为免疫细胞浸润和炎症反应,可减少卵巢卵泡储备,并损害卵母细胞成熟和排卵。ICI还会增加流产率。此外,非人灵长类动物研究已证实,ICI暴露后睾丸重量减少;然而尚无精子组织病理学变化的报道。
目前的临床证据主要来自实体瘤患者,特别是黑色素瘤患者。伊匹单抗(Ipilimumab)的使用与垂体炎发病率相关,范围在11%到17%之间,通常表现为促性腺激素缺乏。除了中枢性性腺功能减退外,ICI相关的性腺毒性可能涉及对性腺组织的直接炎症损伤,可能导致性腺功能减退和生育力下降。报告的妊娠结局虽然罕见,但令人担忧,记录的并发症包括胎盘功能不全、HELLP综合征(溶血、肝酶升高和血小板减少)以及宫内生长受限。
对接受ICI治疗的转移性黑色素瘤患者的睾丸组织进行尸检组织病理学分析显示,生精功能受到严重破坏:86%(7例中的6例)表现出异常的生精模式,包括局灶性活跃生精、生精减少和Sertoli-cell-only综合征。尽管大多数男性患者在接受ICI治疗期间仍保持生育力,但该结果页突显了不可忽视的不孕风险,强调了治疗前进行生育力保存咨询的必要性。
目前,对于免疫检查点抑制剂(ICI)治疗期间怀孕的建议有限,主要建议为在治疗期间推迟怀孕,并在治疗结束后至少给予洗脱期五个月。
CAR-T细胞
CAR-T细胞疗法已成为B细胞血液系统恶性肿瘤患者的有效治疗方法,理论上CAR-T细胞疗法可以避免与传统化疗或放疗相关的性腺毒性,然而探索CAR-T细胞疗法对生育力长期影响的研究较少。CAR-T对生育力的潜在影响有两个方面。首先,大多数患者接受的清淋方案包括环磷酰胺,但使用的剂量(<2000 mg/m2)对性腺毒性风险较低。其次,CAR-T细胞可能通过胎盘和母乳跨代转移,尽管这种跨代转移对胎儿的影响尚不清楚。目前,尚未制定接受CAR-T细胞疗法患者的生育管理指南。通常建议在治疗后避免怀孕或生育6-12个月。John A. Ligon等人报告了7例CAR-T受者的怀孕,其中5例确认活产,另有13例患者寻求辅助生殖,结果有2例活产。虽然CAR-T细胞在减少性腺毒性方面显示出潜力,但仍需进一步研究其对生育结果和胎儿发育的影响,并制定标准化的生育指南。
蛋白酶体抑制剂
硼替佐米广泛用于治疗多发性骨髓瘤、惰性淋巴瘤和急性淋巴细胞白血病等血液系统恶性肿瘤,目前关于硼替佐米对生育力影响的临床研究较为缺乏,但临床前研究表明其可诱导性腺毒性。在雄性小鼠中,硼替佐米通过激活p53和caspases以及引发过度的氧化应激,导致生殖细胞凋亡和长期的睾丸功能障碍。在雌性小鼠中,一方面硼替佐米预处理可作为一种预防性卵巢保护措施,以防止由多柔比星引起的急性卵巢损伤;另一方面,硼替佐米特异性地靶向卵巢颗粒细胞,加速卵巢储备的耗竭,可能导致卵巢早衰。
目前关于靶向治疗(包括BTK抑制剂和JAK1抑制剂)对生育力影响的临床数据存在显著空白。应进一步开展全面的临床研究,以彻底评估这些治疗的潜在生殖影响。
不同性别的生育力保存
新型治疗策略的发展为解决基础性性腺毒性问题提供了机会。例如,ABVD方案作为一线治疗方案,降低了HL患者无精症和少精症的风险;PET驱动的策略也缩短了晚期HL患者的强化疗时间,同时不影响生存率。事实上,这些优化的化疗方案并未降低患者的生存率。此外,将靶向药物与化疗相结合已成为一线肿瘤治疗的常见方法,例如达沙替尼联合贝林妥欧单抗的方案治疗费城染色体阳性ALL患者的估计3年OS率达到80%。在FL患者中,来那度胺联合利妥昔单抗已成为一种可行的无化疗替代方案。
对于血液系统恶性肿瘤患者而言,生育力保存仍存在重大挑战。新诊断的患者应从首次治疗开始就应被告知一线治疗的性腺毒性风险,并接受生育咨询。鉴于疾病可能进展,及时转诊进行生育力保存至关重要。生育力保存方法的选择应基于患者的年龄、疾病阶段、治疗方案、伴侣状况和个人偏好。建立一个包括血液科医生、泌尿科医生、儿科医生、妇科医生、心理学家和患者在内的多学科团队,对于有效的生育管理至关重要。
有多个障碍可能阻碍生育力保存:医疗保健提供者可能缺乏对生育风险和选择的认识,导致错过患者咨询和转诊的机会;患者通常面临诸如医疗状况不佳、伦理问题、疾病治疗的紧迫性和生育力保存费用等挑战。幸运的是,白血病或淋巴瘤的一线治疗通常不会导致永久性不孕,从而为缓解期的生育力保存提供了机会。以下是血液系统恶性肿瘤患者的当前生育力保存选择。
女性患者
女性血液恶性肿瘤患者保留生育力较为复杂,需要考虑患者的年龄、疾病类型、身体状况和生育愿望。根据这些因素有不同的选择。
胚胎或卵母细胞冻存
胚胎或卵母细胞冷冻保存是标准的生育力保存方法,多项研究支持其在血液系统恶性肿瘤患者中的可行性。该过程包括卵巢刺激、卵泡抽吸以及成熟卵母细胞或胚胎的冷冻保存,其优势包括经过验证的成功率、能够在月经周期的任何时间点启动卵巢刺激,以及可进行胚胎植入前遗传学诊断。在一系列接受胚胎冷冻保存的肿瘤患者中,临床妊娠率和活产率分别为 49.0% 和 35.3%。K. Kato 等人报告称,在 193 例未婚且患有血液系统恶性肿瘤的女性中,卵母细胞冷冻保存的成功率为 80.3%。在随后进行卵母细胞解冻用于体外受精(IVF)的 14 例女性中,成功胚胎移植率和活产率分别为 71.4% 和 50%。
冷冻保存方法、患者年龄和冷冻卵母细胞数量等因素都会影响临床结果。与慢速冷冻相比,玻璃化冷冻技术显著提高卵母细胞和胚胎的存活率,以及妊娠率和受精率。年轻女性(<35 岁)通常预后更好,每冷冻 5 个卵母细胞的活产率从 15.4% 增加到 8 个卵母细胞的 40.8%。然而在≥36 岁的女性中,随着卵母细胞数量的增加,活产率的提升速度较慢,并且始终低于年轻女性。
该技术也存在局限性。首先,激素刺激会将化疗推迟 10-12 天,这对于需要紧急缓解的女性可能不可接受。其次,青春期前的患者不符合这些方法的条件。第三,刺激过程中高水平的雌激素会增加血栓形成的风险。第四,血细胞减少症和感染等情况可能使侵入性卵母细胞获取成为禁忌。最后,胚胎冷冻保存需要男性伴侣或供者精子,这可能带来伦理挑战。
卵巢组织冻存
在几项研究中,卵巢组织冷冻保存已被证明对血液系统恶性肿瘤患者是可行且安全的,不再被视为实验性方法。该程序通过腹腔镜手术收集并冷冻卵巢皮质组织,在肿瘤治疗后,移植选项包括原位(orthotopic)移植或异位(heterotopic)移植;原位移植可使95%的患者恢复卵巢功能,异位移植虽然较为罕见,但当因强烈放疗导致盆腔血管受损时,可能采用该方法。
卵巢组织冷冻保存是青春期前女性唯一可用的生育力保存方法,且无需卵巢刺激,从而避免了肿瘤治疗的延迟。通过该方法获得的活产率与卵母细胞或胚胎冷冻保存相当,并且可以恢复正常的激素环境。在Marie-Madeleine Dolmans等人的研究中,285例接受卵巢组织冷冻保存和移植的女性中,26%实现活产,该比例与其他研究报告相似。值得注意的是,卵巢组织冷冻保存前化疗似乎不会影响卵巢功能的恢复,但高剂量盆腔放疗会降低妊娠率。
卵巢组织冷冻保存的局限性包括需要进行侵入性手术,这对于有血细胞减少症或感染的患者来说具有挑战性。此外,移植后的缺氧和氧化应激会显著减少卵泡储备。在血液系统恶性肿瘤患者中,卵巢组织中存在恶性细胞可能会带来复发的风险。对于最近被诊断为急性白血病的患者,不推荐进行卵巢组织冷冻保存,而在缓解期筛查卵巢组织的安全性仍存在争议。尽管有成功案例,但与HL患者相比,急性白血病患者有更高的恶性细胞污染风险。
促性腺激素释放激素类似物
促性腺激素释放激素类似物(GnRHas)可以通过抑制卵巢功能来保护生育力,尽管其具体机制尚不明确。在乳腺癌患者中,化疗前或化疗期间使用GnRHa可降低POI风险,并改善生育前景。然而对于血液系统恶性肿瘤患者,其获益仍存在争议。K. Behringer 等人未观察到在接受 GnRHa 治疗的晚期HL患者中对 POI 有保护作用,在HSCT幸存者中也观察到类似结果,然而有研究表明淋巴瘤患者可能从中受益。此外,GnRHas 可能缓解雌激素缺乏症状,并防止因血小板减少症导致的严重出血,提供潜在的临床优势。通常GnRHas 不推荐作为唯一的生育力保护方法,但可与其他选择一起使用,以获得更大获益。
体外成熟
体外成熟(IVM)涉及使来自小窦卵泡的未成熟卵母细胞成熟,可进行或不进行体外受精(IVF),随后进行冷冻保存。该技术适用于更广泛的患者群体,包括青春期前的女性。尽管 IVM 的活产率通常低于传统的辅助生殖技术(ART),但它具有减少或无需卵巢刺激以及侵入性更小等优势。
卵巢转位和性腺屏蔽
卵巢移位术(Ovarian transposition)是为接受高剂量盆腔放疗的患者提供的一种可行选择,这种手术通过将卵巢重新定位到盆腔侧方或子宫后方来减少辐射暴露。Monica Terenziani等人报告称,11例接受该手术的HL女孩后来在无需人工授精的情况下共实现14次妊娠。性腺屏蔽(shielding)是另一种在盆腔放疗期间保护卵巢的方法。然而由于许多治疗方案还涉及高剂量化疗,卵巢移位术和卵巢屏蔽均很少使用。
其他有希望的策略
未来的生育力保存策略包括人工卵巢构建、卵巢原始卵泡激活以及多能干细胞或保护剂的使用。人工卵巢的生成包含从卵巢组织中分离卵泡,并将其植入卵巢支架中。3D培养和生物工程学的进步使得利用卵巢类器官更好地模拟卵泡生长和卵母细胞成熟成为可能。在小鼠模型中,已证明分离的原始和次级卵泡可以在卵巢支架中存活和生长,且3D打印卵巢植入物的植入已恢复卵巢功能。
原始卵泡的体外成熟提供了一种避免卵巢组织冷冻保存中观察到的残留恶性细胞风险的方法。冷冻保存的原始卵母细胞可以在体外成熟,产生具有生育力的减数第二次分裂中期(MII)卵母细胞。
多能干细胞可以被诱导发育成原始生殖细胞样细胞(PGCLCs)和卵原细胞样细胞。Takashi Yoshino等人证明,这些干细胞可以重建卵巢间质细胞环境,可能作为小鼠胚胎卵巢组织的替代品。这样的进展可能会导致进一步的体外卵巢重建技术。
鞘氨醇-1-磷酸(S1P)在防止环磷酰胺(CPM)诱导的人类卵巢组织中卵泡丢失方面显示出潜力。其他潜在的保护剂,包括mTOR抑制剂AS101和伊马替尼,通过PI3K/Akt/mTOR、PI3K/PTEN/Akt和ABL/TAp63等通路发挥作用。粒细胞集落刺激因子(G-CSF)可通过保护卵巢血管减少卵泡丢失并延缓POI发作。尽管他莫昔芬对小鼠有保护作用,但一项随机对照试验表明,它在人类中没有益处,甚至可能损害受精和胚胎质量。目前,这些保护剂尚未应用于血液系统恶性肿瘤患者的生育力保存。
男性患者
在青春期或成年男性中,保存生育力的首选方法是在开始治疗前冷冻保存精子。精子的收集可以通过手淫、辅助射精或手术精子获取来实现;辅助射精技术包括阴茎振动刺激(PVS)和电射精(EEJ),而手术方法包括睾丸精子抽吸(TESA)和睾丸精子提取(TESE)。据精子库报告,血液系统恶性肿瘤患者的精子收集成功率超过80%。无精症和精液质量差是成功收集的主要挑战。当患者希望生育时,可以使用辅助生殖技术,如宫内人工授精(IUI)、体外受精(IVF)或卵胞浆内单精子注射(ICSI)。
对于青春期前的男孩,睾丸活检是保存生育力的唯一选择。然而未成熟睾丸组织或精原干细胞(SSC)的冷冻保存仍处于实验阶段,存在组织被恶性细胞污染的风险。此外,恢复成年期生育力的有效方法尚未开发出来。睾丸组织移植、SSC自体移植和SSC体外成熟在临床上的应用尚未实现。
重要的是,青春期前患者的生育力保存仍存在严峻的临床挑战。对于接受放疗的患者,包括卵巢移位在内的性腺屏蔽可以有效减轻辐射引起的性腺毒性,对于其他患者,性腺组织冷冻保存目前是唯一可行的临床选择。然而仍存在显著的局限性;例如,在女性患者中,卵巢组织移植的活产率约为30%,并存在组织损伤和功能障碍的风险。在男性患者中,尽管睾丸组织冷冻保存后自体移植或体外精子发生已在灵长类动物模型中实现功能性精子生成,但通过该方法实现完全的人类精子发生仍处于实验阶段,迄今为止尚未有活产的报道。保护剂、干细胞技术、体外激活(IVA)、3D生物打印和CRISPR基因编辑技术在保存青春期前患者的生育力方面显示出巨大潜力,但这些技术大多仍处于实验阶段,需要进一步的研究和临床验证。
未来展望
血液系统恶性肿瘤治疗对生育力的影响较复杂。HSCT通常涉及大剂量烷化剂或放疗,可能导致不孕和内分泌紊乱。然而随着化疗方案的优化和靶向治疗及免疫治疗的引入,治疗相关性腺毒性已逐渐降低。目前关于新药对生育力和妊娠结局的影响主要来自病例报告和登记研究,关于表观遗传继承和潜在跨代效应的不确定性仍然存在。对于所有有生育问题的青春期前儿童和年轻成人,早期进行生育咨询和在诊断时及时转诊至关重要。为高风险不孕患者提供生育力保存选择,并在治疗后密切监测生育指标,同样至关重要。
生育力保存的选择仍然有限,特别是对于青春期前的儿童和女性,目前尚无针对青春期前儿童的标准生育力保存方法。睾丸或卵巢组织冷冻保存存在恶性细胞污染和移植过程中感染的风险。此外,成功的组织移植依赖于原位部位皮下血管网络的形成。体外成熟(IVM)或干细胞自体移植是潜在的替代方法,但确保精子和卵子的遗传和表观遗传完整性仍存在挑战。能够保护生育力并维持内分泌功能的保护剂也显示出潜力,然而使用GnRHas抑制卵巢功能对于青春期前儿童来说并不可行,从而凸显了对保护剂(如mTOR抑制剂、伊马替尼和G-CSF)进行进一步临床研究的必要性。
女性患者在保存生育力方面面临特殊挑战。标准选择通常会导致治疗延迟,对于需要紧急治疗的患者,其身体状况可能限制侵入性手术的可行性。此外,缺乏可靠的预测女性生育力的生物标志物。尽管AMH和AFC用于评估卵巢储备,但它们预测卵巢早衰风险的能力有限。生育预测模型的开发应考虑患者年龄、疾病状态、身体状况、治疗方案和相关生物标志物等因素,以提供更个性化的生育指导。个性化咨询应包括关于保存选择、生育窗口期和治疗后监测计划的信息。
目前,利用机器学习为血液疾病患者创建生育预测模型的研究有限。例如,Steven A. Hicks开发了一种基于机器学习的预测模型,该模型基于精子视频和参与者数据,将组学技术与深度学习相结合,可进一步改善患者的生育评估、管理和保存。机器学习已通过卵泡液的代谢分析用于诊断卵巢储备功能下降,并在生育力保存和辅助生殖领域(包括精子选择)显示出潜力。
性功能障碍也值得关注,因其可显著影响患者生活质量(QoL)。尽管临床数据有限,但许多研究表明这些患者的QoL低于同龄人。有报告表明性功能障碍的患病率增加,主要归因于大剂量化疗、移植物抗宿主病(GVHD)、人乳头瘤病毒(HPV)再激活以及其他导致身体和心理挑战的并发症。生殖并发症可能包括性欲减退、勃起功能障碍、性交疼痛和生殖器GVHD。Zhuoyan Li等人报告称,在女性HSCT受者中,77%的人在一年内至少在一个性健康领域出现问题。因此,性功能障碍的早期发现和治疗对于提高患者的QoL至关重要。
总之,解决生育问题至关重要,实现最佳的个性化治疗需要多学科的密切合作。
参考文献
Wang X, et al.Evaluation and preservation of fertility in patients with hematologic malignancies.Cancer Lett . 2025 Feb 19:616:217569. doi: 10.1016/j.canlet.2025.217569.


