腹膜转移的胃食管腺癌,原发灶与转移灶的PD-L1表达一致性如何?
时间:2025-03-03 12:16:24 热度:37.1℃ 作者:网络
在转移性胃食管腺癌(mGEA)中,程序性死亡配体1(PD-L1)表达可作为免疫检查点抑制剂(ICIs)治疗反应的预测生物标志物。腹膜是最常见的转移部位之一,与不良预后和明显较低的ICIs临床疗效相关。本研究探索了mGEA中PD-L1表达的异质性,分析了原发性肿瘤与配对腹膜转移灶(PMs)之间,以及系统治疗前后,PD-L1表达的一致性。对福尔马林固定石蜡包埋的肿瘤组织进行PD-L1(SP263)免疫组化检测,评估PD-L1联合阳性分数(CPS)。使用CPS阈值1和5报告结果。分析了22例mGEA患者的原发性肿瘤和配对的PM样本。当CPS阈值为1时,PD-L1 CPS的一致性为54.5%;当CPS阈值为5时,一致性为72.7%,这突出了空间异质性。值得注意的是,当使用CPS≥5的阈值时,PD-L1阳性的原发性肿瘤样本,其配对的PM样本均非阳性。此外,还观察到与化疗(联合免疫治疗)相关的潜在的PD-L1表达的时间异质性,当使用CPS≥5的阈值时,一致性为55.6%。本研究表明,在PM mGEA中,PD-L1表达具有空间异质性和潜在的时间异质性,在较低的CPS阈值下,这种异质性更为明显。这种异质性使其作为预测ICIs治疗结局的生物标志物的作用变得复杂。同一患者中原发性肿瘤样本与配对的PM样本之间PD-L1 CPS表达的不一致率较高,提示如果有其他疾病部位的代表性组织,腹膜样本不应作为PD-L1评估的唯一来源。
研究背景
胃癌是全球第五大常见癌症,也是第四大癌症死亡原因。预计到2040年,全球每年的胃癌负担将增加,主要在较年轻成人中。在欧洲,尽管免疫检查点抑制剂(ICIs)在PD-L1筛选的转移性胃食管腺癌(mGEA)患者中取得了积极成果,但5年生存率仍然较低(约25%)。
腹膜是最常见的转移部位之一(在确诊时,15%-30%的病例存在腹膜转移),并且在高达60%的接受手术切除的胃癌患者中,是唯一的复发部位。腹膜转移(PMs)也是该疾病最强烈的预后不良因素之一。药代动力学研究表明,由于腹膜-血浆屏障会减少从血浆进入腹膜肿瘤结节和腹水中的细胞毒性药物的吸收,PMs对全身化疗的耐药性是可以预见的。这一模式似乎也适用于关键的ICIs联合化疗方案:最近的生物学数据表明,PMs患者的免疫细胞表型发生广泛改变,向B细胞和免疫抑制性巨噬细胞极化转变,这似乎促进了局部进展和侵袭性。事实上,CheckMate 649研究的数据表明,在PD-L1联合阳性分数(CPS)≥5的主要终点人群中,化疗联合纳武利尤单抗显著提高了总生存期(OS),但PMs患者亚组似乎从该策略中获益较少。
然而,PMs对ICIs敏感性可能降低的机制尚未完全阐明。最近的文献证据表明,PMs mGEA患者的原发性肿瘤样本的组织切片中广泛存在PD-L1表达(例如,45.6%的原发性肿瘤样本PD-L1 CPS≥1,14.3% PD-L1 CPS≥10)。尽管如此,也有研究描述了胃癌患者中PD-L1表达存在显著的空间(原发性肿瘤与远处转移之间)和时间(治疗前后)不一致性。然而,现有研究未聚焦于PMs,在描述PD-L1异质性的研究中,PMs的代表性不足。
尽管目前缺乏mGEA腹膜样本中PD-L1表达的具体数据,但从生物标志物表达的固有差异角度,探索潜在的耐药机制是合理的。因此,本研究旨在描述mGEA患者中,PMs相比配对的原发性肿瘤,PD-L1表达的空间和时间异质性。
研究结果
患者和组织样本特征
本研究纳入了22例有原发性肿瘤及相关PMs样本可供分析的mGEA患者。筛选流程见图1,患者基线特征见表1。最常见的组织学类型为具有印戒细胞特征的低分化腺癌(54.5%),腺癌患者占45.5%。所有患者均为HER2阴性,且错配修复(MMR)正常。17例(77%)患者在诊断时存在同时性转移性疾病。22例患者中,13例(59.1%)在基线时(治疗前)采集了配对的原发性肿瘤和PM样本。此外,20例(91%)患者在诊断性腹腔镜检查时确定了PM的腹膜癌指数评分,中位评分为9.5(范围0-21)。7例(31.9%)患者接受了腹膜肿瘤细胞减灭术,其中6例手术在完成包含奥沙利铂和氟嘧啶(5-氟尿嘧啶、FOLFOX或卡培他滨(XELOX))的一线化疗后进行。在全部患者中,仅4例(18.2%)接受了纳武利尤单抗联合化疗作为一线治疗,16例(81.8%)接受了仅化疗。
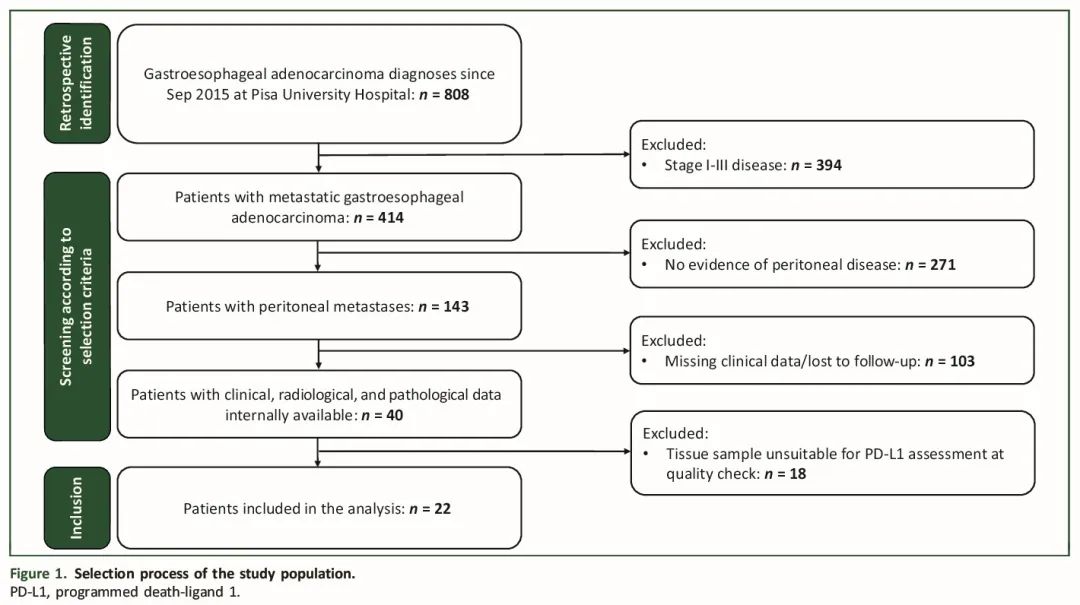
图1
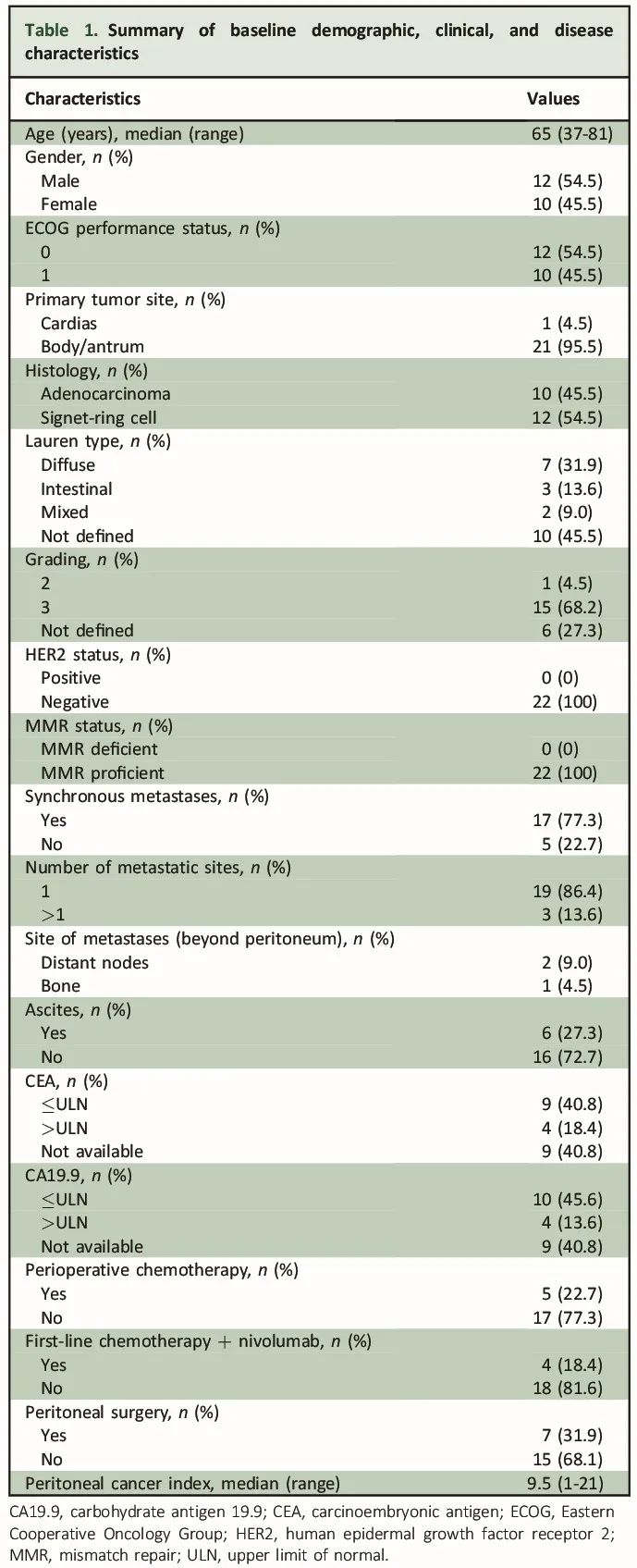
表1
所有PM样本均取自手术切除的腹膜结节。以 5作为PD-L1 CPS阈值时,22例患者中有1例(4.5%)被归为阳性;以1为阈值时,12例患者(54.5%)为阳性。9例患者(40.9%)的原发性肿瘤样本通过内镜活检采集,13例患者(59.1%)为手术样本。分析的样本类型对原发性肿瘤PD-L1表达评估结果无影响。以 5作为PD-L1 CPS阈值时,2/9例(22.2%)活检样本、3/13例(23.1%)手术样本为阳性(P = 0.963)。以1为阈值时,3/9例(33.3%)活检样本、3/13例(30.8%)手术样本为阳性(P = 0.899)。
在分析时,中位随访时间为34.6个月。从GEA初始诊断开始计算,总体中位OS为21.5个月(95% CI 12.6-46.3个月)。对于转移性疾病患者,中位OS为13.2个月(95% CI 11.5-24.9个月)。根据原发性肿瘤的PD-L1 CPS状态,使用两个阈值中的任何一个,均未观察到OS存在显著差异(PD-L1 CPS≥5 vs <5:风险比1.02,95% CI 0.22-4.65,P = 0.98;PD-L1 CPS≥1 vs <1:风险比0.75,95% CI 0.19-2.97,P = 0.70)。在接受纳武利尤单抗联合化疗的4例患者中,均仅存在同时性腹膜转移。在该亚组中,中位PFS和OS分别为5.6个月和9.7个月。值得注意的是,这4例患者的结果均不一致:原发性肿瘤的CPS在所有病例中均≥5,而PMs的CPS在所有病例中均<5。该亚组对治疗的客观缓解模式存在异质性,无论是整体还是分别考虑每个疾病部位时都是如此。
PD-L1的空间异质性
原发性肿瘤样本的PD-L1 CPS范围为0-18,中位CPS为1.25。相比之下,PM样本的PD-L1 CPS范围为0-6.5,中位CPS为1。5例(22.7%)原发性肿瘤的PD-L1 CPS≥5,而PM中仅有1例(4.5%)PD-L1 CPS≥5(P = 0.079)。12例(54.5%)患者原发性肿瘤和PM样本的PD-L1 CPS均呈阳性。
对所有22例患者的原发性肿瘤和PMs的PD-L1表达进行了配对比较。PD-L1空间异质性的结果总结在表2和表3中。图2展示了显示免疫组化PD-L1空间异质性的代表性配对样本。以5为CPS阈值时,配对的原发性肿瘤和PMs的PD-L1状态在72.7%(16/22)的病例中一致。在17例PD-L1阴性的原发性肿瘤中,16例(94%)的PMs也PD-L1 CPS<5。相反,在5例PD-L1阳性的原发性肿瘤中,没有一例的PMs也PD-L1 CPS≥5。以 1为CPS阈值时,一致性为54.5%(12/22)。在10例PD-L1阴性的原发性肿瘤中,5例(50%)的PMs也为PD-L1阴性。在12例PD-L1阳性的原发性肿瘤中,7例(58%)的PMs也为PD-L1阳性。基于原发性肿瘤样本类型(活检或手术样本)的空间异质性分析得到了相似的结果。

表2
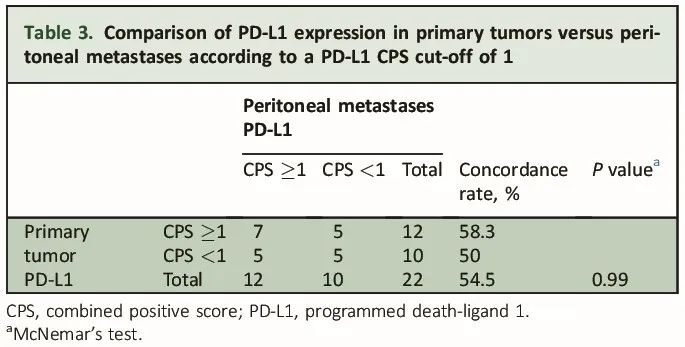
表3
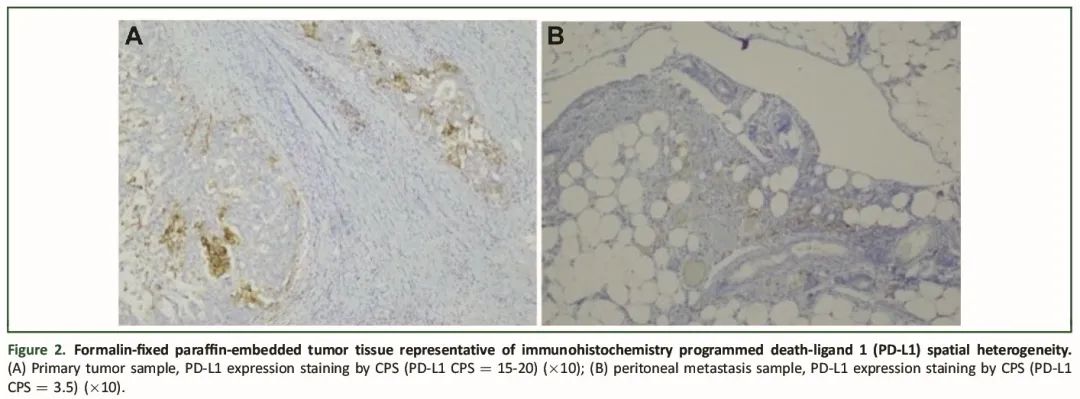
图2
值得注意的是,在4例病例中,有2个或以上同时切除的来自不同腹膜部位的转移灶可供分析。我们观察到3例患者的PD-L1 CPS结果一致:2例的PD-L1 CPS为1,1例的PD-L1 CPS为4。然而,在1例患者中,我们发现两个不同的腹膜种植灶的结果不一致,PD-L1 CPS评分分别为0和3。有趣的是,该患者的原发性肿瘤PD-L1呈阳性,CPS为11。
考虑到采集时间对空间异质性的潜在影响,我们还探索了在同一时间段内采集的原发性肿瘤和PM样本(即同时进行切除和/或活检的同时性病灶)之间的一致性状态。13例患者纳入该亚组分析。结果与总体人群的结果一致。以5为CPS阈值时,一致性为76.9%。特别是,原发性肿瘤和PMs的PD-L1 CPS均<5的样本一致性达到100%。然而,所有3例原发性肿瘤PD-L1 CPS≥5的病例,其PM均为阴性。以1为CPS阈值时,一致性为69.2%。具体而言,PD-L1 CPS≥1组的一致性为62.5%,PD-L1 CPS<1组的一致性为80%。
PD-L1的时间异质性
在9例患者中,进行PD-L1检测的原发性肿瘤和PM样本分别是在接受系统化疗之前和之后收集的。其中2例患者接受了化疗联合ICI。
PD-L1时间异质性的研究结果见表4和表5。以5为CPS阈值时,治疗前后PD-L1阳性的一致性为55.6%(5/9)。4例治疗前PD-L1 CPS≥5的肿瘤在治疗后PD-L1 CPS<5,而治疗前PD-L1 CPS<5的肿瘤在治疗后均未转为PD-L1阳性。以1为CPS阈值时,一致性降至33.3%(3/9)。2例治疗前PD-L1阴性的肿瘤在治疗后变为PD-L1阳性,而4例治疗前PD-L1阳性的肿瘤在治疗后变为PD-L1阴性。
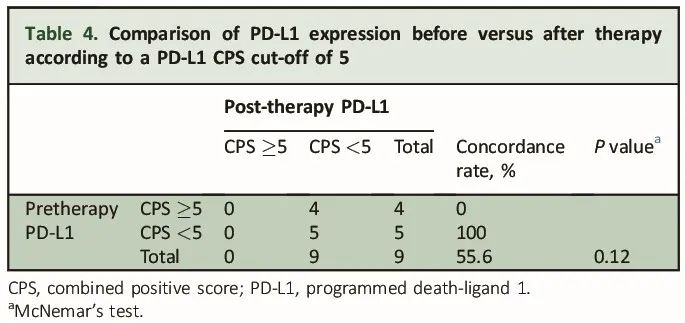
表4
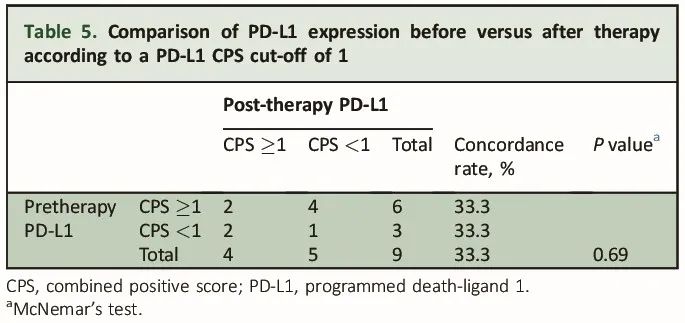
表5
讨 论
本研究对mGEA中PD-L1表达的异质性进行了研究,对比了原发性肿瘤和PMs。我们发现,空间异质性对PMs来说可能是一个关键问题,正如之前在其他疾病部位所证实的那样:事实上,当使用5作为CPS阈值时,我们发现原发性和腹膜样本之间的一致性为72.7%,提示大约四分之一的病例可能出现PD-L1结果不一致的情况。值得注意的是,当CPS阈值为5时,所有PD-L1阳性的原发性肿瘤,其配对的PMs均为PD-L1阴性,而在PD-L1阴性的原发性肿瘤中,原发性病灶和PMs之间的一致性为94.1%。当使用1作为CPS阈值时,一致性较低(54.5%),并且观察到PMs阳性状态的差异更大,50%的PD-L1阴性原发性肿瘤样本其PMs呈阳性,反之为42%。即使将分析限制在同时从两个肿瘤部位采集的样本(从而限制了在此期间接受的系统治疗可能产生的混杂效应),结果也没有改变。此外,当评估同一患者的不同PMs时,结果没有显著变化,只有四分之一的病例显示不同的腹膜结节具有不同的PD-L1表达。关于可能存在的时间异质性,当CPS阈值为5时,我们发现治疗前后肿瘤的PD-L1状态一致性为56%。特别是,所有治疗前PD-L1阳性的样本,其配对的治疗后PMs均变为阴性。
免疫疗法彻底改变了mGEA的系统治疗格局,尤其是在一线治疗中。CheckMate 649研究评估了在一线化疗(XELOX或FOLFOX)中加入抗PD-1单克隆抗体纳武利尤单抗的疗效,使得该方案获得EMA批准用于HER2阴性疾病的一线治疗。随后其他使用不同药物的试验结果进一步巩固了这一批准,甚至在HER2阳性疾病中。在上述所有研究中,生存获益的程度随着PD-L1表达的增加而增加,而在PD-L1阴性亚组中,添加纳武利尤单抗或帕博利珠单抗带来的额外获益非常有限(如果有的话)。因此,PD-L1表达成为mGEA中化疗联合免疫治疗最有价值的预测生物标志物,而MSI/MMR状态是唯一预测能力更强的因素。此外,亚组分析以及不同的临床研究表明,在GEA中,PMs和腹水与ICIs治疗获益较低相关,即使在MSI-H/dMMR亚组中也是如此。
然而,由于使用不同药物的不同试验采用了不同的阈值和评分系统,存在观察者间和实验室间差异,以及主要的空间和时间异质性,PD-L1 CPS仍被认为是一种不太理想的生物标志物。
PD-L1表达的空间异质性已在多种癌症类型中观察到,这归因于肿瘤样本不同切片中PD-L1染色的异质性,以及原发性肿瘤和转移灶之间PD-L1表达的差异。在这方面,Ye等人认为,对于无法手术的胃癌患者,需要超过五个活检样本来评估PD-L1表达状态,确定哪些患者可能从免疫治疗中获益。在GEA中,无论是可切除疾病还是转移性疾病,都观察到了PD-L1表达的显著空间异质性。Gao等人发现,在切除的肿瘤中,区域淋巴结转移灶的PD-L1阳性率高于配对的原发性肿瘤。相比之下,Zhou等人表明,在晚期阶段,远处转移灶的PD-L1阳性率低于配对的原发性肿瘤,当CPS阈值为1和10时,一致性分别为61%和84%。有趣的是,PD-L1一致性与转移部位没有明显的相关性。原发性肿瘤和PMs之间的一致性在阈值为1时为67%。
在空间异质性方面,我们的结果与Zhou及其同事报告的一致。然而,他们没有观察到化疗后PD-L1状态改变的明显模式。最近,有研究描述了与化疗给药相关的PD-L1表达的时间异质性,主要表明治疗后PD-L1表达降低。本研究观察到了明显的时间异质性,当CPS阈值为5时,治疗前后肿瘤的PD-L1状态一致性为56%。值得注意的是,所有治疗前PD-L1阳性的样本其配对的治疗后PMs均变为阴性。
PD-L1表达的空间和时间异质性最终可能会影响包含ICIs的方案的治疗结果。由于我们病例系列中接受ICIs治疗的患者数量较少,我们无法提供这种相关性的证据。然而,我们研究中接受纳武利尤单抗联合化疗的4例患者,其原发性肿瘤和PMs之间存在PD-L1差异。他们不同肿瘤部位的客观缓解情况不同,并且与CheckMate 649研究相比,PFS和OS结果更低,这突出了即使采用免疫治疗,腹膜转移的预后仍然较差。
据我们所知,本研究是首个同时报告mGEA空间和时间异质性,且专门关注PMs的研究。然而,必须指出一些局限性。首先,这是一项单中心回顾性研究,样本量较小,因此需要在更大的独立队列中进行验证。其次,22例患者中只有13例在基线时有配对的原发性肿瘤和PMs样本。因此,在接受系统治疗的患者中观察到的原发性肿瘤和PMs之间PD-L1状态的差异,不应仅仅解释为时间异质性(由治疗选择压力引起),还应考虑空间异质性(由于原发性肿瘤和PMs的微环境不同)。此外,我们的研究无法明确确定PD-L1异质性是否导致对ICIs的耐药性,因为只有4例患者接受了含纳武利尤单抗的方案,且结果相互矛盾。因此,需要对接受ICIs治疗的患者进行更大规模的研究,以及对随机试验进行事后分析。此外,在我们的研究中,40.9%的原发性肿瘤样本通过内镜活检获得,这使我们无法研究原发性病灶内的肿瘤异质性。最后,我们的队列包括自2015年起接受治疗的患者。众所周知,与许多其他通过IHC评估的生物标志物一样,PD-L1表达可能会随着时间而变化,这在很大程度上是由于组织存储条件。因此,我们专注于一个机构在这一时间段内收集的样本,确保固定方案和样本存储实践多年来保持一致。
我们的分析证实了PMs与配对的原发性胃食管肿瘤之间,在PD-L1 CPS表达方面存在空间异质性以及潜在的时间异质性。无论生物标志物阈值如何,这种差异都会出现,至少四分之一的患者结果不一致。具体而言,我们发现,所有原发性肿瘤PD-L1阳性的患者,其PMs均为PD-L1阴性。这些发现提示,仅依靠腹膜样本进行PD-L1评估可能存在问题。因此,应在PMs患者中纳入可评估的原发性肿瘤样本(活检或手术样本)。由于原发性肿瘤和远处转移灶中足够的材料对于GEA生物标志物评估至关重要,我们建议,如果PMs是唯一可用于PD-L1评估的样本,应考虑对原发性肿瘤(如果存档组织不可及或不足以进行IHC)或其他转移部位进行再次活检。在这方面,内镜活检数量和部位应遵循指南和建议。未来需要更大队列的研究来证实我们的发现,确定评估PD-L1表达的最佳解剖部位和时间。
参考文献:
V. Massa, F. Signorini, F. Salani, M.E. Filice, G. Grelli, P. Lippolis, P. Faviana, V. Genovesi, S. Santi, C. Vivaldi, S. Cesario, A. Bertolucci, C. Cremolini, V. Nardini, G. Masi, C. Ugolini, L. Fornaro, Concordance of PD-L1 status in primary gastroesophageal adenocarcinoma and matched peritoneal metastases: a single institution study, ESMO Gastrointestinal Oncology, Volume 5, 2024, 100089, ISSN 2949-8198, https://doi.org/10.1016/j.esmogo.2024.100089.



