Science:华山医院郁金泰团队首次发现帕金森病全新治疗靶点FAM171A2
时间:2025-02-22 12:10:29 热度:37.1℃ 作者:网络
近年来,随着全球人口老龄化加剧,帕金森病这一神经退行性疾病的发病率不断上升,已成为仅次于阿尔茨海默病的第二大常见神经退行性疾病,严重影响患者的运动功能和日常生活。全球帕金森病患病人数预计将从2015年的700万左右增至2040年的1300万,我国帕金森病患者总数约占全球一半。帕金森病的典型症状包括震颤、肌肉僵直、运动迟缓以及平衡障碍,其病理机制主要涉及中脑黑质神经元丢失及病理性α-突触核蛋白异常聚集,这一过程可能在患者出现运动症状前十几年就已悄然发生。
传统药物和手术治疗都只是针对帕金森病的症状进行治疗,不能延缓疾病进展,因而进一步研究帕金森病致病的深层原因并开展针对性治疗,成为全球相关领域科学家竞相探索的战略高地。
病理性 α-突触核蛋白(α-Syn)在不同脑区聚集介导了帕金森病的疾病进展。聚集的 α-Syn 蛋白形成纤维,以朊病毒样(Prion-like)方式发挥作用,在大脑的不同区域传播 α-Syn 病理,然而,其在神经元之间传递的分子机制,目前仍不清楚。
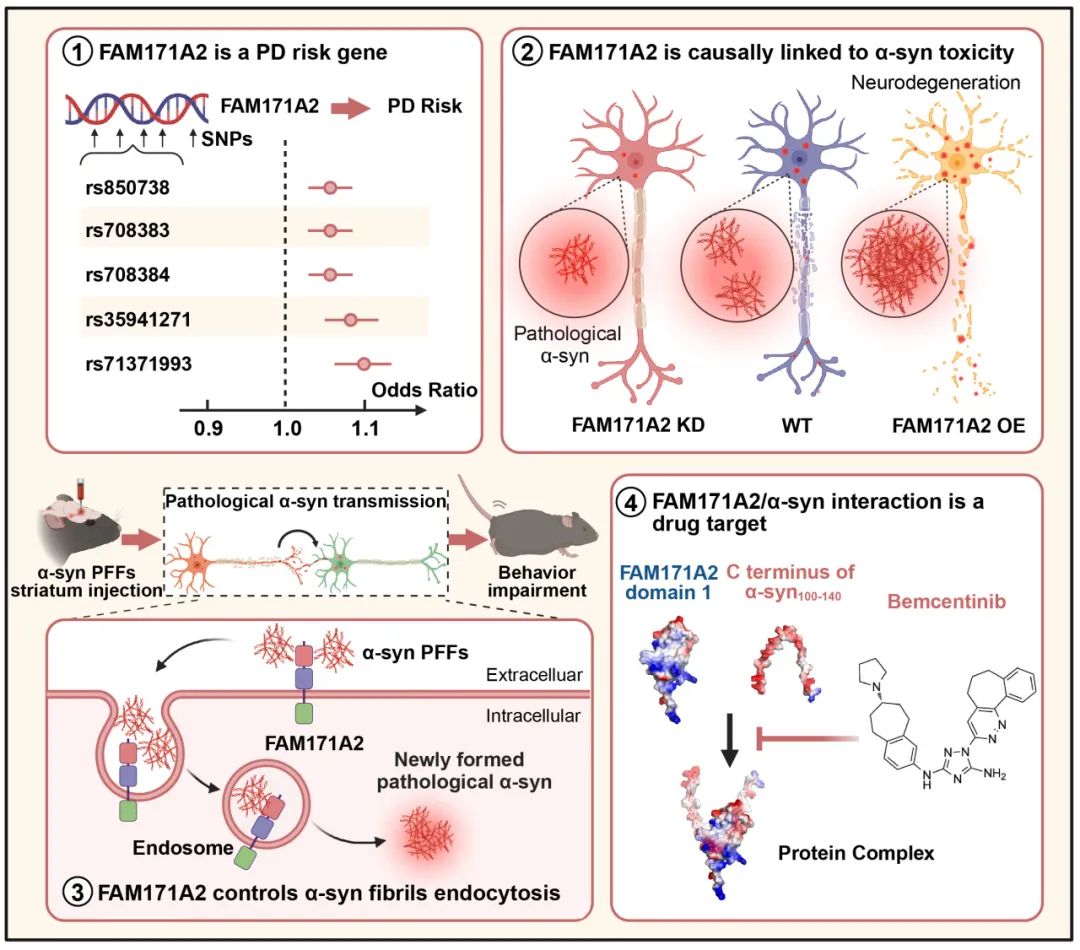
在这一背景下,复旦大学附属华山医院郁金泰团队经过5年的临床和基础研究,取得了重大科研突破——全球首次发现了帕金森病全新治疗靶点FAM171A2。研究团队通过大规模人群全基因组关联分析,确定FAM171A2为帕金森病风险基因。FAM171A2编码的神经元细胞膜蛋白此前功能尚不明确,而该团队的系列研究首次证实其在病理性α-突触核蛋白的传播中发挥了关键作用。
2025年2月20日,复旦大学附属华山医院郁金泰教授团队联合复旦大学脑科学转化研究院袁鹏教授及中国科学院上海有机化学研究所刘聪教授(博士后吴凯敏为第一作者),在国际顶尖学术期刊 Science 上发表了题为:Neuronal FAM171A2 mediates α-synuclein fibril uptake and drives Parkinson’s disease 的研究论文。该研究首次发现了帕金森病(PD)的全新治疗靶点——FAM171A2,并利用基于人工智能的蛋白质结构预测和虚拟筛选技术,成功找到了具有潜在治疗作用的小分子化合物。

研究团队通过对超过 100 万样本的大规模全基因组关联分析(GWAS),发现 FAM171A2 基因的 5 个突变(例如rs850738、rs708384)与帕金森病风险显著相关。帕金森病患者的脑脊液(CSF)中 FAM171A2 蛋白水平升高,且与 α-Syn 病理标志物呈负相关,提示其参与了 α-Syn 的异常聚集。
进一步实验验证显示,过表达 FAM171A2 会促进 α-Syn 纤维的被神经元内吞,加剧病理扩散(例如向黑质、纹状体的扩散)和运动功能障碍。而敲低 FAM171A2 能够减少 α-Syn 纤维的内吞,保护多巴胺能神经元,从而改善小鼠的运动表现。研究团队在小鼠神经元中特异性敲除 FAM171A2,进一步验证了神经元来源的 FAM171A2 在 α-Syn 病理传播中是必要的。FAM171A2像“智能识别门”一样,可选择性地结合病理性α-突触核蛋白,并携带其进入到神经元中,诱导神经元内单体形式的α-突触核蛋白发生错误折叠,造成神经元死亡和其在神经元间的传播。
从机制上来说,FAM171A2 蛋白的胞外结构域 1 通过静电力与 α-Syn 的 C 端相互作用,且高度选择性地结合病理性 α-Syn(纤维形式),其对纤维形式 α-Syn 的选择性结合是单体形式 α-Syn 的超 1000 倍。也就是说,位于神经元上的 FAM171A2 蛋白能够高度选择性的结合病理性 α-Syn,使其通过内吞作用进入神经元内,诱导神经元内的正常的单体形式的 α-Syn 发生错误折叠,转变为病理性 α-Syn,进而诱导神经元死亡以及在神经元之间传播。随后,研究团队通过转基因动物证实,敲除小鼠神经元上FAM171A2,可以有效控制小鼠帕金森样症状的进展。
接下来,研究团队使用 AlphaFold-Multitimer 预测了 FAM171A2-α-Syn 复合物结构,并利用虚拟筛选技术,从 7173 种化合物中筛选出了一种小分子药物——Bemcentinib,其能够竞争性结合 α-Syn 的 C 端,从而阻断 FAM171A2 与 病理性 α-Syn 结合,抑制 FAM171A2 介导的神经元对病理性 α-Syn 的内吞。
总的来说,该研究首次阐明了 FAM171A2 作为病理性 α-Syn 的神经元受体,揭示了其驱动帕金森病病理传播的分子机制,并成功筛选到了潜在抑制剂,为帕金森病的精准治疗提供了新方向。未来研究可聚焦于靶向 FAM171A2 的药物开发及多维度验证其临床价值。
在这一成果基础上,郁金泰团队申请了基于干预FAM171A2治疗帕金森病的国际专利,接下来,将全面、系统地开展寻找治疗帕金森病的小分子药物、抗体以及基因治疗手段的临床前研发工作,并进一步将相关成果推向临床试验和临床应用。
附:
FAM171A2这个蛋白的功能一直并不清楚。在2020年郁金泰团队在Sci Adv上发有文章,首次通过实验证实它与神经退行性疾病可能有关。首先对 1362 名未患痴呆症的成年人的脑脊液 PGRN 水平进行了 GWAS 研究,并成功确定了FAM171A2基因区域内的一个独立位点,该位点与脑脊液 PGRN 水平具有全基因组显著相关性。FAM171A2 在富含 PGRN 的血管内皮和小胶质细胞中大量表达。体外研究进一步证实,rs708384 突变上调了 FAM171A2 的表达,从而导致 PGRN 水平下降。
此次则进一步证实它与帕金森病之间的关联。刚刚在2025年宁夏一个团队也间接证实这一结果,发现四溴双酚A (TBBPA)导致 FAM171A2 表达水平上调,同时 GRN、IκBα 和 p65 水平升高;而 FAM171A2 敲低后 GRN、IκBα 和 p65 表达降低,表明 TBBPA 诱导的 FAM171A2 上调应是 GRN、IκBα 和 p65 表达升高的原因。因此,我们的数据首次表明 TBBPA 诱导的氧化应激和炎症反应与 FAM171A2-GRN-NF-κB 通路密切相关。这也间接证实了帕金森病的作用机制,以及FAM171A2潜在的应用价值。
另外,近年来对帕金森病的靶向治疗研究也有一些进展。
2024 年 4 月份,渥太华大学等研究机构合作在著名期刊 Cell Death & Diseae 发表创新成果 Genetic and pharmacological reduction of CDK14 mitigates synucleinopathy,首次发现细胞周期蛋白激酶 CDK14 能够减轻 α 突触核蛋白的病理聚集,可作为帕金森病的潜在治疗靶点。研究发现 CDK14 基因沉默减轻了黑质中多巴胺能神经元的损失,并防止小鼠出现握力等行为缺陷。以此表明,CDK14 是帕金森病的潜在靶点。
2024年11月18日,中国医学科学院、北京协和医学院药物研究院杜冠华团队在期刊《Signal Transduction and Targeted Therapy》上发表了题为“Identifying genetic targets in clinical subtypes of Parkinson’s disease for optimizing pharmacological treatment strategies”的研究论文。这项研究阐明了PD亚型的发展与神经递质、中枢或外周神经系统的神经元损伤,以及脂质代谢中基因表达的改变有关。此外,基于亚型特异性差异表达基因,团队鉴定了25个潜在的药物候选物。Alox15抑制剂黄芩素对Mix大鼠产生了显著的疗效,突出了为个体选择靶向治疗的可能性。
原始文献:
Neuronal FAM171A2 mediates alpha-synuclein fibril uptake and drives Parkinson's disease. Science. 2025 Feb 21;387(6736):892-900. doi: 10.1126/science.adp3645
The role of FAM171A2-GRN-NF-kappaB pathway in TBBPA induced oxidative stress and inflammatory response in mouse-derived hippocampal neuronal HT22 cells. Ecotoxicol Environ Saf. 2025 Jan 1;289:117445. doi: 10.1016/j.ecoenv.2024.117445
The FAM171A2 gene is a key regulator of progranulin expression and modifies the risk of multiple neurodegenerative diseases. Sci Adv. 2020 Oct 21;6(43):eabb3063. doi: 10.1126/sciadv.abb3063


