【协和医学杂志】外周型脊柱关节炎的临床特征及治疗选择分析
时间:2025-02-22 12:09:48 热度:37.1℃ 作者:网络
脊柱关节炎(SpA)是一组侵犯脊柱、外周关节和关节周围软组织的免疫介导的慢性炎症性疾病,既往被分为强直性脊柱炎(AS)、银屑病关节炎(PsA)、反应性关节炎、炎症性肠病性关节炎及未分化的脊柱关节炎等,不同亚型间存在重叠。随着对SpA认识的逐渐深入,根据其主要受累部位,国际脊柱关节炎协会(ASAS)将SpA分为中轴型脊柱关节炎(axSpA)和外周型脊柱关节炎(pSpA),并分别于2009年[1]和2011年[2]发布了新分类标准。
pSpA主要表现为外周症状,包括外周关节炎、指/趾炎、外周附着点炎等,涵盖既往SpA的多种亚型[3],研究间异质性较大。但到目前为止,仅少数流行病学和临床研究将pSpA视为单独疾病[4],多数研究对pSpA各亚型进行分析,且主要集中于PsA[4],较少探究pSpA全貌,尤其对治疗选择的研究较为有限[5-6]。而外周症状对axSpA亦有重要意义,伴随外周关节炎的axSpA患者比单纯axSpA患者的疾病负担更重[7-9],而外周附着点炎则是脊柱损伤的独立危险因素[10]。本研究采用回顾性分析,探究pSpA与axSpA患者在临床特征及治疗选择上的差异,旨在深入了解pSpA患者的临床特点和疾病负担,从而指导临床实践。
资料与方法
1.1 研究对象
本研究为回顾性队列研究,数据来源于中国强直性脊柱炎前瞻性影像队列(CASPIC)和中国人民解放军总医院第一医学中心电子病历数据。选取2016年1月—2022年12月首次就诊于中国人民解放军总医院第一医学中心且诊断符合ASAS制定的axSpA或pSpA分类标准的患者为研究对象。
纳入标准:(1)年龄≥18岁;(2)首次就诊或住院并在1个月内确诊;(3)基线主诉、现病史及治疗资料齐全;(4)符合ASAS制定的axSpA、pSpA分类诊断标准。
排除标准:(1)缺少外周关节体格检查;(2)同时缺少红细胞沉降率(ESR)和C反应蛋白(CRP)两项炎症指标。
本研究符合《赫尔辛基宣言》的伦理要求,已通过中国人民解放军总医院伦理委员会审批(审批号:S2023-169-01),并豁免患者知情同意。
1.2 数据收集
采用中国人民解放军总医院第一医学中心电子病历管理系统和脊柱关节炎智能管理系统(SpAMS)收集数据。SpA患者的人口学数据、临床特征和治疗选择均为首次就诊基线数据。此外,为减少选择偏倚,对患者进行了连续招募,并对数据进行严格筛选。
本研究收集的数据资料包括以下方面:
1
人口学数据:年龄、性别、体质量指数(BMI)、吸烟史;
2
临床特征:发病年龄、诊断延迟时间、病程、既往是否有颈部/胸背/腰背/臀部疼痛史、炎症性肠病(IBD)、葡萄膜炎、银屑病、AS家族史、葡萄膜炎家族史、IBD家族史、银屑病家族史、外周关节炎、指/趾炎;
3
实验室检查:人类白细胞抗原(HLA)-B27、ESR及CRP(就诊前后1周内检验结果);
4
治疗用药:非甾体抗炎药(NSAIDs)、传统合成改善病情抗风湿药物(csDMARDs)、生物类改善病情抗风湿药物(bDMARDs)、口服糖皮质激素。
1.3
统计学处理
采用R统计软件(版本 4.1.2)和SPSS(版本 26.0)进行数据资料的统计分析。非正态分布的计量资料以中位数(四分位数)表示,组间比较采用秩和检验;计数资料以频数(百分数)表示,组间比较采用χ2检验或Fisher精确概率法。采用最小绝对值收敛与选择算子(LASSO)回归筛选变量,纳入多因素Logistic回归模型,分析pSpA患者HLA-B27阳性与临床特征因素的相关性,并计算相对危险度和95% CI。采用双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 患者一般资料
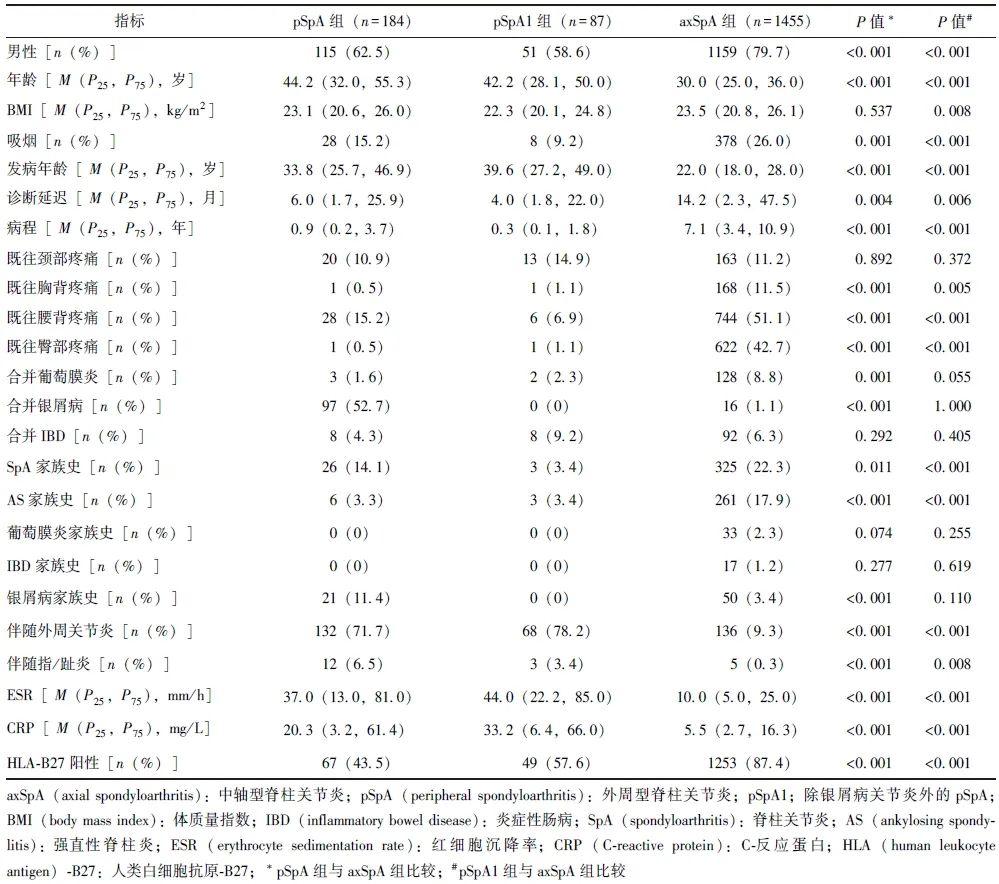
本研究连续纳入SpA患者1639例,包括pSpA患者184例(pSpA组)和axSpA患者1455例(axSpA组)。相较于axSpA组,pSpA组患者的男性占比相对较少(62.5%比79.7%,P<0.001)、就诊年龄更大(44.2岁比30.0岁,P<0.001),同时吸烟人数占比较低(15.2%比26.0%,P=0.001),两组患者的BMI比较差异无统计学意义(23.1 kg/m2比23.5 kg/m2,P=0.537)。将除PsA外的87例pSpA患者归为pSpA1组,相较于axSpA组,pSpA1组患者的BMI更低,其余变量的亚组分析结果相似,详见表1。
表1 pSpA组、pSpA1组与axSpA组患者的临床特征比较
2.2 患者临床特征
相较于axSpA组,pSpA组患者发病年龄较晚(33.8岁比22.0岁,P<0.001),诊断延迟时间更短(6.0个月比14.2个月,P=0.004),病程也更短(0.9年比7.1年,P<0.001)。pSpA组患者既往胸背、腰背、臀部的疼痛发生率明显低于axSpA组(P<0.01),但既往颈部疼痛未见明显统计学差异(10.9%比11.2%,P=0.892)。pSpA组患者葡萄膜炎的患病率较低(1.6%比8.8%,P=0.001),而银屑病的患病率较高(52.7%比1.1%,P<0.001)。在家族史方面,pSpA组患者的银屑病家族史较高(11.4%比3.4%,P<0.001),而AS家族史较低(3.3%比17.9%,P<0.001)。相较于axSpA组,pSpA1组患者除合并银屑病、合并葡萄膜炎、银屑病家族史未表现出统计学差异外,其余变量的亚组分析结果相似,详见表1。
2.3 外周受累情况
与axSpA组相比,pSpA组患者伴外周关节炎(71.7%比9.3%,P<0.001)和指/趾炎(6.5%比0.3%,P<0.001)的占比较高。在关节肿胀分布方面,pSpA组患者最常见的肿胀部位是膝关节(60.6%)和踝关节(36.4%);除下肢大关节肿胀外,还可见肘关节(12.9 %)、腕关节(18.2%)、掌指关节(20.5%)、近端指间关节(26.5%)和远端指间关节(14.4%)肿胀;axSpA组患者常见的外周关节肿胀主要为膝关节(70.9%)和踝关节(24.6%)。在关节疼痛分布方面,pSpA组患者的关节压痛分布与肿胀分布相似,除膝关节(63.2%)和踝关节(32.8%)压痛外,还可见上肢大关节和小关节压痛。此外,2.4% 的pSpA组患者伴髋部压痛,而在关节受累的axSpA组患者中观察到32.7%的患者伴髋部压痛,详见图1、图2。
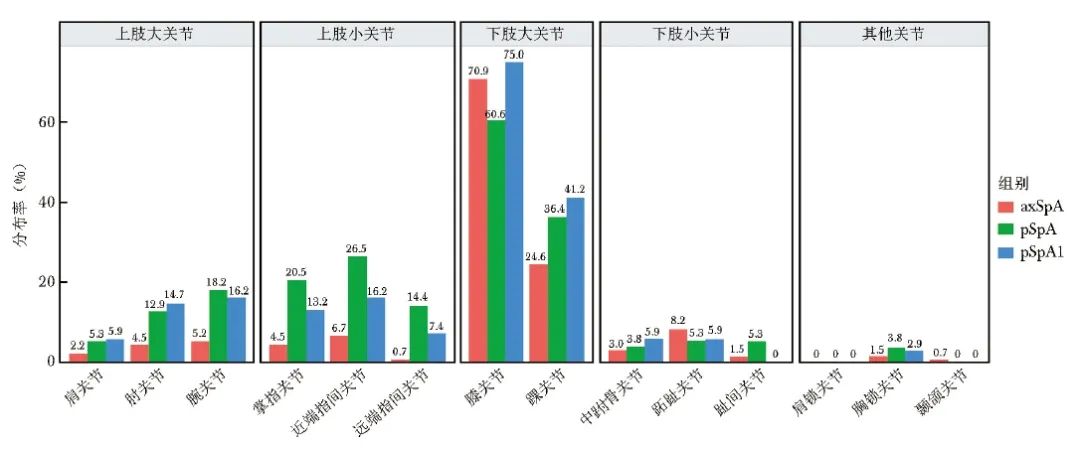
图1 axSpA组、pSpA组和pSpA1组患者外周关节肿胀部位分布情况
axSpA、pSpA、pSpA1:同表1
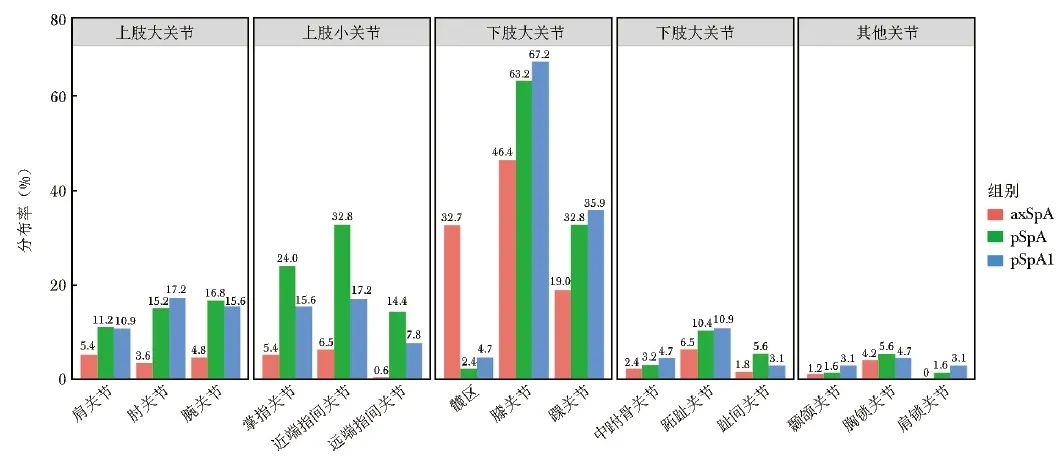
图2 axSpA组、pSpA组和pSpA1组患者外周关节压痛部位分布情况
axSpA、pSpA、pSpA1:同表1
2.4 实验室检查
pSpA组与axSpA组患者的HLA-B27阳性率比较,存在显著统计学差异(43.5% 比87.4%,P<0.001)。此外,两组患者的炎症标志物CRP和ESR升高也存在显著差异,相较于axSpA组患者,pSpA组患者的ESR(37.0 mm/h比10.0 mm/h,P<0.001)、CRP(20.3 mg/L比5.5 mg/L,P<0.001)均更高,亚组分析结果相似,详见表1。
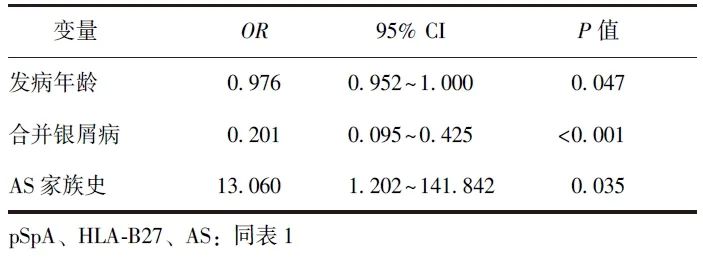
以HLA-B27阳性作为应变量建立Logistic回归模型,采用LASSO回归筛选变量,纳入因素包括:发病年龄、葡萄膜炎、银屑病、IBD、SpA家族史、AS家族史、葡萄炎家族史、IBD家族史、银屑病家族史、外周关节炎、指/趾炎。将初筛后的变量纳入多因素Logistic回归模型进行分析,结果显示发病年龄(OR=0.976,95% CI:0.952~1.000)、合并银屑病(OR=0.201,95% CI:0.095~0.425)以及AS家族史(OR=13.060,95% CI:1.202~141.842)与pSpA患者的HLA-B27存在相关性,详见表2。
表2 pSpA患者HLA-B27阳性与临床特征的多因素Logistic回归分析
2.5 治疗选择
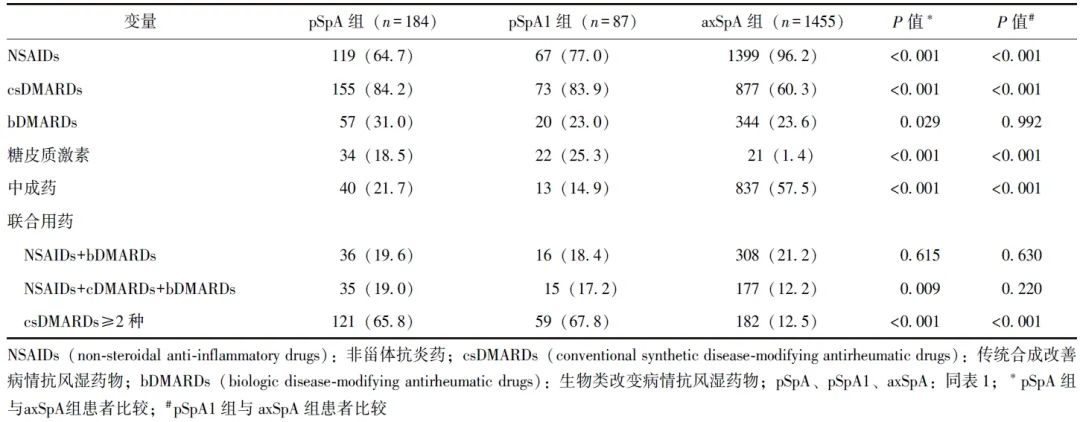
相较于axSpA组,pSpA组患者使用NSAIDs(64.7%比96.2%,P<0.001)的比例更低,但使用csDMARDs(84.2%比60.3%,P<0.001)、bDMARDs(31.0%比23.6%,P=0.029)和口服糖皮质激素(18.5%比1.4%,P<0.001)的比例更高;同时,pSpA组患者更多采用bDMARDs和csDMARDs联合用药(19.0%比12.2%,P=0.009)或多种csDMARDs合用(65.8%比12.5%,P<0.001)。pSpA1组与axSpA组患者使用bDMARDs比较差异无显著统计学意义,详见表3。
表3 pSpA、pSpA1与axSpA治疗差异[n(%)]
3 讨论
本研究回顾性收集了pSpA组和axSpA组患者的临床资料,通过分析两组的临床特征和治疗选择差异以进一步深入了解pSpA患者。研究结果显示,pSpA患者男性相对较少,发病更晚,但诊断更及时,炎症指标更高,而HLA-B27阳性率更低;pSpA患者更易出现外周关节炎、指/趾炎,且关节受累范围更广,既往脊柱疼痛主要集中于腰部和颈部,更多伴随银屑病,较少伴随葡萄膜炎;同时,pSpA患者银屑病家族史更常见,而AS家族史相对较少;在治疗选择方面,pSpA患者则更多选用csDMARDs、bDMARDs和口服糖皮质激素等治疗方式。
本研究中pSpA的发病年龄较晚、女性患者相对较多,HLA-B27阳性率较低,这一结果与既往研究结果相似,即以中轴症状发病的SpA比以外周症状为主的SpA患者发病更早[11];而axSpA组患者中男性及HLA-B27阳性占比高于pSpA组患者[3]。
此外,本研究观察到pSpA组患者发生外周关节炎、指/趾炎和银屑病的比例明显更高,HLA-B27与患者的发病年龄、合并银屑病存在相关性。既往研究显示,在HLA-B27阳性患者中,pSpA发病较早[12]、更少合并银屑病[13]。
此外,本研究发现pSpA组患者的银屑病家族史更多,而AS家族史更少。多因素分析结果提示,pSpA患者中HLA-B27阳性与AS家族史相关。一项全球研究显示,部分地区的axSpA患者中,AS家族史与HLA-B27阳性呈正相关,而IBD或银屑病家族史与其呈负相关[14]。
总之,在pSpA和axSpA患者中,发病年龄、外周关节炎、银屑病、葡萄膜炎以及家族史等特征分布不同,其对疾病进展的影响需研究进一步深入探讨。
本研究发现,相较于axSpA组,pSpA组患者的诊断延误时间更短,可能因axSpA涉及深部解剖结构,因此更易被忽视[15]。与此同时,pSpA往往更易引起患者重视并及时就诊,尤其是外周关节疼痛等明显症状。虽然关于pSpA患者诊断延迟的研究较少,但从银屑病发展为PsA的相关研究[16]可以看出,若银屑病患者出现关节肿痛或指/趾炎则诊断时间较短;相反,若症状表现为僵硬、疲劳、附着点炎或背部疼痛等,则需较长的诊断时间。在以附着点炎等为主要表现的pSpA患者中,诊断往往比较延迟,同时也易与纤维肌痛等其他疾病混淆。
此外,PsA从皮肤病变到诊断出关节病变的中位时间为7~8年[17],皮肤病变为主伴轻微关节症状表现的患者习惯在皮肤科就诊,往往不能及时到风湿科就诊。因此,临床医生应加强对早期pSpA的识别和诊断技能的学习,同时促进不同科室之间的沟通交流和积极转诊,以有效降低pSpA患者的诊断延迟。
在本研究中,pSpA组患者既往胸背、腰背及臀部的疼痛发生率明显低于axSpA组,但两组患者既往颈部疼痛未见明显统计学差异。在PsA患者中,脊柱受累研究以颈椎更为常见[18]。其他探究axSpA合并关节外症状的研究发现,合并银屑病的axSpA患者,全脊柱中颈椎受损情况更为严重,其脊柱影像学进展较快而骶髂关节炎病变更轻[19]。
另一项研究发现,女性axSpA患者骶髂关节和脊柱进展程度出现相似表现,此类患者颈椎和胸椎MRI体征的患病率较高但骶髂关节病变程度较轻[20]。此外,本研究发现pSpA患者既往腰背疼痛患病率为15.2%,与其他pSpA队列研究结果一致[21]。既往研究发现,在axSpA和非SpA慢性腰背疼痛者中,腰椎存在相似比例的退行性病变[22]。
近期,一项针对早期pSpA患者的研究发现,虽然MRI检查提示36%的患者骶髂关节水肿,但临床症状表现为炎症性腰背痛的患者占比很少[23]。目前研究表明,SpA患者脊柱易受累部位可能受疾病亚型、性别、合并银屑病等影响,pSpA患者既往发生腰背疼痛的比例与发生骶髂关节炎的比例不一致,需进一步研究探索。
本研究发现,两组患者外周关节肿胀和压痛部位存在显著差异。axSpA组患者主要表现为下肢大关节受累,而pSpA患者除膝关节和踝关节受累外,上肢的大小关节也受影响。
一项全球多中心研究发现[3],在axSpA和pSpA患者中,约50%的患者外周关节以下肢大关节受累为主,两组患病率相似;而PsA患者多为上肢和小关节受累。导致这种差异的可能原因为:不同研究对纳入的患者定义存在区别,pSpA和PsA的诊断存在一定程度的重合,风湿科医生在诊断过程中,往往将伴有银屑病和外周关节受累的患者纳入PsA组而非pSpA组。
本研究中pSpA纳入了各种亚组,提高了研究的全面性,同时观察到pSpA组部分患者存在上肢大小关节受累情况,在排除了PsA的pSpA1组患者中也观察到类似情况。此外,种族差异可能是导致外周受累部位分布不一致的原因之一。需注意的是,部分pSpA患者表现为上肢小关节受累,可能误诊为类风湿关节炎,因此针对此类患者需加强鉴别诊断。
本研究中pSpA组患者使用csDMARDs和口服糖皮质激素的比例明显高于axSpA组患者,其原因为pSpA组患者通常伴有较高比例的外周关节炎,这也与SpA的管理建议相符[24]。同时,pSpA患者使用bDMARDs的比例不低于axSpA患者,可能与伴有银屑病、外周关节炎等症状相关。
目前研究表明,外周表现和关节外症状均影响患者的疾病负担和治疗方案[25]。axSpA患者出现外周关节炎时可能倾向于选择bDMARDs、csDMARDs、口服激素[7];合并银屑病的SpA患者伴有更大的疾病负担并使用更多的药物[13]。目前,药物随机对照试验研究主要针对axSpA及PsA患者,较少有研究关注pSpA,现有数据表明csDMARDs可改善外周关节炎,但对附着点炎及指/趾炎的疗效不佳[26]。少数随机对照试验研究发现,bDMARDs对于早期pSpA的治疗效果不错[5-6]。
此外,本研究观察到pSpA患者更倾向于同时使用csDMARDs和bDMARDs,或2种以上csDMARDs联合用药。既往针对axSpA的临床研究发现,csDMARDs和bDMARDs联用的有效性和安全性有限,csDMARDs的应用可能提高bDMARDs的生存期[27]。总之,pSpA患者通常伴有更多的银屑病、外周关节炎等症状,其承担的疾病负担不亚于axSpA患者,需使用更多药物进行疾病治疗,本研究为pSpA的治疗提供了新的认识。
本研究采用回顾性研究设计,故存在一定的局限性和不足,但本研究样本量较大,两组患者间具有一定的可靠性和代表性。本研究主要结果是基于差异性分析得出,因此可能受到混杂因素影响,解读时需谨慎。pSpA患者的病程较短,可能对研究结果产生一定影响,因此计划后期加强对患者进行随访,以进一步开展深入研究。
axSpA和pSpA患者的脊柱和外周关节受累模式不同,二者的SpA家族史聚集也不同,而pSpA患者承担更高的炎症负担和更多的药物使用,这些结果对于改善pSpA治疗选择和疾病管理具有重要价值。同时,本研究也为未来研究提供了线索,可深入探讨HLA-B27阳性与axSpA和pSpA患者之间的关系,以及在选择药物治疗时考虑不同临床特征的影响。
参考文献
[1]Rudwaleit M, Landewé R, Van Der Heijde D, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis(part I): classification of paper patients by expert opinion including uncertainty appraisal[J]. Ann Rheum Dis, 2009, 68(6): 770-776.
[2]Zeidler H, Amor B. The Assessment in Spondyloarthritis International Society(ASAS) classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general: the spondyloarthritis concept in progress[J]. Ann Rheum Dis, 2011, 70(1): 1-3.
[3]López-Medina C, Molto A, Sieper J, et al. Prevalence and distribution of peripheral musculoskeletal manifestations in spondyloarthritis including psoriatic arthritis: results of the worldwide, cross-pal ASAS-PerSpA study[J]. RMD Open, 2021, 7(1): e001450.
[4]Carron P, De Craemer A S, Van Den Bosch F. Peripheral spondyloarthritis: a neglected entity-state of the art[J]. RMD Open, 2020, 6(1): e001136.
[5]Carron P, Varkas G, Cypers H, et al. Anti-TNF-induced remission in very early peripheral spondyloarthritis: the CRESPA study[J]. Ann Rheum Dis, 2017, 76(8): 1389-1395.
[6]Mease P, Sieper J, Van Den Bosch F, et al. Randomized controlled trial of adalimumab in patients with nonpsoriatic peripheral spondyloarthritis[J]. Arthritis Rheumatol, 2015, 67(4): 914-923.
[7]López-Medina C, Dougados M, Ruyssen-Witrand A, et al. Evaluation of concomitant peripheral arthritis in patients with recent onset axial spondyloarthritis: 5-year results from the DESIR cohort[J]. Arthritis Res Ther, 2019, 21(1): 139.
[8]Kwan Y H, Fong W, Leung Y Y, et al. Are extra-spinal symptoms associated with quality of life in patients with axial spondyloarthritis? A 1-year follow-up study[J]. Clin Rheumatol, 2019, 38(7): 1881-1887.
[9]López-Medina C, Chevret S, Molto A, et al. Identification of clinical phenotypes of peripheral involvement in patients with spondyloarthritis, including psoriatic arthritis: a cluster analysis in the worldwide ASAS-PerSpA study[J]. RMD Open, 2021, 7(3): e001728.
[10]Solmaz D, Bakirci S, Jibri Z, et al. Psoriasis is an independent risk factor for entheseal damage in axial spondyloarthritis[J]. Semin Arthritis Rheum, 2020, 50(1): 42-47.
[11]Skare T L, Leite N, Bortoluzzo A B, et al. Effect of age at disease onset in the clinical profile of spondyloarthritis: a study of 1424 Brazilian patients[J]. Clin Exp Rheumatol, 2012, 30(3): 351-357.
[12]Arevalo Salaet M, López-Medina C, Moreno M, et al. Association between HLA-B27 and peripheral spondyloarthritis phenotype: results from the ASAS perSpA study[J]. RMD Open, 2022, 8(2): e002696.
[13]López-Medina C, Ortega-Castro R, Castro-Villegas M C, et al. Axial and peripheral spondyloarthritis: does psoriasis influence the clinical expression and disease burden? Data from REGISPONSER registry[J]. Rheumatology(Oxford), 2021, 60(3): 1125-1136.
[14]Boel A, Van Lunteren M, López-Medina C, et al. Geographical prevalence of family history in patients with axial spondyloarthritis and its association with HLA-B27 in the ASAS-PerSpA study[J]. RMD Open, 2022, 8(1): e002174.
[15]Navarro-Compán V, Benavent D, Capelusnik D, et al. ASAS consensus definition of early axial spondyloarthritis[J]. Ann Rheum Dis, 2024, 83(9): 1093-1099.
[16]Ogdie A, Nowell W B, Applegate E, et al. Patient perspectives on the pathway to psoriatic arthritis diagnosis: results from a web-based survey of patients in the United States[J]. BMC Rheumatol, 2020, 4: 2.
[17]Tillett W, Charlton R, Nightingale A, et al. Interval between onset of psoriasis and psoriatic arthritis comparing the UK Clinical Practice Research Datalink with a hospital-based cohort[J]. Rheumatology(Oxford), 2017, 56(12): 2109-2113.
[18]Poddubnyy D, Jadon D R, Van Den Bosch F, et al. Axial involvement in psoriatic arthritis: an update for rheumatologists[J]. Semin Arthritis Rheum, 2021, 51(4): 880-887.
[19]Lorenzin M, Ortolan A, Vio S, et al. Psoriasis and imaging progression in early axial spondyloarthritis: results from a 48-month follow-up(Italian arm of SPACE study)[J]. Rheumatology(Oxford), 2022, 61(6): 2375-2387.
[20]Lorenzin M, Cozzi G, Scagnellato L, et al. Relationship between sex and clinical and imaging features of early axial spondyloarthritis: results from a 48 month follow-up(Italian arm of the SPondyloArthritis Caught Early(SPACE) study)[J]. Scand J Rheumatol, 2023, 52(5): 519-529.
[21]Zabotti A, Luchetti M M, Selmi C F, et al. An Italian disease-based registry of axial and peripheral spondyloarthritis: the SIRENA study[J]. Front Med(Lausanne), 2021, 8: 711875.
[22]De Bruin F, Ter Horst S, Bloem H L, et al. Prevalence of degenerative changes of the spine on magnetic resonance images and radiographs in patients aged 16-45 years with chronic back pain of short duration in the Spondyloarthritis Caught Early(SPACE) cohort[J]. Rheumatology(Oxford), 2016, 55(1): 56-65.
[23]Renson T, Carron P, De Craemer A S, et al. Axial involvement in patients with early peripheral spondyloarthritis: a prospective MRI study of sacroiliac joints and spine[J]. Ann Rheum Dis, 2021, 80(1): 103-108.
[24]Smolen J S, Schöls M, Braun J, et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force[J]. Ann Rheum Dis, 2018, 77(1): 3-17.
[25]Derakhshan M H, Dean L, Jones G T, et al. Predictors of extra-articular manifestations in axial spondyloarthritis and their influence on TNF-inhibitor prescribing patterns: results from the British Society for Rheumatology Biologics Register in Ankylosing Spondylitis[J]. RMD Open, 2020, 6(2): e001206.
[26]Molto A, Sieper J. Peripheral spondyloarthritis: concept, diagnosis and treatment[J]. Best Pract Res Clin Rheumatol, 2018, 32(3): 357-368.
[27]Behrens F, Cañete J D, Olivieri I, et al. Tumour necrosis factor inhibitor monotherapy vs combination with MTX in the treatment of PsA: a systematic review of the literature[J]. Rheumatology(Oxford), 2015, 54(5): 915-926.


