刘庄团队AM:捕获DNA的锰协同壳聚糖微粒可通过激活cGAS-STING通路和维持肿瘤浸润性CD8+ T细胞的干性来增强放疗
时间:2025-02-22 12:09:33 热度:37.1℃ 作者:网络
放疗与cGAS-STING
放射治疗(RT)是一种广泛应用的癌症治疗方式。详细的机制研究表明,高能电离辐射(如X射线、γ射线等)可以通过直接促进DNA损伤或通过产生细胞毒性活性氧间接破坏癌细胞。除了有效抑制甚至治愈照射部位的肿瘤病变外,放射治疗还被证明可以通过众所周知的“远隔效应(abscopal effect)”引起照射区域外的恶性病变的缩小和消退,这一效应主要归因于抗肿瘤免疫的启动。迄今为止,从免疫检查点阻断抗体到免疫激动剂等多种方法已在临床试验和动物实验中被广泛探索,以增强放射治疗诱导的抗肿瘤免疫,从而改善癌症治疗效果。受抗原呈递细胞(APCs),特别是常规1型树突状细胞(cDC1s)在启动肿瘤清除性CD8+ T细胞反应中的关键作用启发,合理地将放射治疗与能够激活APCs的制剂结合被认为是有效癌症放射免疫治疗的实用策略。
cGAS-STING通路是一条关键的细胞内通路,通过响应来自病原性病毒、细菌或受损细胞释放的DNA片段,介导先天性和适应性免疫反应的激活。由于其能够促进CD8+ T细胞反应的启动,cGAS-STING通路已被广泛探索为多种肿瘤的有希望的治疗靶点。与开发针对cGAS-STING通路的小分子免疫激动剂(如环二核苷酸(CDNs))相比,促进肿瘤中DNA片段的积累也被认为是激活cGAS-STING通路的另一种策略。因此,包括放射治疗、小分子抑制剂和增加癌细胞染色体不稳定性的纳米药物在内的多种DNA损伤性癌症治疗方法已被证明是激活cGAS-STING通路的有效候选者。然而,鉴于DNA片段固有的负电荷显著限制了它们进入活细胞的能力,从而阻碍了它们与cGAS蛋白的结合。因此,开发合理的策略以增加肿瘤病变中DNA片段的细胞质传递能力,有望显著增强其cGAS-STING激活能力,从而实现更有效的癌症免疫治疗。
可捕获DNA的锰配位壳聚糖微粒
在这项研究中,苏州大学刘庄教授和冯良珠教授等人通过一种配位导向的一锅合成法,简洁地制备了具有选择性DNA捕获能力的锰配位壳聚糖(CS-Mn)微粒,以增强放射治疗的免疫原性。所获得的CS-Mn微粒在生理条件下能够迅速解离,并由于线性壳聚糖与DNA分子之间的强静电相互作用,选择性地与DNA结合形成带正电荷的DNA-CS复合物。因此,它们在血清存在下能够实现DNA的高效细胞质传递,并与Mn2+协同作用,激活树突状细胞中的cGAS-STING通路。通过瘤内注射,CS-Mn微粒显著增强了放射治疗对多种肿瘤模型中照射部位和远端肿瘤的疗效,这得益于其共同促进了肿瘤浸润性CD8+ T细胞的干性特征和先天免疫的激活。CS-Mn微粒的放射增敏效应可以通过同时应用抗程序性细胞死亡蛋白1(抗PD-1)免疫疗法进一步增强。这项工作展示了一种巧妙的策略,即制备类似特洛伊木马的DNA捕获微粒作为cGAS-STING激活的放疗增敏剂,用于有效的放射免疫治疗。相关工作以“DNA-Capturing Manganese-Coordinated Chitosan Microparticles Potentiate Radiotherapy via Activating the cGAS-STING Pathway and Maintaining Tumor-Infiltrating CD8+ T-Cell Stemness”为题发表在Advanced Materials。

【文章要点】
壳聚糖是一种天然的阳离子线性多糖,由于其与带负电荷的分子(包括DNA分子)具有高结合亲和力,已被广泛应用于基因传递、DNA提取和其他生物医学领域。然而,壳聚糖分子间和分子内的强氢键使其仅溶于酸性溶液,从而限制了其直接体内应用。因此,在本研究中,作者利用锰离子(Mn2+)与壳聚糖的氨基和羟基之间的弱配位相互作用,合成了在水中具有优异分散性的锰配位壳聚糖(CS-Mn)微粒(图1)。

图1 CS-Mn的制备表征
研究发现,这些CS-Mn微粒在磷酸盐缓冲液(PBS)中迅速解离,之后即使在含血清的条件下也能优先与DNA组装形成颗粒状DNA-CS复合物,从而实现了对DNA的高效动态选择性吸附,效率高达94.2%。因此,CS-Mn微粒显著促进了游离DNA片段进入树突状细胞(DCs),并与Mn2+协同作用,通过共同激活cGAS-STING通路刺激DCs的成熟(图2)。
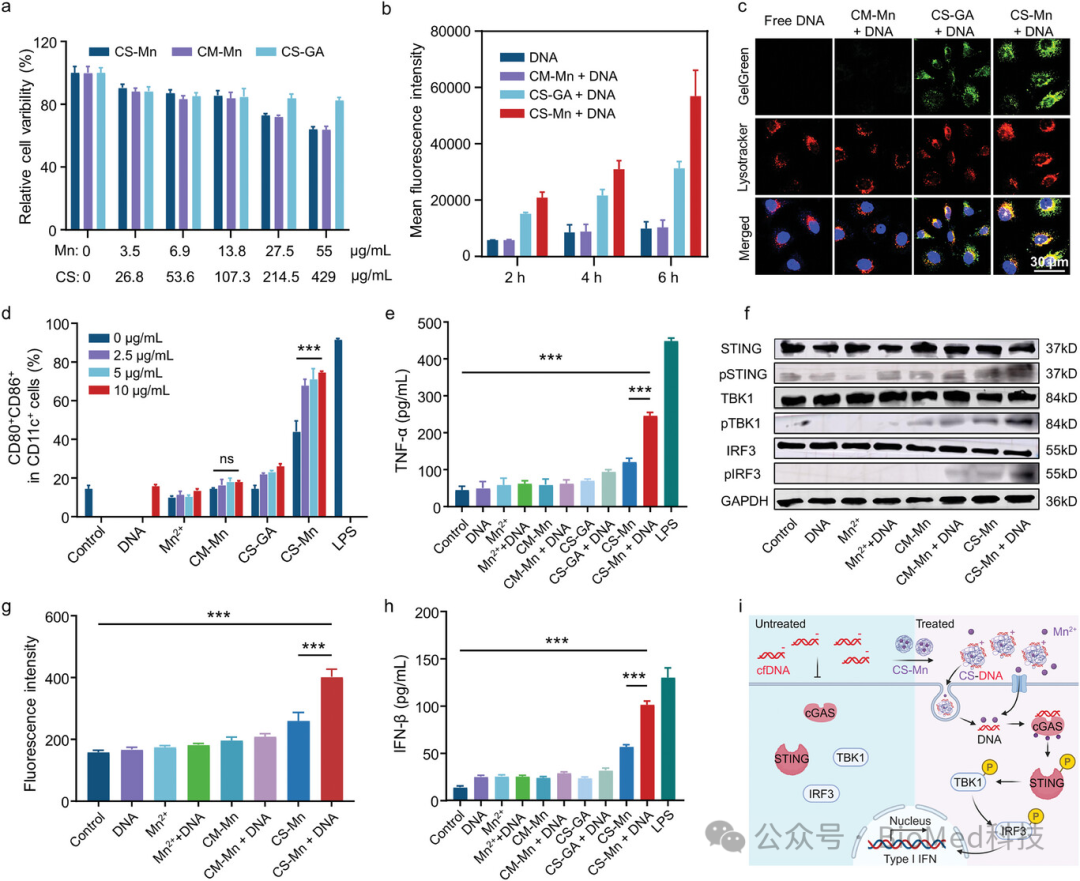
图2 CS-Mn在细胞水平的生物学效应
此外,CS-Mn微粒还可与放射治疗协同作用,通过DNA片段介导的cGAS-STING信号通路促进了cDC1s向肿瘤引流淋巴结的募集、肿瘤浸润性CD8+ T细胞的干性特征以及先天抗肿瘤免疫的激活。因此,通过瘤内注射,CS-Mn微粒能够显著增强放射治疗对照射部位和远端肿瘤的疗效,并且在与抗PD-1免疫疗法联合使用时进一步增强。因此,作者认为,本研究开发了一种简洁的方法,制备具有动态选择性DNA捕获能力的特洛伊木马式壳聚糖微粒,可通过激活cGAS-STING通路增强放射治疗启动抗肿瘤免疫的能力(图3)。

图3 利用CS-Mn微粒进行强化放疗示意图
【结论与展望】
总之,本研究强调了一种简洁的协调方法来制备具有动态和选择性DNA捕获能力的CS-Mn微粒,该微粒在生理溶液中的稳定性十分有限,以及壳聚糖对DNA的结合亲和力高于对蛋白质的结合亲和力。这些特洛伊木马式的CS-Mn微粒被证明是通过在受辐射的肿瘤病灶中集体激活cGAS-STING信号轴,有效增强单纯放疗以及分次放疗与抗PD-1免疫疗法联合治疗的潜在候选者。考虑到除手术外,几乎所有癌症治疗方式在杀死癌细胞的过程中都会促进DNA片段的释放,CS-Mn微粒有望普遍增强这些癌症治疗的疗效。由于壳聚糖和Mn2+的优异生物相容性、明确的组成以及简便的制备过程,CS-Mn微粒在未来临床转化中具有广阔的前景。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202418583


