Nat Med:异体GD2 CAR-T在治疗高危神经母细胞瘤中展现出希望
时间:2025-02-15 12:09:19 热度:37.1℃ 作者:网络
即使采用强化的多模式治疗,50%至60%的高危神经母细胞瘤 (HR-NB) 患者的肿瘤反应不佳或会遇到复发。而复发或难治性 (r/r) HR-NB的预后不佳,长期无病生存率不超过10-15%。因此目前仍需探索新的治疗方案,例如CAR-T治疗。
此前,NCT03373097这项I/II期临床试验的中期分析显示,靶向GD2的第三代 (CD28-4.1BB) CAR-T,GD2-CART01这种自体CAR-T疗法可能是 r/r HR-NB患者的潜在选择。尤其值得注意的是,在那项研究中,输注时疾病负担较低的患者在用GD2-CAR T细胞治疗时疗效显著,3年无事件生存率接近 60%。但实现低肿瘤负担可能需要使用HD化疗或间碘苄胍 (MIBG)疗法,而对于无法采集自体干细胞的患者,则不能使用这些疗法。此外,一部分患者由于严重的淋巴细胞减少而无法获得自体CAR-T细胞。
近日,来自意大利的研究团队在 Nature Medicine 上发表了题为 Donor-derived GD2-specific CAR T cells in relapsed or refractory neuroblastoma 的论文,在NCT03373097 自体CAR-T治疗神经母细胞瘤的基础上,探索用同种异体GD2-CAR T细胞(ALLO_GD2-CART01)治疗r/r HR-NB。在5例患者中观察到2例完全缓解,一例维持缓解,显示出初步希望,也意味着ALLO_GD2-CART01 对 r/r HR-NB 儿童的安全性和有效性值得在前瞻性试验中进一步研究。

2022年2月到2024年1月,研究人员用ALLO_GD2-CART01治疗了5名r/r HR-NB患者。所有患者的肿瘤都对超过3线的治疗不再有应答,包括两人接受过自体GD2-CART01治疗。使用ALLO_GD2-CART01治疗的原因包括已经没有其它治疗选择,潜在的治愈可能以及过往自体CAR-T治疗失败。值得注意的是5位患者都成功接受了ALLO_GD2-CART01治疗,没有患者中途退出。
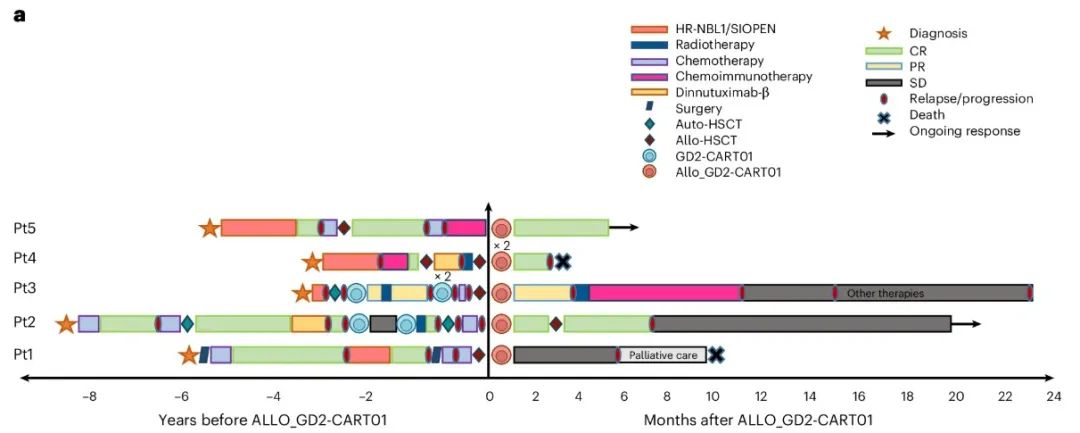
附图. 5位患者的治疗流程
已为所有五名患者成功生产ALLO_GD2-CART01,所用生产工艺与自体GD2 CAR-TAUTO_GD2-CART01相同。ALLO_GD2-CART01 生产结束时的中位T细胞数为3.85 × 10^9(范围2.4 – 4.76 × 10^9),中位转导效率和细胞存活率分别为 70.1%(范围 62.8–76.5%)和 94.4%(范围 88.5–96.7%)。
生产出来的ALLO_GD2-CART01特点是CD4或CD8中央记忆CAR阳性T细胞占主导,与AUTO_GD2-CART01药物产品相比,幼稚CD4 CAR阳性T细胞和幼稚和终末分化效应记忆CAR阳性CD8 T细胞百分比较低。
ALLO_GD2-CART01在患者 1中于HSCT(干细胞移植)后第 62 天输注,在患者3中于第72天输注,在患者4中于第 73 天输注,在患者 5 中于HSCT后2.5年输注,而患者 2 则在HSCT前89天接受了从 HLA 相合兄弟姐妹产生的基因工程 T 细胞(该患者接受异基因 HSCT 是为了治疗 ALLO_GD2-CART01 后出现的长期严重的血细胞减少症)。在四名患者中观察到对ALLO_GD2-CART01的反应,其中患者2和4中获得2次CR(尽管输注前观察到大量进展),患者5中1次维持CR,患者 3中1 次部分反应(PR),两个软组织病变缩小,MIBG 骨骼评分降低 50% 以上。
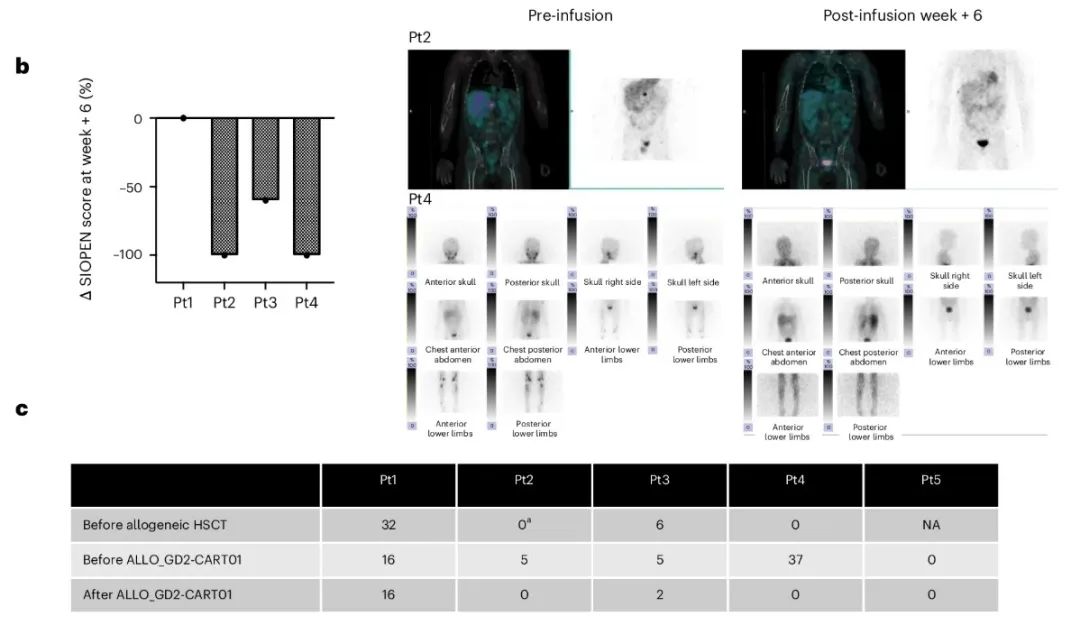
附图. 部分患者治疗效果
在患者4中,鉴于获得的结果、良好的安全性和疾病特有的非常高的风险,研究人员决定在第一次输注后的第8周输注第二剂 ALLO_GD2-CART01(3 × 10^6 CAR阳性细胞/kg),考虑到患者仍然处于细胞减少症,无需先前进行淋巴细胞清除。患者2最初接受自体CAR-T治疗,观察到的最佳反应为 SD,反应持续时间为 6 个月,而在接受ALLO_GD2-CART01 后,最终获得CR。
患者3接受AUTO_GD2-CART01后获得的最佳反应是 PR,持续时间为 15 个月。在此期间,患者还接受了放射治疗。在随后的复发后,她又接受了两次AUTO_GD2-CART01输注,但证明具有抗药性。然后研究人员决定继续进行 ALLO_GD2-CART01 输注,获得了新的PR。
尽管取得了这些成果,但前四名患者的病情随后复发或进展。特别是患者1在接受 ALLO_GD2-CART01 治疗 6 个月后病情进展,出现新的肝病变。患者2在HSCT后4个月观察到两个新的骨斑,但直到输注后 24 个月进行的最后一次评估时,尽管没有任何其他治疗,骨斑仍未进展。患者3在输注ALLO_GD2-CART01 3 个月后观察到病情进展。患者4在输注3.5个月后观察到疾病在中枢神经系统中大规模扩散。患者5在接受 ALLO_GD2-CART01 治疗6个月后仍保持持续CR。
在安全性方面,所有患者中均观察到与自体产品常见的毒性反映。特别是在所有儿童中均观察到≥3 级血液学毒性,第2,4,5位患者经历了长时间(>4 周)的中性粒细胞减少症。所有患者均出现了细胞因子释放综合征(CRS),并与血清细胞因子(包括 CXCL9 和 CXCL10)的增加有关,这些细胞因子的水平又与患者随访期间和 CAR T 细胞体内扩增时干扰素增加相关。在同样与使用过自体CAR-T治疗2、3号患者中,参考CRS分级和IL-6 细胞因子升高水平,均是接受ALLO_GD2-CART01治疗时CRS的严重程度更高,这表明来自同种异体的CAR-T细胞活化更强。
为了进一步了解ALLO_GD2-CART01的生物学特性,研究人员将RNA-seq分析获得的五个药物产品的转录组谱与在随访扩增高峰期从患者中收集和分离出的CAR-T细胞进行比较。在所有分析的基因中,有 2,725 个基因表达存在差异,其中 1,204 个基因在随访中上调。
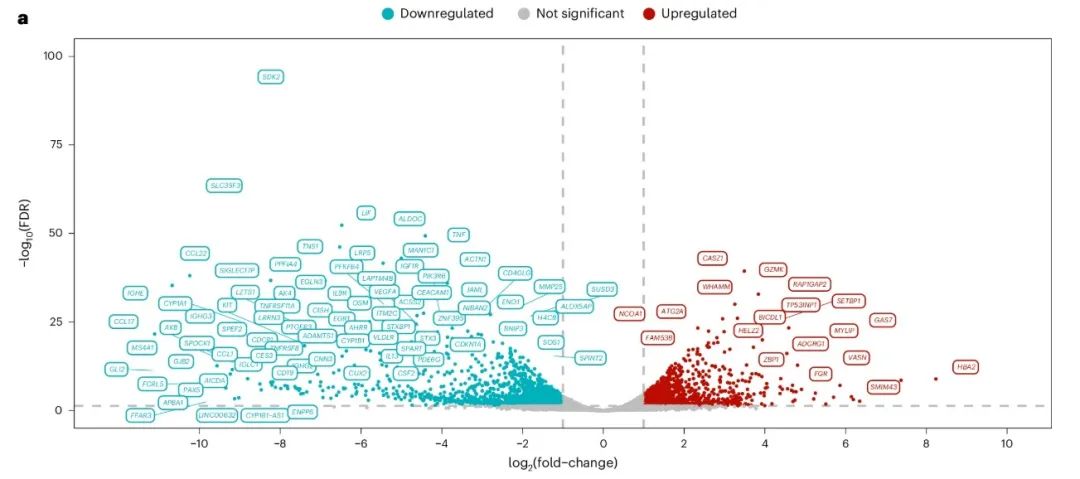
附图. 药物产品与随访时采集的CAR-T细胞基因表达差异
在与药物产品相比,随访样本中上调差异表达最高的基因中观察到多个与T细胞活化和迁移相关的基因,包括CASZ1、GZMK 、WHAMM和RAP1GAP2(参与肌动蛋白细胞骨架的组织和膜运输,与CAR-T细胞粘附于靶细胞和突触形成有关)、ATG2A和TP53INP1(参与自噬,对CAR-T细胞在压力下的存活和功能至关重要)VCAM1 (参与细胞粘附、迁移,对CAR-T细胞运输和肿瘤浸润很重要)、FGR(一种免疫反应的酪氨酸激酶,对CAR-T细胞活化和信号传导很重要)和LYST (调节溶酶体的大小和功能,对CAR-T细胞的功能和细胞毒性很重要)。
总之,这项研究显示在异质性患者群体中使用 ALLO_GD2-CART01是可行的,具有可接受的毒性特征和治疗这些多次复发的 HR-NB 患者的疗效证据。考虑到这五名患者所表现出的可行性和安全性,ALLO_GD2-CART01 可能为传统的 AUTO_GD2-CART01 提供替代方案。
尽管这项研究存在局限性,特别是样本量很小,只有五名患者接受了治疗。此外,既往治疗的高度异质性使得结果难以推广。但在所述晚期疾病患者病例系列中,该方法表现出令人鼓舞的安全性和抗肿瘤活性,值得在正式的 I/II 期临床试验中对ALLO_GD2-CART01进行进一步的前瞻性研究。


