脑胶质瘤术后结局风险模型:RANO切除组的报告 - 协和神经肿瘤专栏
时间:2024-12-10 11:01:16 热度:37.1℃ 作者:网络
协和神经肿瘤专栏 第96期

原文链接:https://academic.oup.com/neuro-oncology/advance-article
【编者按】
胶质母细胞瘤是成人中最常见的原发性脑肿瘤,对于新诊断的患者,标准治疗方案包括最大安全范围的手术切除及术后同步放化疗和替莫唑胺维持化疗(TMZ/RT → TMZ),但病情进展不可避免,并且预后较差1。许多临床试验前瞻性地招募初次手术后的新诊断胶质母细胞瘤患者以评估新的治疗方法,因此在随机化分组前对入组患者进行风险分层至关重要,以减少组别之间可能存在的不平衡,避免影响干预组和对照组之间的差异分析2,3。
为建立一个易于临床使用的风险预测模型, RANO 切除组(RANO resect group)在一个由美国和欧洲多中心组成的新诊断胶质母细胞瘤患者队列中评估切除程度、临床及分子特征与生存之间的关系。通过单因素、多因素以及决策树分析等方法,构建了一个风险评分,称为“RANO 术后结局风险评分”。评分整合了肿瘤切除程度、MGMT 启动子状态、年龄、术后Karnofsky 功能状态评分(KPS)四个预后相关的因素,每个因素均分配相应的分值,最后根据四个因素得分相加的总分将新诊断胶质母细胞瘤患者分为三个风险类别:低风险(0-2 分,风险类别 I)、中等风险(3-5 分,风险类别 II)、高风险(6-9 分,风险类别 III)。该模型不仅在训练队列中可以区分不同预后的患者,也在外部单中心验证队列中被证实其预后价值。此外,RANO 术后风险评分在接受术后TMZ/RT→TMZ的患者亚组和其他术后治疗方案的患者亚组中均可以划分出三个预后显著不同的风险类别。与既往文献中提出的预后模型相比,此模型拟合优度更好。
新诊断胶质母细胞瘤患者即使在接受当前的标准治疗方案后,预后仍然较差,迫切需要开发新的疗法4-6。RANO切除组开发了一个基于四个关键因素的预后分层评分模型,该模型易于在临床上应用。评分模型不仅可以在临床试验分组时最小化研究组别之间的差异,也可以为患者预后及术后管理提供一定指导意义。未来可以考虑在复发性胶质母细胞瘤患者中验证这一风险评分的预后价值,并进一步细化手术相关因素,例如术中辅助影像的使用和卡莫司汀植入物的使用,以提高风险分级的准确性。
研究背景
之前,RANO切除组已经建立了用于衡量胶质母细胞瘤手术切除程度的RANO分类,并将术后残留肿瘤体积作为评估指标,证实了其与患者生存的相关性7,8。然而,除了切除程度,其他因素如患者人口统计学特征、术后神经功能等也与切除程度存在相互作用,并且与临床结局相关。考虑到不同临床和分子特征的患者亚组中,手术切除程度与生存之间的关联存在差异,因此需要一个可靠的分层系统,将手术切除以及其他预后相关因素结合起来9。此外,许多新诊断的胶质母细胞瘤患者在手术后会参与临床试验,需要进行细致的风险分层评估,以减少不同研究组之间的不平衡。因此,此研究旨在分析新诊断胶质母细胞瘤患者术后残余肿瘤大小与临床、分子因素对生存结局的影响,建立一个术后风险评估工具。
研究方法
RANO切除组回顾性收集了位于美国和欧洲的 7 个中心的新诊断胶质母细胞瘤患者。纳入标准:(1)根据2021年世界卫生组织(WHO)第五版中枢神经系统肿瘤分类诊断为未经治疗的幕上异柠檬酸脱氢酶(IDH)野生型胶质母细胞瘤;(2)有术前及术后 MRI;(3)胶质母细胞瘤诊断后至少有 3 个月的随访。满足标准的患者,从各个中心的数据库中提取其人口统计学、临床及肿瘤体积的信息,此外还组建了一个外部单中心验证队列。
临床终点的定义:手术(或活检)日期被定为诊断日期,根据神经肿瘤疗效评估(RANO)标准,第一次于 MRI 上显示疾病进展的时间被定为首次复发的日期,一小部分患者因参与临床试验而使用免疫治疗 RANO(iRANO)或改良 RANO(mRANO)进行评估。无进展生存期(PFS)为诊断到首次复发或任何原因死亡之间的时长,总生存期(OS)为诊断到任何原因死亡之间的时间。
统计学分析:首先通过 Kaplan-Meier曲线和log-rank检验进行生存分析,再通过 Cox比例风险回归模型来量化各个因素的风险比(HRs)进行单因素生存分析,在单因素分析中p 值≤0.05 的预后印象因素被纳入多因素生存分析中。利用 CART 决策树算法对训练队列进递归划分分析,将患者分为不同的生存风险类别,多因素分析中筛选出显著影响预后的因素作为潜在的划分子集的特征。最后,为了将得出的风险类别转化为易于临床使用的风险模型,此研究建立了一个评分系统,为每个类别分配的分数反映了决策树分析预测的相互作用,相加后总和得分反映了决策树分析的风险类别。在外部验证队列中测试了评分系统的预后价值,并将此模型与既往文献中的预后模型进行拟合优度的比较(包括Harrell’s C指数、伪R2值、预测准确度指数(IPA))。
研究结果
训练队列由来自7个不同中心的1003名新诊断的胶质母细胞瘤患者组成,而外部单中心验证队列则包括了另外258名患者。所有患者的诊断均基于2021年WHO第五版中枢神经系统肿瘤分类标准进行的。验证队列与训练队列在人口统计学上无显著差异,但验证队列患者具有更好的临床特征,包括解剖定位于皮层下的肿瘤更常见、术后KPS评分更高、术前影像学上肿瘤体积更小、以及接受术后同步放化疗患者比例更高。不过,值得注意的是,验证队列的患者手术切除程度比训练队列小。
为了识别与预后相关的特性,在训练队列中运用单因素分析,检验了大量患者特征与OS的关联。研究发现以下特征与较好的生存预后相关:更年轻、MGMT 启动子甲基化的状态、更大的切除范围、更高的术后 KPS 评分、肿瘤位置较表浅、术后更强化的一线治疗(例如任何形式的放化疗)。在随后的多因素分析中,除了肿瘤位置外,其他特征都保持了与预后相关的显著性。对于年龄和术后 KPS 这两个连续变量,取具有临床意义的临界值(年龄 >65岁定义为老年患者,术后 KPS ≥80表示患者能够进行日常活动工作),将其转换为二分类变量时,这些临界值在两组之间产生了最大的风险比。此外,生存结局和不同的术后治疗方案之间的相关性并不一致,这取决于具体的治疗方法。从多因素分析中去除术后治疗方式时,四个关键预后标志物(年龄、MGMT 启动子甲基化的状态、肿瘤切除范围、术后 KPS)仍然显著。
将多因素分析中显著的因素纳入递归划分分析中,构建一个术后风险模型来预测生存。为了简化模型并增强临床实用性,“年龄”和“术后 KPS”这两个变量采取之前提到的临界值转换为二分类变量。术后治疗类型被作为分层因素而非协变量。通过重复分裂(repetitive tree splitting),计算出 11 个终端节点,在合并了 log-rank生存分析中无差异的节点后,最终确定了三个不同的风险类别(图1A)。三个风险类别的患者mOS (风险类别 I、II、III 分别为:24、16、6 个月,p = 0.001)和mPFS(11、9、3 个月,p = 0.001)都有显著差异,而同一风险类别内患者在生存上无显著差异(图1B)。
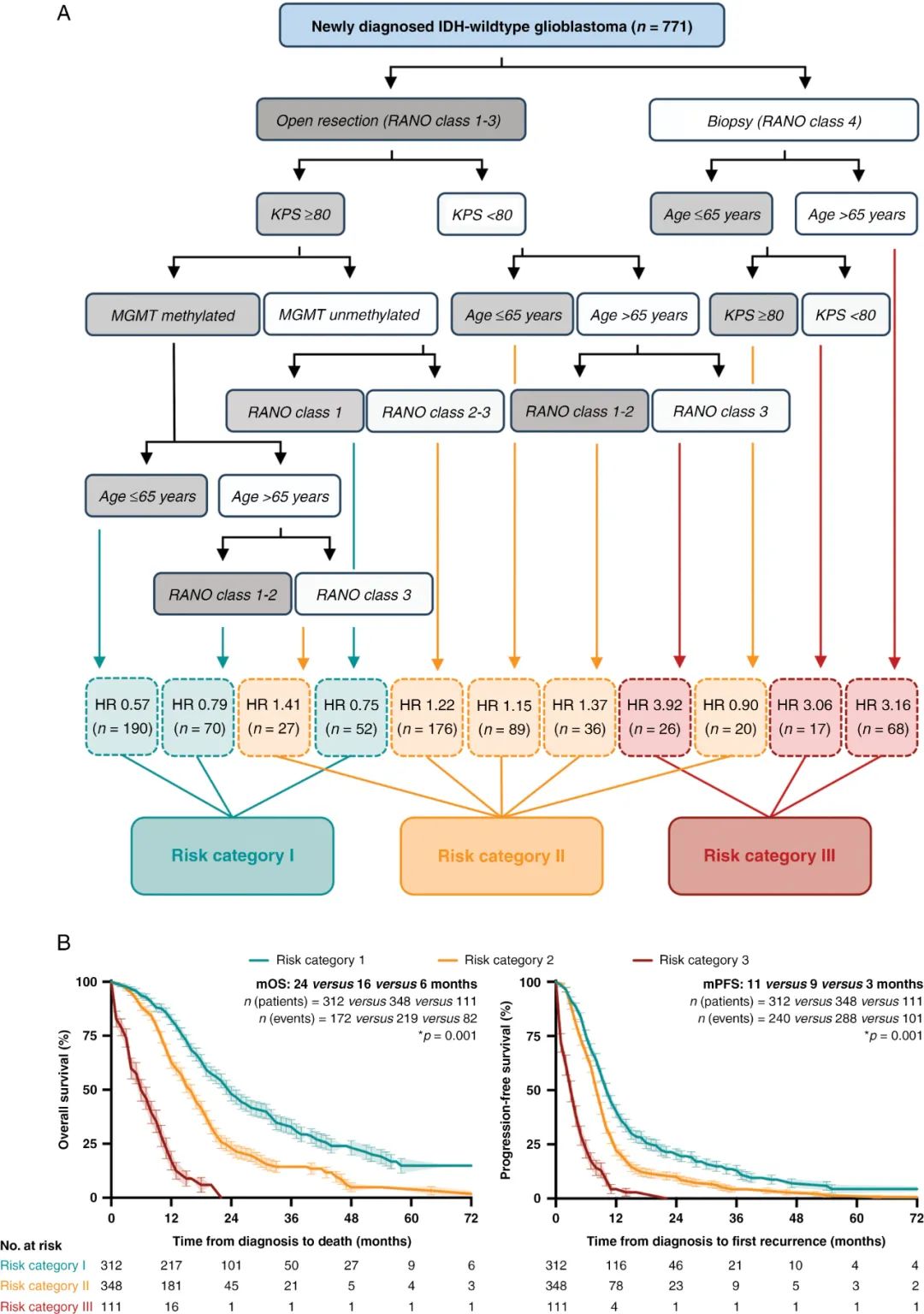
图1递归划分分析确定风险类别。(A)训练队列中决策树分析,纳入多因素分析中具有显著性的 4 个变量(切除范围、MGMT 启动子状态、术后 KPS、年龄),最后确定 3 个不同的风险级别。(B)训练队列患者的 OS 和 PFS 按照风险类别进行比较。阴影表示标准误(SEM)。
为了简化模型,该研究将三个风险类别转化为一个加和的综合评分系统(称为“RANO 术后结局风险评分”)。四个预后关键因素(切除程度、术后 KPS、年龄、MGMT 启动子甲基化状态)均被赋予对应的分值(图2A)。总分为每个预后因素的分数加和,范围从 0 到 9 分。基于决策树分析,“年龄”和“MGMT 启动子甲基化状态”这两个因素的权重会根据其他风险因素的存在而有所不同。根据总分可以区分出低风险(0-2 分,风险类别 I)、中等风险(3-5 分,风险类别 II)、高风险(6-9 分,风险类别 III)的患者。在训练队列中,不论患者术后是按照EORTC-NCIC 方案(即 TMZ/RT→TMZ)或其他治疗方式,此模型都能区分出具有显著生存差异的三组风险类别的患者(图2B)。此外,评分的分数值本身也与生存结局相关。通过单因素 Cox比例风险回归模型,研究发现风险评分每增加 1 分,死亡风险比呈指数增长(图2C)。
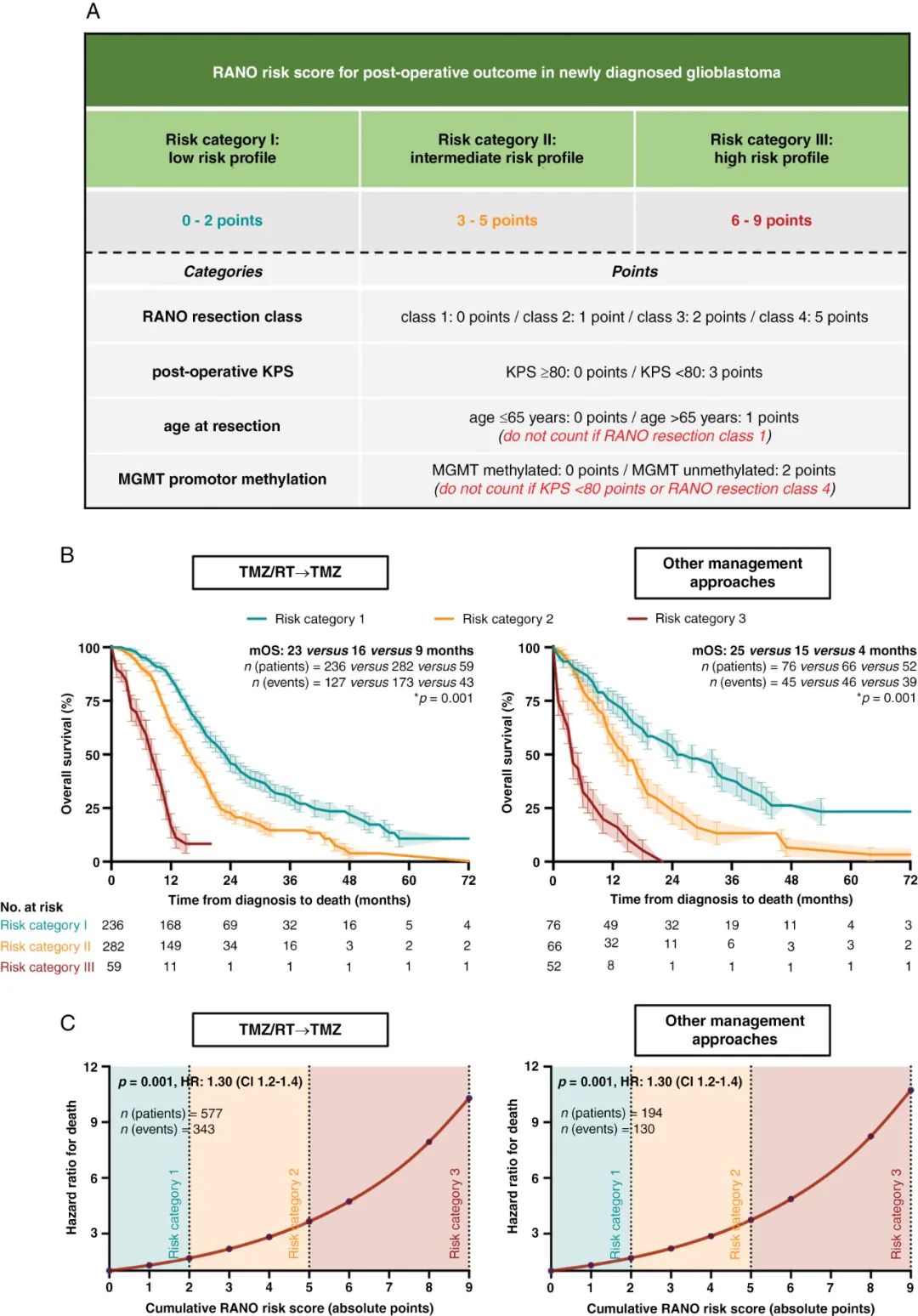
图2 RANO 术后结局风险评分。(A)评分系统;(B)不同术后治疗方案下,训练队列中不同风险类别患者的生存期比较;(C)死亡风险比与 RANO 风险评分之间的关联。
最后,该研究在独立的外部验证队列中对模型的预后价值进行检测(图3A)。三个不同风险类别患者的总生存期有显著不同(风险类别 I、II、III 分为别 37、19、11个月,p=0.001,图 3B)。RANO 风险模型的预后价值不仅在标准治疗的亚组中得以保留(图3C),而且在采取其他术后治疗方式的患者亚组中也得以保留(图 3D)。与既往文献中的其他预后模型,包括简化 RTOG RPA 模型(三个风险组)10、RPA 模型(四个风险组)7、GBM-molRPA 模型(三个风险组)11,本研究的风险评分模型在训练队列和验证队列中的Harrell’s C指数优于其他模型,而简化 RTOG RPA 模型和 RPA 模型未能在验证队列中区分不同的风险类别。此外,GBM-molRPA 模型的建立时间早于 2021版 WHO 分型,所以该模型在开发时包含部分 IDH 突变型胶质瘤,而在本研究仅含 IDH 野生型胶质母细胞瘤患者的队列中,GBM-molRPA 模型仅能区分出 2 个风险类别。
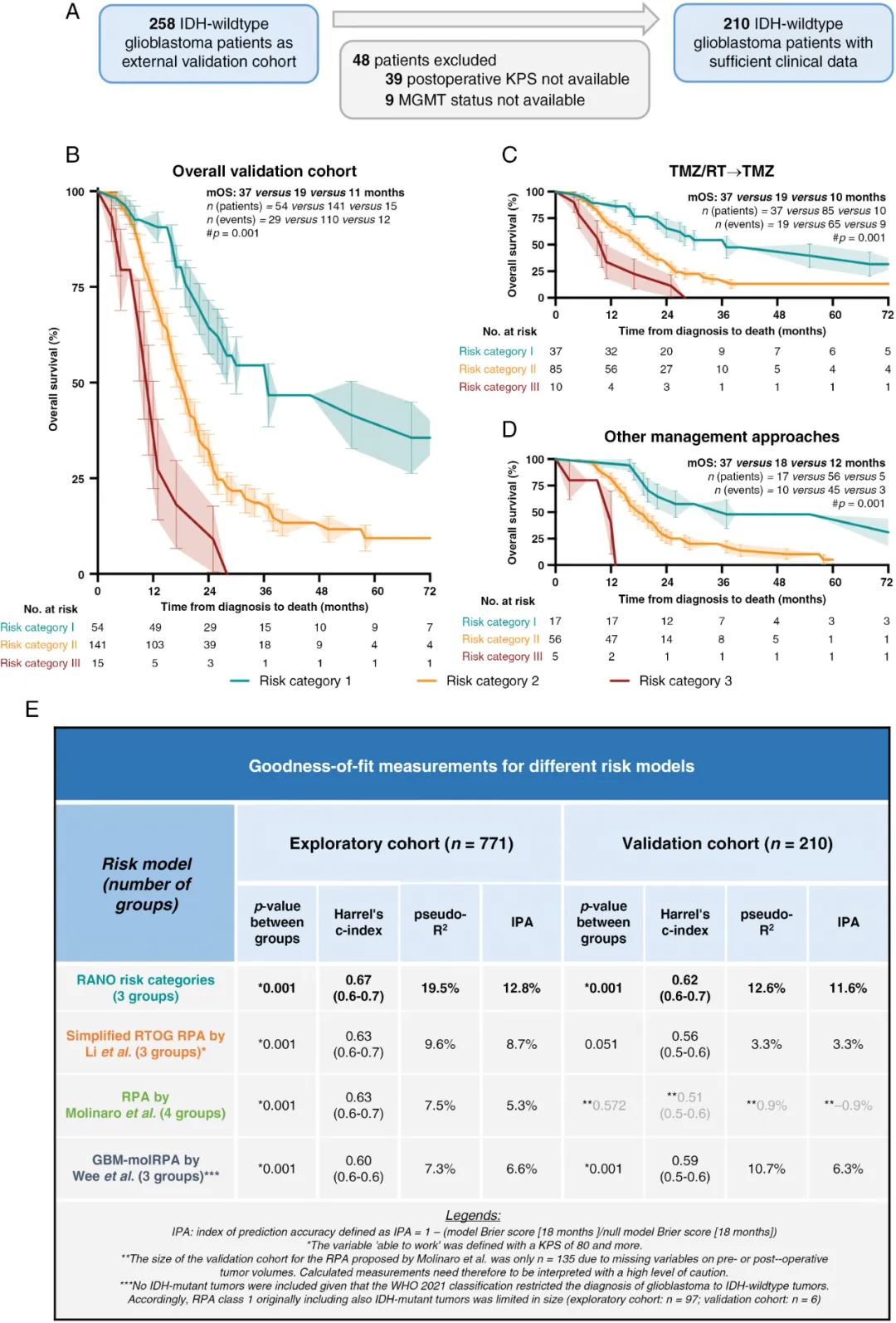
图3评分模型的验证。(A-D)风险评分系统在外部验证队列中的验证;(E)RANO 术后结局风险评分与其他模型之间的拟合优度比较。
参考文献
1. Karschnia P, Dono A, Young JS, et al. Prognostic evaluation of re-resection for recurrent glioblastoma using the novel RANO classification for extent of resection: A report of the RANO resect group. Neuro Oncol. Sep 5 2023;25(9):1672-1685. doi:10.1093/neuonc/noad074
2. Singh K, Hotchkiss KM, Parney IF, et al. Correcting the drug development paradigm for glioblastoma requires serial tissue sampling. Nat Med. Oct 2023;29(10):2402-2405. doi:10.1038/s41591-023-02464-8
3. Rahman R, Polley MC, Alder L, et al. Current drug development and trial designs in neuro-oncology: report from the first American Society of Clinical Oncology and Society for Neuro-Oncology Clinical Trials Conference. Lancet Oncol. Apr 2023;24(4):e161-e171. doi:10.1016/S1470-2045(23)00005-0
4. Wen PY, Weller M, Lee EQ, et al. Glioblastoma in adults: a Society for Neuro-Oncology (SNO) and European Society of Neuro-Oncology (EANO) consensus review on current management and future directions. Neuro Oncol. Aug 17 2020;22(8):1073-1113. doi:10.1093/neuonc/noaa106
5. Weller M, van den Bent M, Preusser M, et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol. Mar 2021;18(3):170-186. doi:10.1038/s41571-020-00447-z
6. Ostrom QT, Shoaf ML, Cioffi G, et al. National-level overall survival patterns for molecularly-defined diffuse glioma types in the United States. Neuro Oncol. Apr 6 2023;25(4):799-807. doi:10.1093/neuonc/noac198
7. Molinaro AM, Hervey-Jumper S, Morshed RA, et al. Association of Maximal Extent of Resection of Contrast-Enhanced and Non-Contrast-Enhanced Tumor With Survival Within Molecular Subgroups of Patients With Newly Diagnosed Glioblastoma. JAMA Oncol. Apr 1 2020;6(4):495-503. doi:10.1001/jamaoncol.2019.6143
8. Gerritsen JKW, Zwarthoed RH, Kilgallon JL, et al. Effect of awake craniotomy in glioblastoma in eloquent areas (GLIOMAP): a propensity score-matched analysis of an international, multicentre, cohort study. Lancet Oncol. Jun 2022;23(6):802-817. doi:10.1016/S1470-2045(22)00213-3
9. Gerritsen JKW, Zwarthoed RH, Kilgallon JL, et al. Impact of maximal extent of resection on postoperative deficits, patient functioning, and survival within clinically important glioblastoma subgroups. Neuro Oncol. May 4 2023;25(5):958-972. doi:10.1093/neuonc/noac255
10. Li J, Wang M, Won M, et al. Validation and simplification of the Radiation Therapy Oncology Group recursive partitioning analysis classification for glioblastoma. Int J Radiat Oncol Biol Phys. Nov 1 2011;81(3):623-30. doi:10.1016/j.ijrobp.2010.06.012
11.Wee CW, Kim E, Kim N, et al. Novel recursive partitioning analysis classification for newly diagnosed glioblastoma: A multi-institutional study highlighting the MGMT promoter methylation and IDH1 gene mutation status. Radiother Oncol. Apr 2017;123(1):106-111. doi:10.1016/j.radonc.2017.02.014

北京协和医学院医学培养模式改革试点班2022级博士生 康筱曼



