病例报告:胃混合性神经-非神经内分泌癌
时间:2024-12-10 11:00:25 热度:37.1℃ 作者:网络
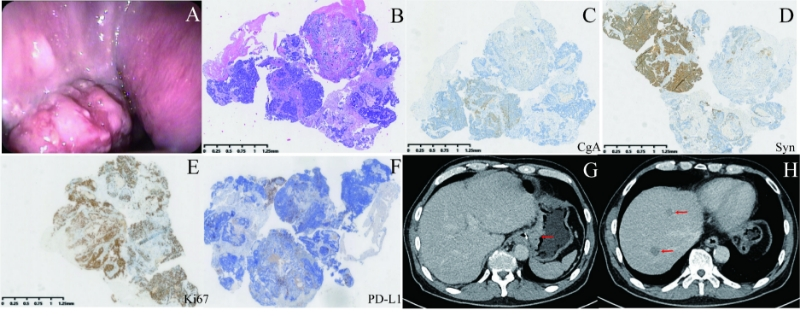
一例具有微卫星高度不稳定性(MSI-H)但错配修复完整(pMMR)的转移性胃混合性神经-非神经内分泌癌患者经过综合治疗后成功进行转换手术:病例报告及文献综述。 该病例已发表在SCI收录期刊Frontiers in Oncology 胃混合性神经-非神经内分泌癌(MANEC)是一种罕见且具有高度侵袭性的恶性肿瘤,具有外分泌和神经内分泌成分。对于转移性病例,治疗选择有限,通常的治疗方法包括化疗和免疫治疗的联合使用。一名68岁男性,患有胃混合性神经-非神经内分泌癌,接受了包括S-1、阿帕替尼、卡度尼利单抗和紫杉醇在内的靶向治疗、免疫治疗和化疗。经过六个疗程治疗,肝转移完全消失,胃肿瘤部分缓解,最终进行了转化手术。患者接受了D2根治性胃切除术,实现了R0切除,包括近端胃切除、脾切除、网膜切除以及食管胃吻合术,同时对肝转移病灶进行了射频消融术。术后病理检查确认肝转移已完全消失,但在胃癌病灶中发现残留腺癌,在胃周围淋巴结中发现神经内分泌成分癌。患者术后七天出院。术后五个月,发现新的肝转移,病理活检提示为神经内分泌分化。随后,患者接受了S-1和帕博利珠单抗的维持治疗,但疾病持续进展。患者最终生存期为17个月。本个案突出显示了胃混合性神经-非神经内分泌癌显著的异质性及其治疗的挑战。虽然转化手术对胃腺癌患者有生存获益,但对于转移性胃混合性神经-非神经内分泌癌,术后早期复发和转移,需要谨慎选择转化手术。未来需要进一步研究评估转换手术在转移性混合性神经-非神经内分泌癌中的长期益处,并开发个体化的治疗策略。 引言 胃混合性腺神经-非神经内分泌癌(MANEC)是一种罕见的胃肿瘤类型,具有外分泌和神经内分泌成分,每种成分在肿瘤中占比均超过30%(1)。2019年,世界卫生组织(WHO)将MANEC归类为胃混合性神经内分泌-非神经内分泌肿瘤的一部分(2)。与胃腺癌相比,MANEC侵袭性更强,更易发生远处转移,这使得其治疗更加具有挑战性(3)。尽管目前缺乏有效的治疗方法来应对转移性胃MANEC,临床上通常采用化疗和免疫治疗。然而,这种癌症通常对化疗的反应较差(4)。回顾性研究表明,转化手术可能对IV期胃腺癌患者带来生存获益(5-7)。然而,关于转化手术是否对IV期胃神经内分泌癌或胃MANEC患者提供类似的益处,目前仍存在争议(8, 9)。 在本报告中,我们介绍了一例转移性胃MANEC的独特病例,该患者肿瘤表现出微卫星高度不稳定性(MSI-H)但错配修复完整。该患者在接受靶向治疗、免疫治疗和化疗方案后,成功进行了转化手术,实现了D2胃切除和R0切除。我们的目的是探讨转化手术在转移性胃MANEC治疗中的潜在使用并提供更深入的认识。 病例介绍 2023年3月,一名68岁男性因持续三个月的上腹部间歇性疼痛前往当地医院就诊。患者自述在过去三个月内体重减轻了3公斤,并提到有超过四十年的偶尔饮酒和吸烟史。胃镜检查显示胃贲门及胃体部位有一个大的不规则病变,病理结果提示中度分化的腺癌。患者无明显的既往病史,也无糖尿病、高血压等合并症。此外,患者没有家族肿瘤史或遗传性疾病史。为进一步评估和治疗,患者被转诊至我院。 在我院,患者接受了全面的体格检查。腹部平坦,左上腹有轻度压痛,其他部位的体格检查未见异常。此外,患者还接受了增强腹部CT、胃镜超声检查以及胃肿瘤活检(图1)。CT显示贲门和胃底部的胃壁增厚,扩展至下段食管,同时伴有后腹膜淋巴结转移。此外,肝脏内发现多个低密度结节,提示胃癌肝转移。病理和免疫组化结果表明胃肿瘤为胃混合性腺神经内分泌癌(MANEC)。胃肿瘤细胞的PD-L1免疫组化检测显示局部阳性。该胃MANEC分期为IV期(cT4N3M1)。 图1.第一次入院时的病人检查。(A)在胃镜检查时可见肿瘤。(B)胃镜下活检标本的 HE染色。(C、D、E、F)CgA、Syn、Ki67和PD-L1的免疫组化染色。CgA和PD-L1表现为局灶性阳性,而Syn和Ki67表现为强阳性。(G、H)CT显示胃壁增厚,肝转移。 该患者随后接受了综合治疗方案:S-1(60 mg,口服,每天两次,1至14天),阿帕替尼(0.25 g,口服,每天一次,1至21天),卡度尼利单抗(720 mg,静脉注射,第1天),紫杉醇(210 mg,静脉注射,第1天),每个治疗周期持续三周。经过六个治疗周期,原发肿瘤实现部分缓解,肝转移完全消失(图2)。第七周期时,阿帕替尼被停用,患者继续接受化疗和免疫治疗,并随后进行转化手术。术前检查未发现其他合并症。 图2.综合治疗后对患者的检查。(A、B、D、E)新辅助治疗后,PETCT显示胃肿瘤缩小,肝转移消失。(C)胃镜检查时肿瘤体积缩小。(F) MRI显示无肝转移。 手术非常手术顺利,无术中或术后并发症。手术包括近端胃切除、脾切除、网膜切除及食管胃吻合术。术中冰冻病理提示肝转移灶消失。为了减少肝转移灶复发,对原转移灶部位进行了射频消融。手术成功实现R0切除,患者恢复良好,术后七天出院。术后常规病理提示原肝转移病灶部位为炎性细胞,胃病灶中存在大量残留腺癌组织。胃病灶的病理和免疫组化结果证实为胃混合性腺神经内分泌癌,且为pMMR。此外,肿瘤为EB病毒(EBV)和HER2阴性。然而,基于聚合酶链反应(PCR)的基因检测揭示该胃MANEC具有微卫星不稳定性高(MSI-H)。后续肿瘤多个部位基因检测一致显示MSI-H状态。术后,该胃MANEC被分为IIa期(ypT2N1M0)。患者术后拒绝了进一步的辅助治疗,选择了定期随访。 图3.胃癌的治疗过程及术后病理检查。(A)术后胃癌的 HE染色。(B,C)CgA和Syn的免疫组化染色显示局灶性阳性。(D)患者的治疗过程。 术后五个月,患者复查腹部CT显示肝脏内多发新的低密度病灶(图4)。随后,病灶活检证实为具有神经内分泌成分的低分化癌。根据患者的病史,这些结果提示肿瘤复发。由于患者全身情况较差且年龄较大,肿瘤复发后选择了S-1单药化疗和帕博利珠单抗联合治疗。然而疾病持续进展。患者于今年8月去世,总体生存期为17个月。 图4.术后肝转移灶的检查。(A、B)CT显示有新的肝转移灶。对新发肝转移瘤的活检组织进行(C) HE染色。(D,E,F)CgA、Syn、CD56的免疫组化染色。CgA和CD56呈局灶性阳性,而Syn呈强阳性。 讨论 胃MANEC作为一种罕见的恶性肿瘤,其生物学行为与胃腺癌不同,通常倾向于在早期就发生远处转移(10)。研究发现,当胃癌中的神经内分泌成分超过10%时,通常会成为不良预后因素(11)。对于早期胃神经内分泌癌和胃MANEC,手术是主要的治疗手段。然而,一旦胃MANEC发生转移,化疗成为治疗的主要手段,通常不考虑手术治疗。在出现严重并发症如出血或幽门梗阻时,可能会进行姑息性切除。 转化手术是指在经过化疗、靶向治疗、免疫治疗或其他治疗后,原发肿瘤和转移灶均得到部分或完全缓解时,进行根治性手术治疗。对于最初为转移性胃腺癌的患者,在化疗后如果进行转化手术并实现R0切除,会提高生存。实际上,一些病例报告报道了通过化疗和免疫治疗联合治疗,成功实现转化手术并达到病理完全缓解(12, 13)。回顾性研究表明,原发肿瘤手术可能为转移性胃癌患者带来生存获益(14-16)。然而,需要注意的是,这些研究涵盖了各种类型的胃癌,并未专门针对胃神经内分泌癌或胃MANEC等亚组进行研究。关于转化手术在转移性胃MANEC中的应用研究非常有限。随着转移性胃MANEC治疗选择的不断丰富,当肿瘤经过各种系统治疗后实现部分或完全缓解时,转化手术的可行性值得研究。 微卫星不稳定性(MSI)是胃癌中的一个关键分子亚型,可指导治疗决策。通常,胃癌中的MSI-H与错配修复缺陷(dMMR)密切相关(17, 18)。有意思的是,该患者的胃MANEC虽然具有pMMR状态,但却表现为MSI-H。胃癌中出现MSI-H和dMMR不一致的结果时,建议进行额外的检测。因此,我们在术后对多处胃部病灶以及初次胃镜活检的病灶进行了基因检测,结果一致显示为MSI-H状态。免疫组化对MMR蛋白的结果解释可能是导致这种差异的原因之一(19)。不同病理医生的独立复审一致确认,根据免疫组化结果,肿瘤表现为pMMR。在一项比较MSI检测和MMR蛋白免疫组化的研究中,分析了超过5000例胃癌组织样本,发现具有pMMR状态但MSI-H发生率仅为0.05%(20)。MMR蛋白中的罕见错义突变(如MLH1和MSH6)可能影响蛋白功能,而不会影响蛋白翻译或抗原性,这可能导致这种差异(21, 22)。二代基因测序可以用于检测这些错义突变。此外,这种差异也可能是由其他信号通路的改变、基因组中特定区域的突变引起的微卫星不稳定性,而并不直接改变负责错配修复的蛋白质。最后,免疫组化检测的技术局限性也可能是导致该问题的原因之一。 在错配修复缺陷(dMMR)/微卫星不稳定性高(MSI-H)胃癌患者中,化疗的生存益处仍然存在争议(23)。MSI-H肿瘤中的大量突变产生新的抗原,这些抗原激活免疫系统,从而提高了免疫治疗的反应率(24, 25)。值得注意的是,研究表明,在局部晚期dMMR/MSI-H胃癌或胃食管腺癌患者中,联合免疫治疗(nivolumab加ipilimumab,针对PD-1和CTLA-4)可以在超过一半的患者中实现病理完全缓解(pCR)(24)。在我们的研究中,该患者肿瘤为MSI-H,且PD-L1免疫组化显示局部阳性,提示该患者可能从免疫治疗中受益。我们采用了一种新型的免疫治疗药物——卡度尼利单抗。卡度尼利单抗是全球首个双特异性抗体,能够同时靶向PD-1和CTLA-4(26)。2017年,美国食品和药物管理局(FDA)批准了帕博利珠单抗用于治疗无法切除或转移的dMMR/MSI-H实体瘤(27)。术后,随着新的肝转移灶的出现,患者接受了帕博利珠单抗与S-1联合治疗。 尽管在术前治疗后肝转移可能已经消失,但癌细胞仍然可能已转移到身体的其他部位,只是未被检测到。术后早期出现的肝转移可能源于手术前已经转移至其他部位的癌细胞。值得注意的是,系统治疗后淋巴结转移癌和术后复发肝脏转移灶都为神经内分泌成分癌。这一观察结果表明,胃癌中的神经内分泌成分表现出更高的恶性度和更高的转移倾向。研究发现,胃MANEC中的神经内分泌成分起源于腺癌,这种转变导致恶性程度增加【28】。在少数报道的胃MANEC转移病例中,手术后往往很快发生新的肝转移(表1)。在本研究中,术后五个月发现新的肝转移,并被确认为神经内分泌癌。尽管之前的报告未对新的肝转移进行活检,但考虑到肿瘤的转移和复发倾向,极有可能这些新的肝转移也是神经内分泌癌。尽管实现了R0切除,转化手术未能明显提高该患者的生存期。这可能与肿瘤的神经内分泌成分密切相关。 这些发现突显了胃癌的显著异质性。尽管在靶向治疗和免疫治疗时代,转化手术可提高晚期胃腺癌患者的生存,但在治疗晚期胃神经内分泌癌和混合性腺神经内分泌癌时,仍需谨慎考虑转化手术。未来需要进一步研究评估转化手术在转移性胃MANEC中的长期益处,并制定个性化的治疗策略 结论 本病例提示了在系统治疗(包括靶向治疗、免疫治疗和化疗)后,转化手术可能可以应用于转移性胃MANEC。然而尽管转化手术实现了R0切除,但早期肝转移灶复发突显了该疾病治疗的复杂性和该疾病具有高度恶性。这些发现表明,尽管转化手术在晚期胃腺癌中可能有效,但对于胃MANEC而言仍需谨慎考虑。 参考文献 1. Fléjou JF. [WHO Classification of digestive tumors: the fourth edition]. Ann Pathol. 2011;31(5 Suppl):S27-31. 2. Nagtegaal ID, Odze RD, Klimstra D, Paradis V, Rugge M, Schirmacher P, et al. The 2019 WHO classification of tumours of the digestive system. Histopathology. 2020;76(2):182-8. 3. Lin J, Zhao Y, Zhou Y, Tian Y, He Q, Lin J, et al. Comparison of Survival and Patterns of Recurrence in Gastric Neuroendocrine Carcinoma, Mixed Adenoneuroendocrine Carcinoma, and Adenocarcinoma. JAMA Netw Open. 2021;4(7):e2114180. 4. Lin Z, Kwok HF. RUNDC3A/SNAP25/Akt signaling mediates tumor progression and chemoresistance in gastric neuroendocrine carcinoma. Cell Death Dis. 2022;13(10):840. 5. Choe HJ, Kim JW, Han SH, Lee JH, Ahn SH, Park DJ, et al. Conversion Surgery in Metastatic Gastric Cancer and Cancer Dormancy as a Prognostic Biomarker. Cancers (Basel). 2019;12(1). 6. Morgagni P, Solaini L, Framarini M, Vittimberga G, Gardini A, Tringali D, et al. Conversion surgery for gastric cancer: A cohort study from a western center. Int J Surg. 2018;53:360-5. 7. Yoshida K, Yamaguchi K, Okumura N, Tanahashi T, Kodera Y. Is conversion therapy possible in stage IV gastric cancer: the proposal of new biological categories of classification. Gastric Cancer. 2016;19(2):329-38. 8. Li Z, Ren H, Wang T, Zhang X, Zhao L, Sun C, et al. Resection of the Primary Tumor Improves the Survival of Patients With Stage IV Gastric Neuroendocrine Carcinoma. Front Oncol. 2022;12:930491. 9. Zheng M, Li Y, Li T, Zhang L, Zhou L. Resection of the primary tumor improves survival in patients with gastro-entero-pancreatic neuroendocrine neoplasms with liver metastases: A SEER-based analysis. Cancer Med. 2019;8(11):5128-36. 10. Lin JP, Zhao YJ, He QL, Hao HK, Tian YT, Zou BB, et al. Adjuvant chemotherapy for patients with gastric neuroendocrine carcinomas or mixed adenoneuroendocrine carcinomas. Br J Surg. 2020;107(9):1163-70. 11. Park JY, Ryu MH, Park YS, Park HJ, Ryoo BY, Kim MG, et al. Prognostic significance of neuroendocrine components in gastric carcinomas. Eur J Cancer. 2014;50(16):2802-9. 12. Matsumoto R, Arigami T, Matsushita D, Okubo K, Tanaka T, Yanagita S, et al. Conversion surgery for stage IV gastric cancer with a complete pathological response to nivolumab: a case report. World J Surg Oncol. 2020;18(1):179. 13. Izumo W, Hosoda K, Kuramochi H, Nakajima G, Maeda S, Ito S, et al. A Case of Pathologically Complete Response After Nivolumab Combined with Chemotherapy in a Gastric Cancer Patient with Virchow's Lymph Node Metastasis. Clin Exp Gastroenterol. 2023;16:107-15. 14. Park JY, Yu B, Park KB, Kwon OK, Lee SS, Chung HY. Impact of Palliative Gastrectomy in Patients with Incurable Gastric Cancer. Medicina (Kaunas). 2021;57(3). 15. Ren B, Yang Y, Lv Y, Liu K. Survival benefits of palliative gastrectomy for gastric cancer patients with liver metastasis: a population-based propensity score-matched cohort analysis. Front Oncol. 2023;13:1309699. 16. Wu J, Yu J, Chen Z, Zhu H, Zhong C, Liang Y, et al. Survival benefit of primary tumor resection for gastric cancer with liver metastasis: A propensity score-matched, population-based study. Front Oncol. 2022;12:1039086. 17. Kim HS, Lee BL, Woo DK, Bae SI, Kim WH. Assessment of markers for the identification of microsatellite instability phenotype in gastric neoplasms. Cancer Lett. 2001;164(1):61-8. 18. Smyth EC, Wotherspoon A, Peckitt C, Gonzalez D, Hulkki-Wilson S, Eltahir Z, et al. Mismatch Repair Deficiency, Microsatellite Instability, and Survival: An Exploratory Analysis of the Medical Research Council Adjuvant Gastric Infusional Chemotherapy (MAGIC) Trial. JAMA Oncol. 2017;3(9):1197-203. 19. Sari A, Pollett A, Eiriksson LR, Lumsden-Johanson B, Van de Laar E, Kazerouni H, et al. Interobserver Agreement for Mismatch Repair Protein Immunohistochemistry in Endometrial and Nonserous, Nonmucinous Ovarian Carcinomas. Am J Surg Pathol. 2019;43(5):591-600. 20. Park Y, Nam SK, Seo SH, Park KU, Oh HJ, Park YS, et al. Comprehensive Study of Microsatellite Instability Testing and Its Comparison With Immunohistochemistry in Gastric Cancers. J Gastric Cancer. 2023;23(2):264-74. 21. Klarskov L, Holck S, Bernstein I, Okkels H, Rambech E, Baldetorp B, et al. Challenges in the identification of MSH6-associated colorectal cancer: rectal location, less typical histology, and a subset with retained mismatch repair function. Am J Surg Pathol. 2011;35(9):1391-9. 22. Pino MS, Chung DC. Microsatellite instability in the management of colorectal cancer. Expert Rev Gastroenterol Hepatol. 2011;5(3):385-99. 23. Wu H, Ma W, Jiang C, Li N, Xu X, Ding Y, et al. Heterogeneity and Adjuvant Therapeutic Approaches in MSI-H/dMMR Resectable Gastric Cancer: Emerging Trends in Immunotherapy. Ann Surg Oncol. 2023;30(13):8572-87. 24. André T, Tougeron D, Piessen G, de la Fouchardière C, Louvet C, Adenis A, et al. Neoadjuvant Nivolumab Plus Ipilimumab and Adjuvant Nivolumab in Localized Deficient Mismatch Repair/Microsatellite Instability-High Gastric or Esophagogastric Junction Adenocarcinoma: The GERCOR NEONIPIGA Phase II Study. J Clin Oncol. 2023;41(2):255-65. 25. Lei X, Wang Y, Shan F, Li S, Jia Y, Miao R, et al. Efficacy and safety of preoperative immunotherapy alone followed by surgery in the treatment of advanced gastric cancer with MSI-H/dMMR or EBV-positive. J Chin Med Assoc. 2023;86(8):717-24. 26. Keam SJ. Cadonilimab: First Approval. Drugs. 2022;82(12):1333-9. 27. Hargadon KM, Johnson CE, Williams CJ. Immune checkpoint blockade therapy for cancer: An overview of FDA-approved immune checkpoint inhibitors. Int Immunopharmacol. 2018;62:29-39. 28. Qiu MZ, Chen Q, Zheng DY, Zhao Q, Wu QN, Zhou ZW, et al. Precise microdissection of gastric mixed adeno-neuroendocrine carcinoma dissects its genomic landscape and evolutionary clonal origins. Cell Rep. 2023;42(6):112576. 29. Chen H, Shu M, Chen S, Xue L, Lin Y. Clinicopathological features and lymph node metastatic patterns of gastric mixed adenoneuroendocrine carcinoma. Histol Histopathol. 2019;34(4):373-9. 30. Nagata H, Tsujimoto H, Yaguchi Y, Kouzu K, Itazaki Y, Ishibashi Y, et al. Mixed adenoneuroendocrine carcinoma with loss of HER2 positivity after trastuzumab-based chemotherapy for HER2-positive gastric cancer: a case report. Surg Case Rep. 2020;6(1):5. 31. Zhang W, Xiao W, Ma H, Sun M, Chen H, Zheng S. Neuroendocrine liver metastasis in gastric mixed adenoneuroendocrine carcinoma with trilineage cell differentiation: a case report. Int J Clin Exp Pathol. 2014;7(9):6333-8. 32. Inaba Y, Fujita M, Ninomiya R, Hashimoto D. [Conversion Therapy Using Etoposide and Cisplatin Chemotherapy for Liver Metastases from Advanced Gastric Mixed Adenoneuroendocrine Carcinoma - A Case Report]. Gan To Kagaku Ryoho. 2017;44(12):1488-90.