朱晨旭最新Nature Methods:单细胞DNA损伤检测新方法
时间:2025-03-27 12:14:14 热度:37.1℃ 作者:网络
在多细胞生物体中,基因组的稳定性对于维持正常生理功能至关重要。然而,随着个体的生长与环境的变化,DNA损伤不断累积,影响基因表达及细胞功能。尽管已有研究表明DNA损伤与衰老、癌症及神经退行性疾病密切相关,但由于技术限制,科学家们尚未能在单细胞分辨率下全面解析DNA损伤的分布及其对基因调控的影响。
2025年3月24日,纽约基因组中心/威尔康奈尔医学院朱晨旭实验室在《Nature Methods》期刊上发表了一篇题为:Single-cell parallel analysis of DNA damage and transcriptome reveals selective genome vulnerability的论文。该论文共同第一作者是纽约基因组中心博士后柏东生和毕业生曹振坤。
该论文开发了Paired-Damage-seq技术,实现了单细胞层面上同时解析氧化性DNA损伤、单链DNA断裂(SSBs)及转录组。通过这一方法,研究者揭示了基因组损伤的选择性脆弱性,并分析了其在不同细胞类型中的分布模式及潜在的生物学影响。

Paired-Damage-seq:单细胞DNA损伤检测新方法
为了在单细胞水平上揭示DNA损伤的分布特征及其对基因表达的影响,研究者开发了Paired-Damage-seq技术,该方法利用“标记-修复”策略对氧化性DNA损伤和单链DNA断裂(SSBs)进行生物素标记,并结合单细胞RNA测序(scRNA-seq)进行联合分析。在HeLa细胞的实验验证中,研究者首先通过特定酶(Nt.BbvCI)人工诱导单链断裂,并观察到Paired-Damage-seq检测的损伤信号与预期的切割位点高度相关。此外,通过H₂O₂诱导氧化应激,研究者发现DNA损伤水平随H₂O₂浓度增加而升高,进一步证明了该方法能够灵敏检测氧化性DNA损伤。UMAP降维分析显示,不同时间点的细胞基因表达模式存在明显变化,表明DNA损伤可能影响基因调控。综合来看,Paired-Damage-seq为高效检测单细胞DNA损伤及其对基因表达的影响提供了强有力的工具。
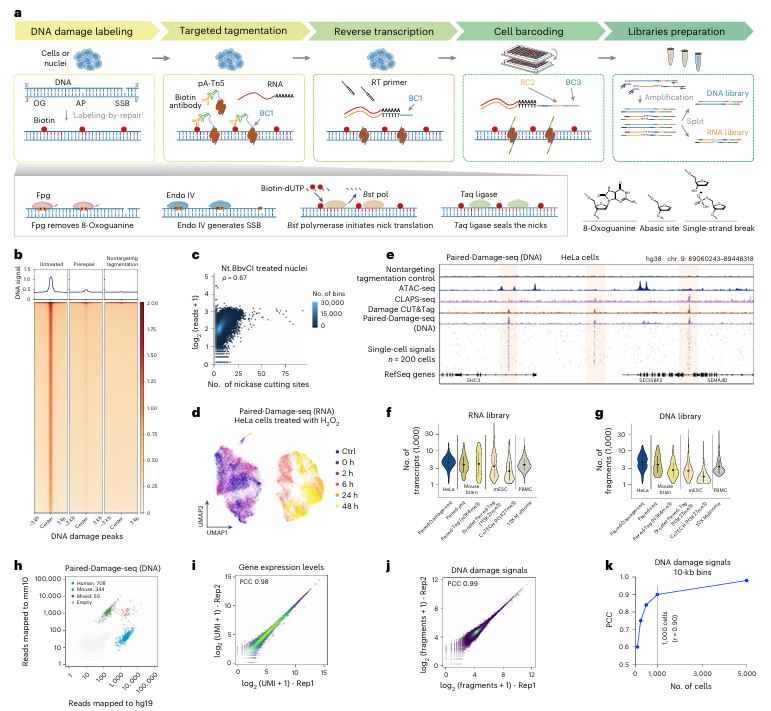
图1:单细胞中氧化DNA损伤与单链DNA损伤的联合转录组分析
DNA损伤的基因组分布模式
基于Paired-Damage-seq技术,研究者进一步探讨了DNA损伤在基因组中的分布特征及其与表观遗传状态的关系。结果显示,DNA损伤在异染色质(compartment B)中的累积程度高于常染色质(compartment A),这一发现与癌细胞中突变更容易在异染色质区域发生的现象一致。此外,增强子区域(Enhancer)和基因内部的转录区域(Transcribed regions)富含DNA损伤,而pK27me3修饰的多聚梳沉默区(Polycomb-associated heterochromatin)则较少受损,提示特定染色质结构可能影响DNA损伤的发生和修复。进一步分析发现,DNA损伤水平的升高与ATAC-seq信号的降低呈负相关,并且在DNA损伤热点区域,pK9me3水平显著下降,这意味着DNA损伤可能导致染色质封闭及表观遗传记忆的丧失。这些结果表明,DNA损伤的发生受到染色质状态的调控,并可能影响细胞的长期基因调控能力。
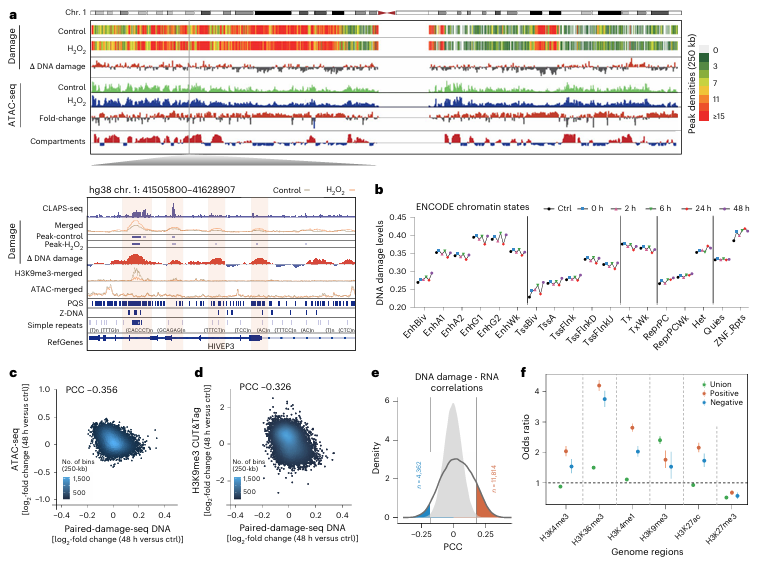
图2:HeLa细胞中氧化DNA损伤热点区域的分布
细胞类型特异性的DNA损伤模式:小鼠大脑研究
研究者将Paired-Damage-seq技术应用于小鼠大脑,以探索不同细胞类型的DNA损伤模式。单细胞RNA测序数据的聚类分析识别出了八种主要细胞类型,包括兴奋性神经元(ExN)、抑制性神经元(InN)、星形胶质细胞(AST)和小胶质细胞(MiG)等。结果发现,DNA损伤在不同细胞类型中特定基因座上富集,例如小胶质细胞中特异性高表达的Csf1r基因区域具有更高的DNA损伤水平。此外,在所有脑细胞类型中,异染色质区域的DNA损伤水平始终高于常染色质区域,说明DNA损伤的分布模式在组织水平上具有一定的保守性。值得注意的是,DNA损伤在CpG岛、LINEs和短串联重复序列(STRs)区域高度富集,并且神经元特异性的增强子区域(pK27ac+)表现出更高的DNA损伤水平,提示DNA损伤可能影响神经元的基因调控网络,从而对大脑功能产生深远影响。
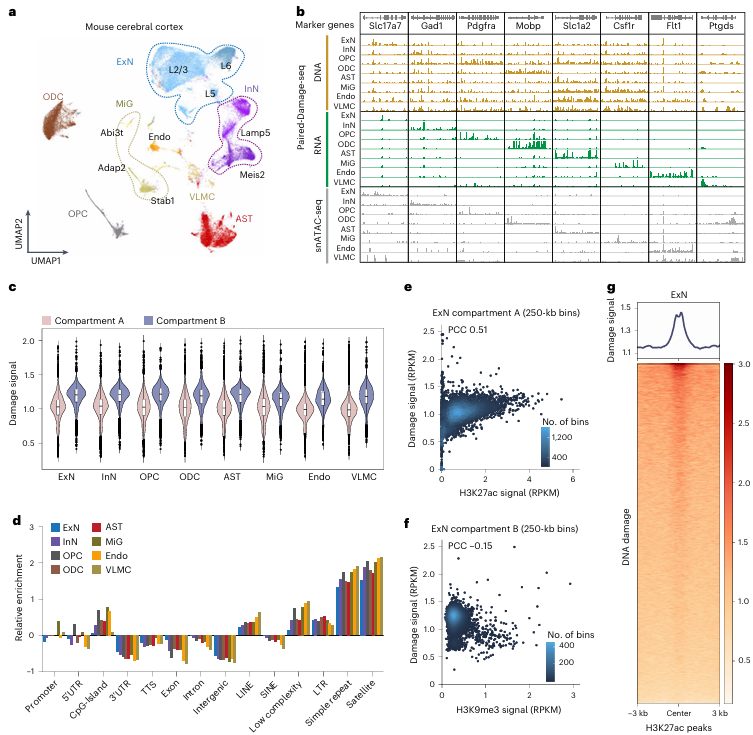
图3:小鼠大脑中细胞类型特异的DNA损伤图谱
DNA损伤与疾病风险的关联
考虑到DNA损伤的累积可能与多种神经系统疾病相关,研究者进一步分析了DNA损伤热点与疾病风险的关系。通过基因组关联研究(GWAS)数据的比对,他们发现兴奋性神经元的DNA损伤热点与抑郁症风险高度相关,而小胶质细胞的DNA损伤热点与阿尔茨海默病风险相关。此外,研究者在老龄小鼠中观察到,DNA损伤热点区域的染色质可及性明显下降,表明DNA损伤的积累可能影响基因的正常表达模式。进一步分析发现,在神经元、少突胶质细胞和星形胶质细胞中,高DNA损伤区域的pK9me3修饰水平随年龄下降,表明DNA损伤可能导致表观遗传记忆的丧失。这些结果提示,DNA损伤的积累不仅影响细胞功能,还可能增加神经退行性疾病的易感性,为疾病的早期干预提供了新的研究方向。
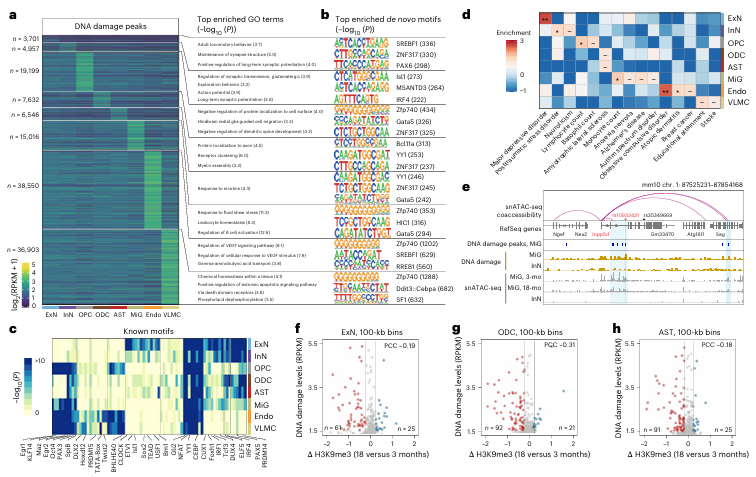
图4:与多种细胞功能相关的细胞类型特异性DNA损伤热点
【小结】
本研究通过Paired-Damage-seq技术揭示了基因组损伤的选择性脆弱性,并提供了DNA损伤如何影响基因表达、表观遗传记忆及疾病风险的新见解。未来,该技术可应用于衰老研究、神经退行性疾病及癌症研究,为疾病的早期干预和治疗提供新思路。
原文链接:
https://doi.org/10.1038/s41592-025-02632-3

