STTT:解放军总医院张旭院士团队、华中科技大学王志华教授团队、复旦大学卫功宏教授等团队在前列腺癌领域最新发现
时间:2025-03-18 12:09:02 热度:37.1℃ 作者:网络
活性增强子作为基因表达的关键调控元件,不仅能够通过远程染色质环化机制精确调控靶基因转录,还可产生一类新型非编码RNA——增强子RNA(eRNA)。近年来研究表明,eRNA在恶性肿瘤的发生发展中扮演着重要角色,然而其在前列腺癌进展中的具体功能及分子机制仍是一个亟待解决的科学问题。
2025年3月14日,由华中科技大学同济医学院附属同济医院王志华教授、复旦大学上海医学院卫功宏教授、解放军总医院张旭院士领衔的研究团队在Signal Transduction and Targeted Therapy在线发表题为“Enhancer transcription profiling reveals an enhancer RNA-driven ferroptosis and new therapeutic opportunities in prostate cancer”的研究论文。研究团队通过整合染色质可及性测序(ATAC-seq)和转录组测序(RNA-seq)技术,系统揭示了eRNA在前列腺癌中的关键调控作用,创新性地提出了通过靶向eRNA调控铁死亡的新型治疗策略。
这项研究系统构建中国前列腺人群eRNA表达谱,发现LTFe-LTF轴在调控铁死亡和肿瘤抑制中的关键作用。通过揭示AR信号对LTFe-LTF轴的负向调控机制,研究为克服CRPC的治疗耐药性提供了新的思路。这一发现不仅深化了对前列腺癌表观遗传调控机制的理解,也为开发基于eRNA的精准治疗策略开辟新的方向。

前列腺癌作为全球男性最常见恶性肿瘤之一,其临床病程呈现显著异质性,涵盖从惰性生长到侵袭性转移的广泛谱系,这一特征凸显了精准分子分型对优化治疗策略的重要性。近十年来,基于大规模基因组和转录组测序的研究虽已阐明前列腺癌的关键遗传变异,但对非编码调控元件,特别是增强子在肿瘤进展中的作用机制仍知之甚少。值得注意的是,增强子失调在致癌转录程序中的核心调控作用日益受到关注,这为深入探索前列腺癌的表观遗传调控机制提供了新的研究方向。
增强子作为远端调控元件,通过染色质环化与靶基因启动子相互作用,以细胞类型特异性方式精细调控基因表达。其中,增强子RNA(eRNA)作为增强子活性的重要标志物,在转录调控中发挥多重作用:包括稳定增强子-启动子环、建立染色质可及性、招募转录共激活因子以及调控转录延伸等。特别是在激素依赖性肿瘤中,eRNA与性激素信号通路的交互作用已成为研究热点。然而,eRNA在前列腺癌AR信号网络中的具体调控机制及其功能贡献仍有待深入阐明。
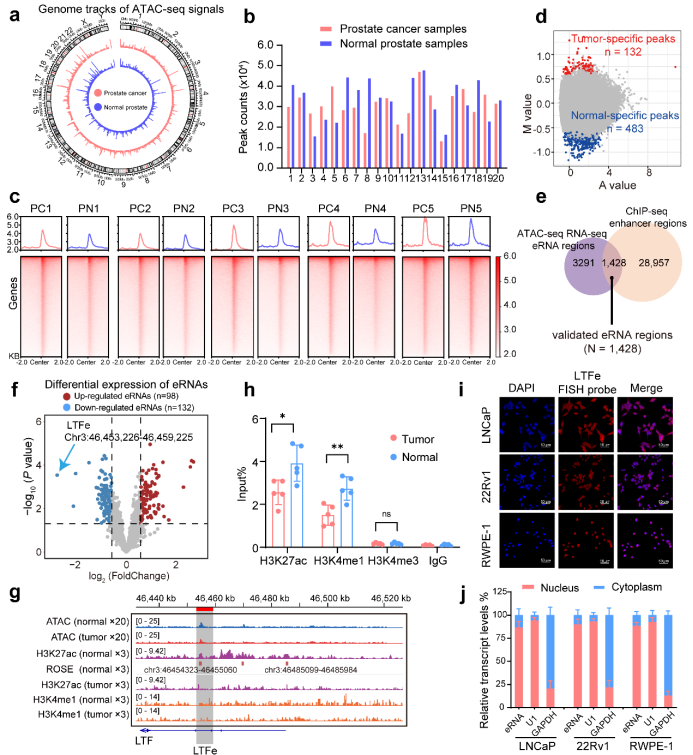
图1:前列腺癌染色质可及性和增强子转录谱分析。(摘自Signal Transduction and Targeted Therapy )
染色质分析技术的进展,如转座酶可及染色质测序(ATAC-seq),显著增进了我们对染色质可及性的理解,特别是在临床可用或冷冻组织样本中。ATAC-seq能够识别开放染色质区域,为绘制癌细胞和临床样本中的活性增强子提供了强大的工具。利用癌症基因组图谱(TCGA)和其他大规模前列腺癌队列的转录组数据集,跨多种癌症的全基因组染色质可及性研究揭示了与疾病进展相关的广泛染色质重塑事件。然而,在前列腺肿瘤发生中控制染色质可及性的精确调控机制,特别是eRNA在调节转录中的作用,仍然很大程度上未被探索。解决这些空白对于理解表观遗传重编程如何促进前列腺癌的恶性和治疗抵抗至关重要。
为了解决这一空白,本研究整合ATAC-seq和RNA-seq技术,对20对前列腺癌及癌旁组织进行了系统分析,鉴定出具有潜在功能意义的eRNA分子。其中,乳铁蛋白-eRNA(LTFe)作为关键肿瘤抑制因子,在前列腺癌组织中显著下调。机制研究表明,LTFe通过结合异质核核糖核蛋白F(HNRNPF),促进增强子-启动子相互作用,从而激活乳铁蛋白(LTF)表达,抑制肿瘤增殖并诱导铁死亡。值得注意的是,AR信号可破坏这一调控网络,而抗AR药物恩杂鲁胺(ENZ)与铁死亡诱导剂RSL3的联合应用可协同抑制肿瘤生长。这一发现为克服去势抵抗性前列腺癌(CRPC)的治疗耐药提供了新的策略。
本研究首次揭示了LTFe在前列腺癌中的肿瘤抑制功能,阐明了eRNA介导的表观遗传调控新机制,为开发基于增强子调控的精准治疗策略奠定了理论基础。这些发现不仅拓展了对前列腺癌生物学行为的认知,也为克服治疗耐药提供了潜在的治疗靶点。
参考信息:
https://doi.org/10.1038/s41392-025-02170-6


