Science子刊:华中科技大学孙朝阳等表明NHIPEC可增强高级别浆液性卵巢癌的肿瘤反应
时间:2025-03-18 12:09:05 热度:37.1℃ 作者:网络
卵巢癌腹腔热灌注化疗(HIPEC)的益处仍有争议,阻碍了基于热疗(HT)的合理联合治疗的发展。
2025年3月12日,华中科技大学孙朝阳、陈刚、中山大学李晶、海南大学盛夏共同通讯在Science Translational Medicine在线发表题为“Heterogeneous cellular responses to hyperthermia support combined intraperitoneal hyperthermic immunotherapy for ovarian cancer mouse models”的研究论文,该研究报告了新辅助HIPEC (NHIPEC)试验的初步结果,表明NHIPEC可增强高级别浆液性卵巢癌的肿瘤反应。
该研究通过单细胞RNA测序分析,确定了肿瘤和微环境中对HT的同质和异质细胞反应。上皮间质转化激活的肿瘤细胞和基质金属蛋白酶11 (MMP-11)+癌相关成纤维细胞(CAFs)对HT表现出更大的减少和更高的敏感性。CUT&Tag和RNA测序整合揭示了肿瘤细胞和caf中HSF1在常温(NT)和高温下的差异结合程序和转录调控机制。此外,HT改善了免疫抑制肿瘤微环境,体内小鼠模型证实了HT和程序性细胞死亡配体1阻断的联合抗肿瘤作用。这些发现为卵巢癌HT的合理联合治疗提供了一个创新的策略。
上皮性卵巢癌(EOC)是全球最致命的妇科恶性肿瘤,通常在晚期诊断为广泛腹膜转移,导致预后不良和治疗选择有限。初次减瘤手术(PDS)后进行辅助化疗是晚期卵巢癌患者的标准治疗方法。虽然新辅助化疗(NACT)提高了最佳细胞减少的可能性,但它并不能提供生存益处。因此,当务之急是探索增加NACT治疗效果的创新方法。热疗联合化疗是一种很有前途的治疗方法,特别是对卵巢癌腹膜转移的治疗。然而,HIPEC对EOC患者的益处仍有争议。尽管对HT在癌细胞中的机制进行了广泛的研究,但其对肿瘤细胞的选择性作用及其对肿瘤微环境(TME)的各种成分(包括基质细胞和免疫细胞)的影响仍然不太清楚。
热休克因子1 (HSF1)是热休克反应(HSR)的关键调节因子,协调热休克蛋白(HSPs)在热休克反应中的表达。最近的研究强调了在正常体温条件下,HSF1在癌细胞中驱动致癌程序的关键作用。然而,它参与调节TME内的癌症相关成纤维细胞(CAFs)和免疫细胞,这些细胞已知在恶性进展中起关键作用,但仍不清楚。理解HSF1在这些细胞成分中的潜在作用将提供有价值的见解。此外,HSF1在常温(NT)下的不同作用与其在HT后的反应相比,其潜在的机制还不清楚。需要进一步的研究来揭示控制HSF1在促进恶性肿瘤和对热应激反应中的这些不同作用的精确机制。填补这些知识空白将加深人们对HSF1参与肿瘤发生及其对治疗干预的影响的理解,有必要对HSF1和TME不同细胞成分之间的复杂相互作用进行全面调查。
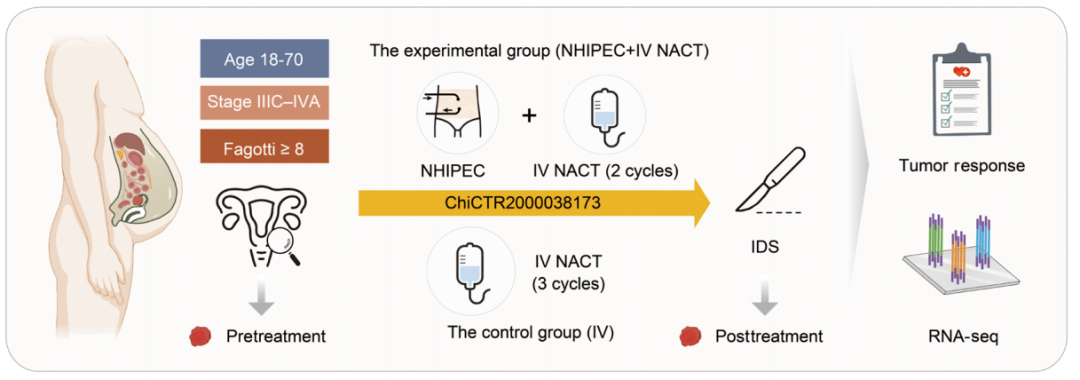
NHIPEC试验示意图(图源自Science Translational Medicine )
在这项研究中,研究人员报告了新辅助HIPEC (NHIPEC)试验(ChiCTR2000038173) (17)的初步结果,这是第一项使用HIPEC作为新辅助治疗的对照临床研究。与静脉注射NACT组(42.4%比18.9%)相比,静脉注射NACT(静脉注射NACT)中加入NHIPEC后,化疗反应评分(CRS)达到3分的比率显著增加;P = 0.03)。单细胞RNA测序(scRNA-seq)分析揭示了不同细胞类型甚至不同细胞状态中的异质性HSRs。通过结合靶下切割和标记(CUT&Tag)以及RNA-seq图谱,该研究揭示了NT和HT下肿瘤细胞和caf中HSF1的差异结合程序和转录调控机制。此外,发现HT改善免疫抑制TME,并且体内小鼠模型证实了HT和程序性细胞死亡配体1 (PD-L1)阻断的联合抗肿瘤作用。这些发现为开发合理有效的基于HT的联合疗法提供了潜在的策略和见解。
参考信息:
https://www.science.org/doi/10.1126/scitranslmed.adp2124


