轻断食又“翻车”?多项研究:或使心血管疾病死亡风险飙升91%,加剧动脉粥样硬化;年轻时长期轻断食损害β细胞,代谢危机四伏
时间:2025-03-10 12:08:25 热度:37.1℃ 作者:网络
天气一回暖,空气中似乎都弥漫着健身房的味道。衣柜里的夏装也在默默提醒:是时候和冬天囤积的“储备粮”说再见了!可面对喷香诱人的外卖、舒适到不想动弹的沙发,以及无数次信誓旦旦的“减肥flag”……瘦身之路,真的道阻且长。
“减肥党”们无奈叹息:“春天不减肥,夏天徒伤悲……” 于是,一种号称既简单又高效的瘦身方法——轻断食(学名:间歇性禁食,Intermittent Fasting, IF)成了他们的新宠。无需精确计算每一餐的热量,只需调整进食时间,就能轻松减重?听上去简直是“懒人福音”!
不过,轻断食并非“一个模式走天下”,它有不同的执行方案,可根据个人作息和饮食习惯进行选择:
-
隔日断食(ADF):一天几乎不吃(仅摄入0-500大卡的极低热量),第二天恢复正常饮食,无需严格控制。
-
5:2轻断食:每周选择2天控制热量摄入(500-1000大卡),其余5天照常饮食,无需特别限制。
-
16+8限时进食:每天限定8小时为正常进食窗口,剩余16小时禁食。

听起来完美无缺?然而,现实远没有这么简单。近年来,越来越多的研究发现,轻断食并非万能,也有不少“翻车”现场。
来自上海交通大学、斯坦福大学的研究人员一项发表于《美国心脏协会杂志》(American Heart Association),涵盖超2万人的研究[1]提示,限时进食并未显现出“延长寿命”的作用,坚持16+8轻断食的群体死于心血管疾病的风险增加了91%。
而来自南方医科大学的研究团队则发现了ADF的一大健康危害——相较于自由进食,为期11周的隔日进食通过改变胆固醇代谢途径,抑制激活转录因子3的表达,从而加剧动脉粥样硬化病变的形成[2]。
短期普适、长期分化


不过,短期IF对它们的血糖调控能力却是“全员受益”!


换句话说,它们不是因为吃得更少而变瘦的,而是可能通过提高代谢效率、调节能量消耗等方式让自己“轻盈”了起来。
但当研究团队继续观察长期IF对血糖调控的影响时,发现情况变得复杂了:

这或许提示,年轻小鼠本身代谢旺盛,胰岛素功能良好,长期IF并不能再“锦上添花”。
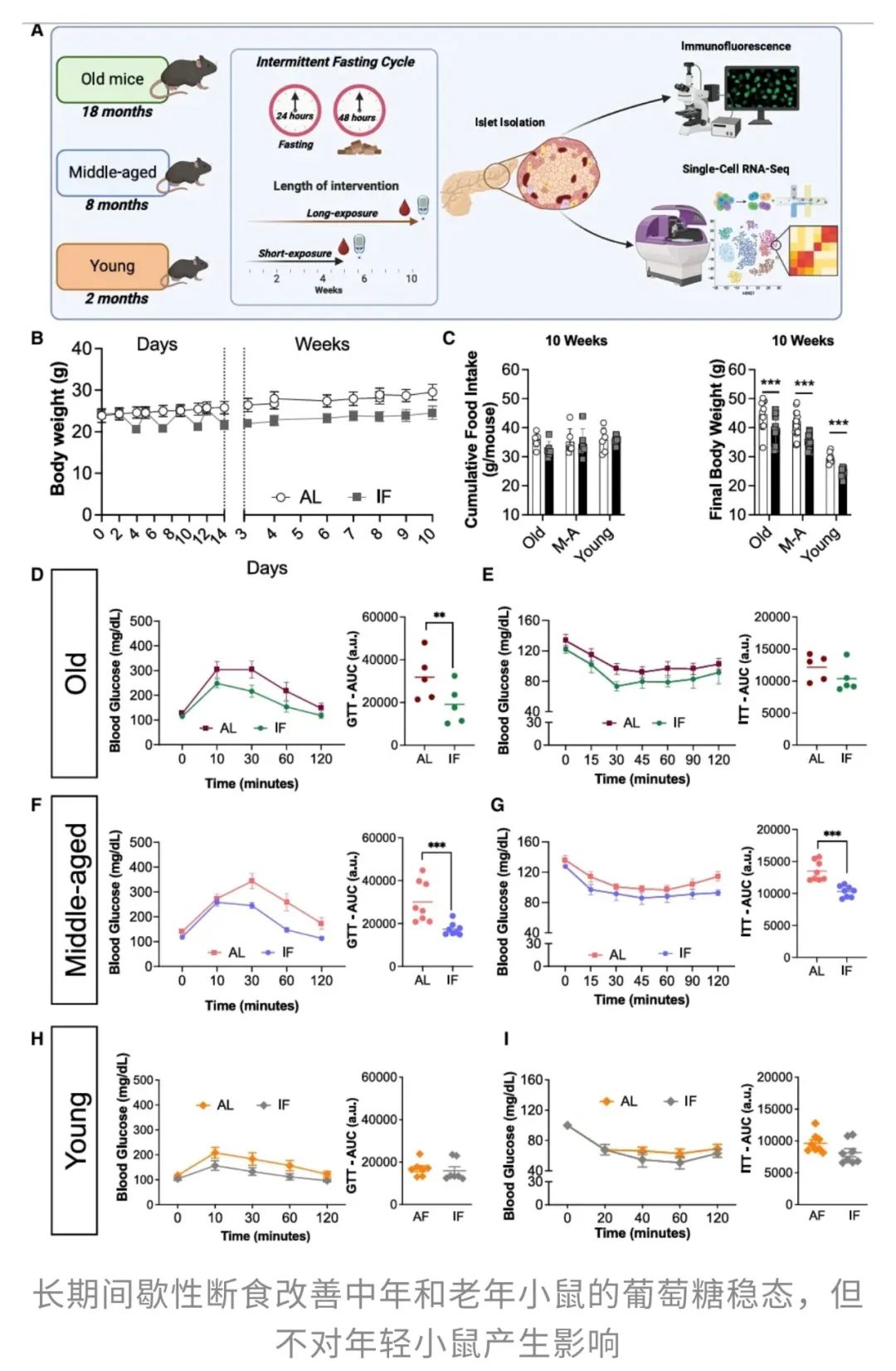
总结来看,短期IF对血糖调控的改善不分年龄,全员受益!但长期IF的效果就复杂多了,此时其代谢调节作用可能并不是“放之四海皆准”,中年小鼠受益最大,老年小鼠只能部分改善,而年轻小鼠几乎无感。
老年小鼠β细胞“进阶”,
中年小鼠“稳如泰山,
年轻小鼠意外“掉线”
说到血糖稳态维持,胰岛β细胞是关键。如果把胰岛看作是胰腺中的“内分泌小区”,那β细胞则是这个小区里最重要的“住户”之一,负责分泌胰岛素,调控血糖水平。在胰岛里,β细胞的数量占比最高,大约60%-80%,是当之无愧的“主力军”。
既然老年和中年小鼠在长期IF后血糖稳态得以改善,但年轻小鼠却未能获益,这就引发了一个疑问:长期IF是否对不同年龄的小鼠β细胞功能产生了不同影响?
研究人员带着这个问题,先测量了不同年龄小鼠在自由进食和长期IF条件下的胰腺重量。

这说明老年小鼠的β细胞在长期IF后变得更敏感、更高效,能够更快地响应高血糖环境,让血糖保持稳定。
另外,此时中年小鼠的胰岛素分泌能力与自由进食组无显著差异,表明长期IF对这一年龄组的影响较为温和。
然而,年轻小鼠的情况就没那么乐观了……在同样的高糖刺激下,年轻小鼠的β细胞分泌的胰岛素反而比自由进食组更少!换句话说,长期IF并没有让它们的β细胞“升级”,反而像是被“掏空”了一样,分泌胰岛素的能力下降了。

年轻小鼠的“胰岛之殇”:
间歇性禁食的代价?
为了弄清楚长期IF到底对年轻小鼠的胰岛造成了什么影响,研究人员首先测量了它们的胰岛整体面积。结果发现,和自由进食的小鼠相比,长期IF组的小鼠胰岛整体大小并没有明显变化,乍一看似乎“风平浪静”。

换言之,虽然胰岛的“地盘”没有缩小,但“居民”却少了不少,这可能成为胰岛功能受损的关键因素。
那么,α细胞和β细胞数量减少的原因是什么?

也就是说,长期IF让年轻小鼠的胰岛细胞“招工困难”,新生细胞供不应求,导致整体数量下降。特别是β细胞减少,会直接影响胰岛素的分泌,使年轻小鼠在高糖状态下难以有效调节血糖——这可能就是长期IF让年轻小鼠血糖调节能力下降的“罪魁祸首”!
和年轻小鼠的“惨状”不同,长期IF在老年小鼠身上表现得像是“福音”。

年轻时禁食,β 细胞可能“没发育好”?
为了揭示长期IF对β细胞影响的年龄依赖性,研究团队利用单细胞RNA测序(scRNA-seq) 技术,对长期IF后不同年龄小鼠的胰岛细胞进行了深入分析。
最引人注目的是,β细胞的成熟度在不同年龄小鼠中的表现差异明显。


换句话说,年轻小鼠的β细胞失去了应有的“活力”,导致它们的胰岛素分泌能力下降,从而影响了血糖的稳定。
更令人意外的是,研究人员进一步分析了人类1型糖尿病和2型糖尿病患者的胰岛RNA-seq数据,发现:在T1D患者的胰岛样本中,那些在年轻长期IF组β细胞中下调的基因也呈现出类似的表达模式,这一发现表明,长期IF可能会以类似T1D的机制损害年轻小鼠的 β细胞功能,从而影响其胰岛素分泌能力。不过,在T2D患者中,并未观察到相同的基因表达模式。
总的来说,这项研究提示短期IF可增强血糖稳态和胰岛素敏感性,但长期IF并非对所有人群都有相同的益处,尤其是对于年轻个体和T1D高风险人群,长期IF可能带来意想不到的风险。
看来,虽说轻断食在减肥界混得风生水起,可年轻人想靠它“弯道超车”,没准就给β细胞来了个“下马威”,血糖调控能力“溜”走了。这事还是不能盲目跟风,得“量体裁衣”,别让身体“吃不消”,也别让这“减肥大计”变成健康陷阱。
仍需指出的是,研究对象为小鼠模型,尽管在预临床研究中有一定价值,但无法完全模拟人类的代谢过程,因此其发现不能直接推广到人类。


