惊爆内幕!麝香保心丸抗动脉硬化的神秘面纱揭开:代谢组学+网药联合大揭秘
时间:2025-03-08 12:08:34 热度:37.1℃ 作者:网络
动脉粥样硬化(AS)是一种持续性的炎症状态,其特征是在动脉壁,尤其是主动脉和冠状动脉中形成显著的动脉粥样硬化病变。有研究表明,AS是心血管疾病的基础病理机制;该病促进了血管内膜斑块的形成,导致受影响动脉腔的狭窄甚至闭塞,进而引发器官功能障碍或组织坏死。近年来,随着现代医学的进步,可用于心血管疾病治疗和预防的药物种类得到了扩展,然而,传统的西医疗法在某些患者中可能疗效有限或难以承受。因此,迫切需要有效的补充和替代疗法来维护心血管系统的健康。
麝香保心丸(SBP)由麝香、人参、人工牛黄、苏合香、蟾酥、肉桂和冰片等药物组成,能够减轻脂质积累,抑制炎症相关通路的激活,并具备扩张正常及病变冠状动脉的功能,在心血管疾病的治疗中得到了广泛的应用。值得注意的是,除了在心血管疾病方面的应用,研究还指出SBP能够针对线粒体抑制代谢紊乱,改善由缺血-再灌注损伤引起的认知障碍,甚至可能缓解抑郁和焦虑症状。尽管已有大量研究证实了SBP的治疗效果,但由于对其复杂作用机制缺乏明确的解释,SBP的全球推广和应用仍面临挑战。
日前,一篇名为“Integrated metabolomics and networkpharmacology to reveal the mechanisms of Shexiang Baoxin pill against atherosclerosis”的研究论文揭示了SBP抗AS的潜在作用机制。

图1 论文首页
SBP对脂质水平和AS病变的影响
在实验的全过程中,每三周对实验小鼠的体重进行一次记录。各组之间未发现具有统计学意义的差异,这表明SBP并未对小鼠的食欲或能量消耗产生干扰。与模型组相比,治疗组在经过SBP灌胃12周后,TC、TG和LDL-C水平显著降低(图2A-C)。此外,ALT、AST、尿素水平在各组间未显示出显著性差异,表明SBP对小鼠的肝肾功能无显著影响(图2D-F)。
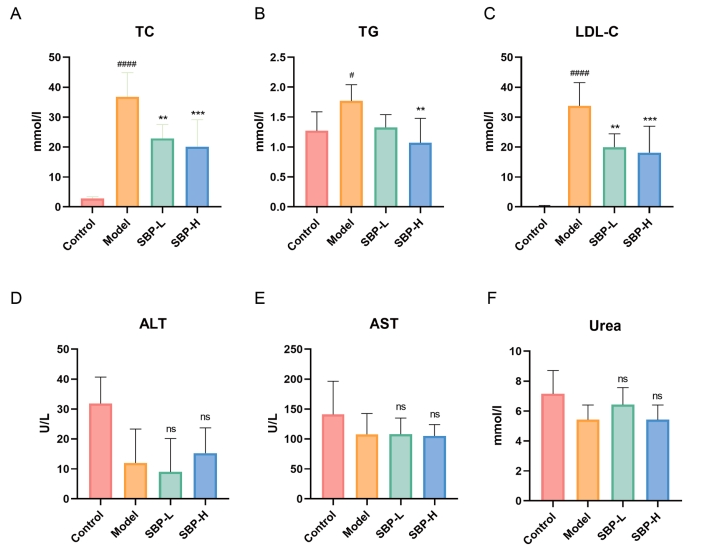
图2 SBP对小鼠脂质和肝肾功能的影响
在组织病理学领域,研究首先通过量化主动脉斑块病变的大小来评估SBP对AS的影响。在实验组中,反映主动脉粥样硬化程度的油红O染色区域的百分比显著高于对照组,而SBP则抑制了这种变化(图3A)。此外,HE和Masson染色的主动脉根部病变面积及胶原含量也是评估AS的重要指标,显示SBP对病变面积和胶原含量的增加有显著的逆转作用(图3B-C)。这些结果表明,SBP通过减少脂质积累和抑制主动脉斑块的形成来改善AS。
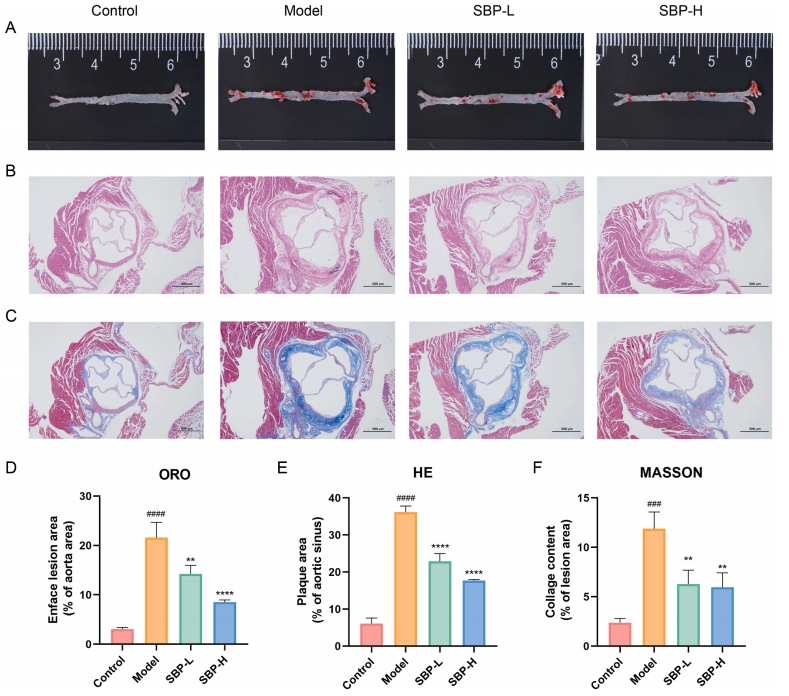
图3 SBP对小鼠动脉粥样硬化病变的影响
SBP对TMAO处理的HUVECs迁移、凋亡和氧化应激的影响
为了进一步阐释SBP是否能够通过抑制TMAO改善AS及内皮功能障碍,研究采用TMAO作为AS的诱导剂,进行了后续实验。首先,通过CCK-8检测TMAO是否会引起细胞毒性。结果显示,与不含TMAO的对照组相比,经不同浓度(50、100、200、500、1000或2000µM)TMAO处理的HUVECs细胞活力变化微乎其微,说明在这些浓度下TMAO对HUVECs无细胞毒性作用。对初始处理组和划伤后24小时的创面面积进行量化和比较后发现,TMAO抑制了细胞迁移,而SBP组则表现出相反的效果。这表明,SBP能够刺激细胞迁移,而TMAO则具有抑制作用(图4A-B)。
此外,研究采用了流式细胞术探究TMAO和SBP对内皮细胞凋亡的作用。TMAO提升了细胞早期及晚期凋亡的比例,但在SBP的干预下,凋亡细胞的比例有所下降,这表明SBP能够抑制由TMAO引起的细胞凋亡(图4C-D)。鉴于氧化应激是AS进展中的关键因素,研究进一步探讨了SBP是否参与了细胞内ROS的清除过程。结果显示,TMAO显著提高了HUVECs中的ROS水平,而SBP则阻断了这一过程,并降低了内皮细胞的氧化应激水平(图4E-F)。综合以上结果,可以得出结论,SBP能够抑制由TMAO诱导的HUVECs细胞凋亡和氧化应激,并缓解TMAO对细胞迁移能力的抑制作用。
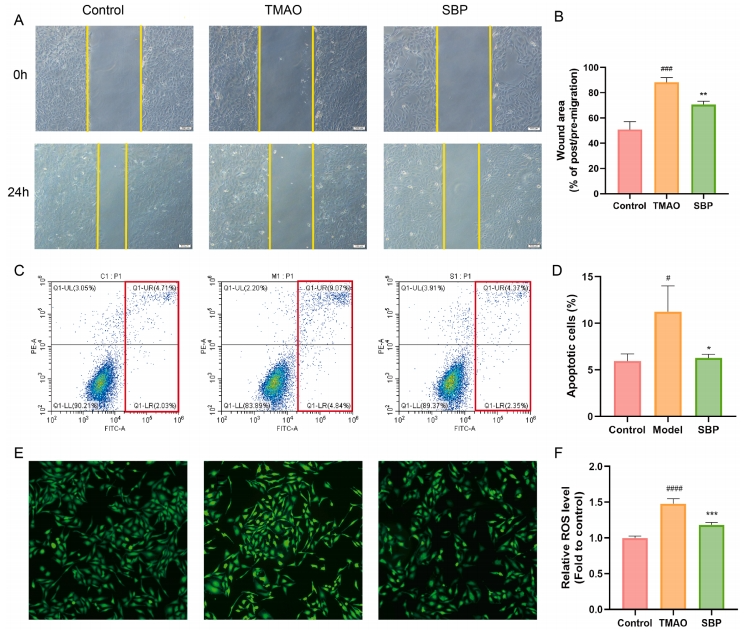
图4 SBP对TMAO诱导的HUVECs损伤的影响
SBP在体内和体外均可减轻内皮细胞功能障碍
内皮功能障碍已被确认为AS诱导的初始因素之一,VCAM-1和ICAM-1的表达在内皮功能障碍的调节中扮演着至关重要的角色。免疫组织化学实验结果显示,在模型组中,VCAM-1和ICAM-1的水平显著升高,而SBP则抑制了这两种蛋白的表达(图5A-D)。
在体外实验中,研究观察到TMAO能够增加HUVECs中ICAM-1和VCAM-1的表达,而SBP组则显示出明显的降低趋势,这表明SBP参与了对TMAO诱导的内皮损伤的保护作用。此外,LOX-1作为内皮功能障碍的另一指标,研究者观察了其在TMAO和SBP作用下的表达变化。结果显示,TMAO能够诱导HUVECs中LOX-1表达的上调,而这一上调随后被SBP所抑制(图5E-H)。这表明,SBP能够降低主动脉根部和HUVECs中LOX-1、ICAM-1和VCAM-1的表达,这反映了SBP通过缓解内皮功能障碍对AS的保护作用。

图5 SBP对内皮功能障碍的影响
SBP通过降低MAPK3、AKT1和STAT3的表达来改善AS
初步的网络药理学与代谢组学研究认为MAPK3、AKT1和STAT3是SBP参与AS调控的关键靶点。研究通过免疫组化分析进行验证,结果显示,MAPK3在模型组中的表达上调,而在SBP处理组中表达下调(图6A-B)。对各组小鼠主动脉组织进行的Western blot分析揭示,SBP逆转了磷酸化(P)-MAPK3、P-AKT1和P-STAT3表达的增加趋势(图6C-F)。同时,体外实验结果表明,TMAO促进了HUVECs中P-MAPK3、P-AKT1和P-STAT3的表达,而SBP则抑制了这些基因的表达(图6G-J)。综上所述,这些结果为SBP通过调节MAPK3、AKT1和STAT3缓解AS提供了证据。
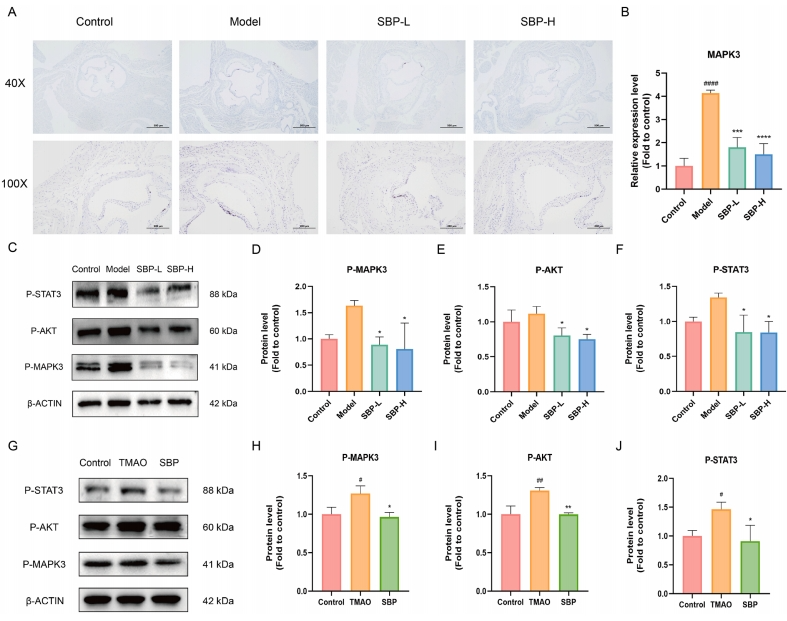
图6 SBP的机制验证
结论
总之,该研究揭示了SBP在TMAO促进AS过程中的多重作用机制,确定了SBP作为关键治疗靶点对TMAO诱导的AS进展的影响。SBP可能通过直接或间接的方式调节TMAO水平,从而对AS产生改善作用。
参考文献:
Li D, Chen R, Xu X, Hou Y, Li Z, Huang C, Zhang G, Wang B, Li B, Chu X. Integrated metabolomics and network pharmacology to reveal the mechanisms of Shexiang Baoxin pill against atherosclerosis. Phytomedicine. 2024 Dec;135:156138. doi: 10.1016/j.phymed.2024.156138


