NBT:诺奖得主Jennifer Doudna教授新作,首次实现活细胞天然RNA单分子实时追踪
时间:2025-03-04 12:12:22 热度:37.1℃ 作者:网络
RNA在细胞中扮演着多种关键角色,例如直接参与蛋白质合成,在转录和转录后调控基因表达等,因此对RNA进行实时追踪可以帮助研究人员更好地探索和理解其在细胞和生物体内的行为和功能。但RNA是一个具有动态产生性的分子,具有复杂的高级结构与相互作用,以及特定的时间、空间分布及不同的转录后修饰状态,已有研究只能通过固定细胞成像或荧光标记等来推测RNA分子的行为。2019年,华东理工大学杨弋教授团队及合作者首次实现了动物细胞中不同种类RNA的标记与无背景成像,解决了活细胞RNA实时标记与成像的难题。但截止到目前,活细胞中未修饰的内源性RNA单分子成像尚未有通用方法可用。
近日,2020年诺贝尔化学奖得主Jennifer A. Doudna教授团队在Nature Biotechnology发文报道了活细胞RNA单分子成像的最新突破性进展,首次实现了对活细胞中天然RNA的单分子实时追踪。

作为CRISPR基因编辑技术先驱 ,Doudna教授领导团队创新的将可编程RNA引导、RNA靶向CRISPR-Csm系统与多路gRNA相结合,开发了单分子活细胞荧光原位杂交方法(smLiveFISH),用于直接、高效地可视化一系列细胞类型(包括原代细胞)中任何未修饰的内源性单个mRNA分子。研究表明,smLiveFISH有可能帮助解析控制健康和疾病中天然转录本时空组织的原理。
虽然来自不同类型CRISPR-Cas系统(例如RCas9、dCas13、dCsm)已被用于标记活细胞中的靶标RNA。但这些方法尚未达到单分子分辨率,因为每个RNA都有一个单一的crRNA靶向,这导致自由RNA和靶向RNA之间的荧光强度相似。只有RNA granules或具有重复序列的RNA才能从结合RNPs的多个拷贝中产生足够信号,这与非特异性结合或背景信号是有区别的。
为了克服信噪比问题,Doudna团队从smFISH中获得了灵感。研究团队推断,如果荧光标记的RNA可以同时沿着靶RNA平铺,那么活细胞中内源性RNA的单分子成像是可能的(图1a)。通过多次比较分析,研究团队最终选择来自嗜热链球菌的RNA靶向III-A型CRISPR-Csm系统和多导RNA,设计了靶向RNA的crRNA探针阵列,结合多荧光标记Csm复合物(每个复合体携带≥3个GFP标记),成功开发了活细胞RNA单分子成像方法smLiveFISH,用于追踪不同类型活细胞中的单个mRNA分子。
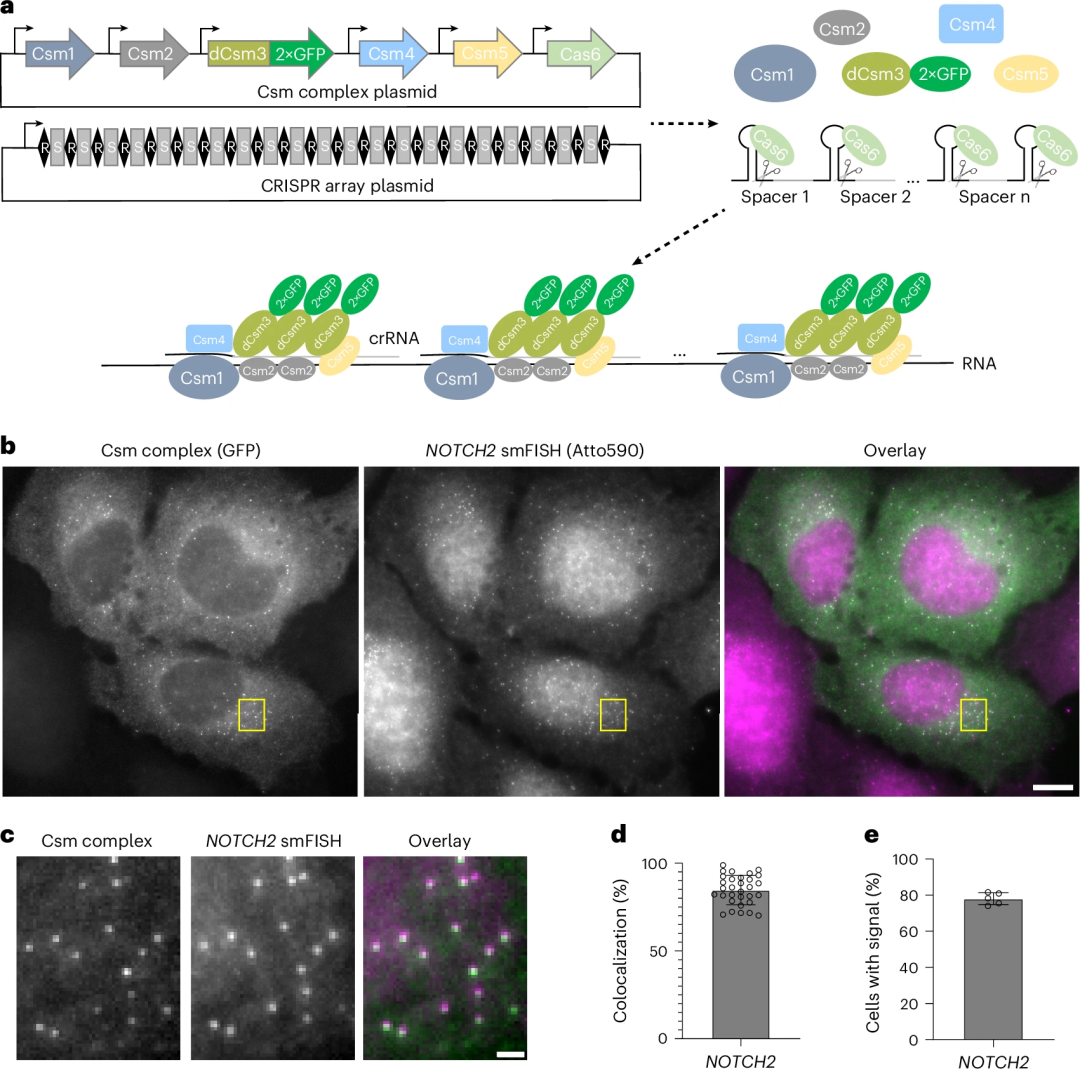
图1.天然mRNA单分子的smLiveFISH成像。a:smLiveFISH系统的原理图。b:左图为GFP标记的Csm复合物和48个NOTCH2靶向crRNA标记的单个NOTCH2 mRNA的固定细胞图像;中图为smFISH探针标记的单个NOTCH2 mRNA图像;右图为重叠图。c:b图中黄色框区域的放大图。d:Csm复合foci与smFISH foci共定位的百分比。e:Csm复合物标记foci的转染细胞百分比。
为了验证smLiveFISH方法,研究团队利用其在活细胞中追踪了两种不同mRNA:NOTCH2和MAP1B。研究发现NOTCH2 mRNA包括两个种群,它们具有不同的动态,与内质网的共翻译易位相关。与之相反,MAP1B mRNA表现出几种不同的行为,包括MAP1B mRNA向细胞外周的定向转运,并且其定向转运不依赖于翻译。
在NOTCH2的分析中,成像结果显示,Csm标记与smFISH点强共定位,表明GFP标记的Csm复合物成功标记了内源性NOTCH2 mRNA。定量分析显示85%的Csm标记与smFISH点共定位。此外,将smLiveFISH应用于其他细胞系,包括HEK293T、HeLa、原代人成纤维细胞IMR-90和非洲绿猴COS-7,在所有细胞类型中都发现了内源性NOTCH2 mRNA的强大信号。
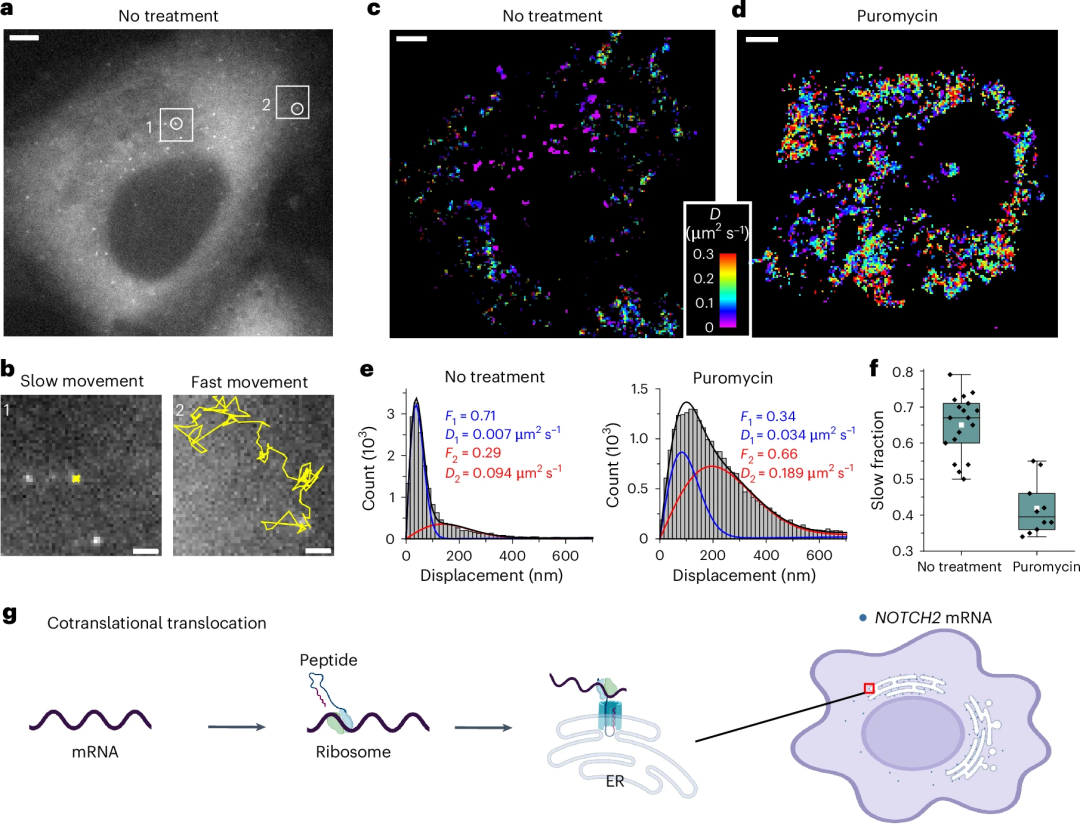
图2.活细胞中单个NOTCH2 mRNA的动态。
MAP1B具有不同于NOTCH2 mRNA的空间定位模式。研究团队使用GFP荧光检测在细胞质中观察到单分子点,并观察到Csm标记与smFISH点有很强的共定位。使用smLiveFISH,研究进一步分析了标记RNA种类的空间分布,发现MAP1B mRNA在细胞外周富集,而NOTCH2 mRNA在核周区域富集,这与此前固定细胞中的RNA FISH结果一致。
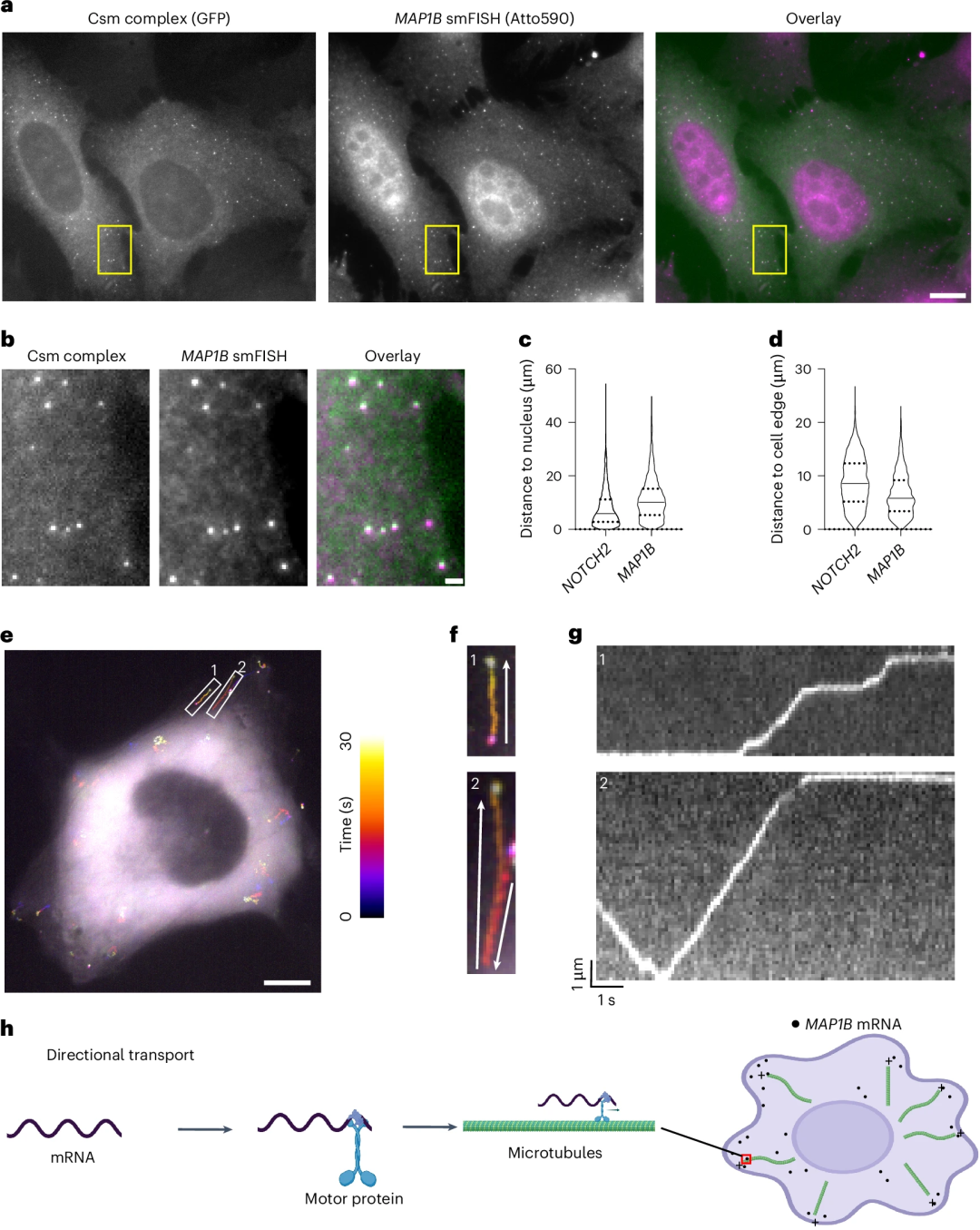
图3.活细胞中单个MAP1B mRNA的动态。
在活细胞成像中,研究发现MAP1B mrna向细胞边缘的线性运输,在此基础上它们保持相对静止,这与NOTCH2不同。虽然MAP1B mRNA偶尔向后面的细胞核方向移动,但最终再次向细胞边缘移动。
此外,进一步分析表明,smLiveFISH可以检测到响应小分子的单转录本定位的差异,例如整合到p -小体中,强调了评估单个内源性RNA行为的实用性。
综上,SmLiveFISH能够在单分子分辨率实时追踪活细胞中未修饰的内源性mRNA,揭示它们在时空动态。与以往的活细胞RNA成像技术相比,SmLiveFISH是一个显著的进步。该方法不需要外源表达或RNA的遗传标记,可用于低丰度和非重复RNA成像,同时保持单分子分辨率和低背景噪声。利用smLiveFISH,研究发现共翻译易位和定向转运是NOTCH2和MAP1B mRNA分别定位到核周和外周区域的两种不同方式。
SmLiveFISH作为一种敏感的检测方法,能够以固定细胞检测无法实现的方式来探索MAP1B mRNA等分子机制,例如通过检测mRNA运输速度的变化或逐步位移。这些分析可能有助于揭示以RNA为中心的疾病(如脆性X综合征和肌萎缩性侧索硬化症)的病理机制。研究团队希望smLiveFISH能够加速不同种类RNA在不同条件下的时空动态研究,并在RNA、细胞生物学和神经生物学领域得到直接应用。
论文原文:
Xia, C., Colognori, D., Jiang, X.S. et al. Single-molecule live-cell RNA imaging with CRISPR–Csm. Nat Biotechnol (2025). https://doi.org/10.1038/s41587-024-02540-5


