Biomolecules:铁死亡在脑出血后血脑屏障功能障碍中的关键作用
时间:2025-03-04 12:10:42 热度:37.1℃ 作者:网络
脑出血是一种毁灭性的疾病。目前临床实践中的治疗方法旨在减轻局部机械损伤引起的即刻脑损伤。然而,脑出血会诱发继发性脑损伤,导致脑组织进一步损伤,大大超过出血的直接面积,导致更差的临床结局。
临床研究通过影像学扫描表征了出血周围水肿的形成,并确定虽然脑出血逐渐恶化,但周围水肿在初始出血事件后 2-3 周内相应增加。水肿形成的程度与较差的临床结局相关。因此,必须怀疑血肿逐渐释放的降解产物会导致脑出血的继发性损伤。
实验研究侧重于特定的信号通路、分子或蛋白质,以确定潜在的治疗靶点,但这些高度特异性的研究方法尚未导致脑出血的成功治疗方案。虽然血脑屏障的破坏已被确定为出血周围水肿形成的主要因素,并且近年来铁在各种疾病的发病机制和进展中的关键作用已被揭示,但速发性血液降解产物(如铁)对血脑屏障功能及其脑出血中继发性损伤的影响尚未得到彻底研究,因此,有必要研究铁死亡与脑出血后血脑屏障功能改变及其脑出血中的继发性损伤。
1月22日,Friedrich-Alexander大学的Stefanie Balk教授研究团队在Biomolecules(IF=4.8)上在线发表了题为“Intracerebral Hemorrhage-Associated Iron Release Leads to Pericyte-Dependent Cerebral Capillary Function Disruption”的研究,结果提示,位于脑毛细血管分支部位的周细胞受铁死亡特别影响,导致毛细血管破裂和血管收缩,而 ferrostatin-1 部分阻止了这些。游离铁诱导脑毛细血管功能的周细胞依赖性破坏,是减轻脑出血后继发性损伤的治疗靶点。

本研究表征了血液成分、降解产物及其在继发性脑损伤中的影响。使用人类细胞培养物和人类离体脑组织切片进行免疫细胞和免疫组织化学、荧光激活细胞分选、WST-1检测和 RNA 测序。在神经外科手术期间,立即收集、冷却和切片脑组织,以对人脑的活组织切片进行实验。在血液降解产物中,游离铁对周细胞功能和存活产生不利影响。RNA 测序显示铁死亡是主要细胞机制,通过谷胱甘肽过氧化物酶4(Glutathione Peroxidase 4, GPX-4)介导进行通路分析,并最终导致氧化细胞死亡。具体结果如下:
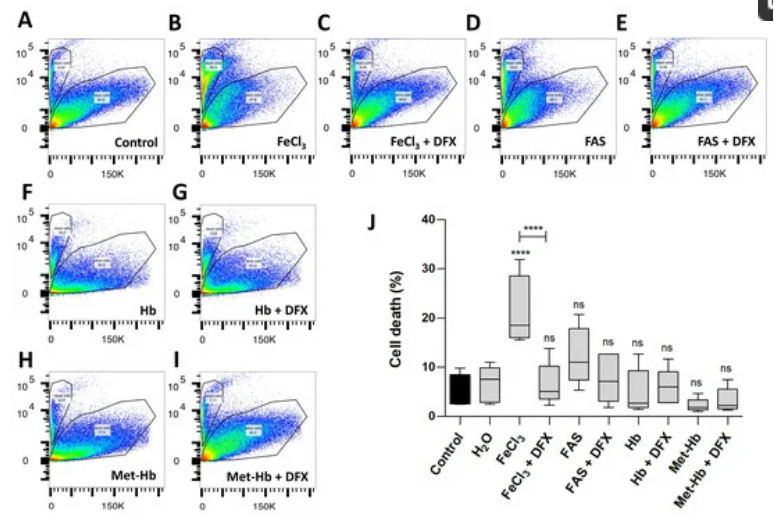
图1.二价和三价铁对周细胞存活率的影响
铁和血红蛋白对人毛细血管周细胞的存活和功能的影响,这些周细胞是维持血脑屏障的必需细胞:这项研究表明游离铁作为人脑周细胞中的一种特定类型的细胞死亡诱导铁死亡,导致血脑屏障功能障碍、血管连续性破坏和血管收缩。暴露于三价铁后比暴露于二价铁后更明显。所以该研究表明,除了血红蛋白的清除作用之外,还有其他因素可能导致血管痉挛和细胞死亡。这些额外的因素可能是铁诱导毒性的结果,这反过来又可以解释脑出血中延迟性继发性脑损伤的发展,特别是因为血红蛋白降解为游离铁需要一些时间。三价铁而不是血红蛋白导致铁死亡诱导的周细胞死亡的发现很有趣,并表明了清除游离铁是减轻脑出血后继发性损伤的治疗靶点。
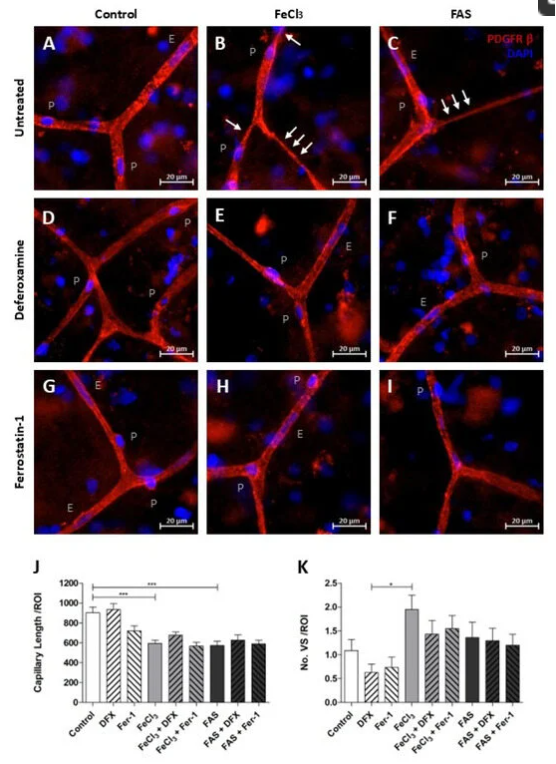
图2.铁暴露会损害毛细血管的结构完整性
为了阐明潜在的细胞内机制,研究对三价铁暴露的周细胞进行了全基因组 RNA 测序通路分析:该研究发现当周细胞暴露于铁时,TMEM119 是激活率最高的基因之一。已知TMEM119激活ATF4,ATF4是代谢和氧化还原过程的调节因子,对谷胱甘肽系统(包括GPX-4)很重要。研究使用离体人脑组织切片评估了 GPX-4 在毛细血管床中周细胞中的空间分布。当暴露于三价铁时,GPX-4 在周细胞中升高,主要在毛细血管分支位点,血脑屏障被破坏,水肿形成加剧,脑出血后继发性损伤。总之由于损伤过程,诱导氧化还原系统的基因同时激活,当周细胞暴露于三价铁时,谷胱甘肽系统以及铁死亡在细胞死亡中起重要作用。
铁和铁死亡引起的脑损伤可以预防。在细胞培养实验中,铁螯合剂去铁胺有效地恢复了周细胞的功能和存活率,并在几乎所有涉及铁或血液降解产物的体外实验研究中都产生了积极的结果 ,但在人脑组织切片实验中无效。去铁胺和铁司他汀-1 在挽救人脑切片方面无效的一个可能解释是,与细胞培养实验相比,该系统有其固有的复杂性,许多影响因素(例如,细胞间相互作用、神经递质的释放等)仍有待阐明。这项工作展示了新治疗靶点在细胞培养中的潜力,但也强调了与复杂系统应用相关的挑战。
总而言之,该研究首次证明,当暴露于三价铁时,人脑周细胞会发生铁死亡,这是一种特定类型的细胞死亡,并可能导致血脑屏障功能障碍、血管连续性破坏和血管收缩增加。游离铁和铁死亡是减轻脑出血继发性脑损伤的治疗靶点。未来的研究应评估铁螯合剂和铁死亡抑制剂以及脑出血的微创手术治疗。
原始出处:
Intracerebral Hemorrhage-Associated Iron Release Leads to Pericyte-Dependent Cerebral Capillary Function Disruption. Biomolecules. 2025 Jan 22;15(2):164. doi: 10.3390/biom15020164. PMID: 40001467; PMCID: PMC11852616.


