Cell Metab:上海药物研究所谢岑等发现肝鞘磷脂磷酸二酯酶3通过破坏膜鞘脂代谢促进脂肪性肝炎
时间:2025-03-02 12:08:33 热度:37.1℃ 作者:网络
代谢功能障碍相关的脂肪性肝炎(MASH)仍然是一个主要的健康挑战。
2025年2月26日,中国科学院上海药物研究所谢岑、柳红、Liu Yameng、上海交通大学谢青共同通讯在Cell Metabolism在线发表题为“Hepatic sphingomyelin phosphodiesterase 3 promotes steatohepatitis by disrupting membrane sphingolipid metabolism”的研究论文,该研究发现肝鞘磷脂磷酸二酯酶3通过破坏膜鞘脂代谢促进脂肪性肝炎。该研究确定鞘磷脂磷酸二酯酶3 (SMPD3)是通过增加细胞膜上鞘磷脂的水解来促进肝脏神经酰胺积累的关键驱动因子。肝细胞特异性Smpd3基因破坏或SMPD3的药物抑制减轻了MASH,而重新引入SMPD3逆转了MASH的分解。
尽管健康肝脏表达低水平的SMPD3,但脂毒性诱导的DNA损伤抑制sirtuin 1 (SIRT1),触发MASH期间SMPD3的上调。这破坏了膜鞘磷脂-神经酰胺平衡,并通过增强脂肪变性肝细胞的小窝依赖性脂质摄取和细胞外囊泡分泌来加剧炎症和纤维化,从而促进疾病进展。因此,SMPD3充当了集成关键MASH标志的中心枢纽。值得注意的是,研究人员发现了一种同时激活SIRT1和抑制SMPD3的双功能药物,这在MASH治疗中显示出显著的治疗潜力。这些发现表明,抑制肝脏SMPD3恢复了膜鞘脂代谢,并为开发新的MASH疗法带来了巨大的希望。

代谢功能障碍相关脂肪性肝病(MASLD),以前称为非酒精性脂肪性肝病(NAFLD),是肝硬化、癌症和移植的主要原因,影响全球25%的成年人。代谢功能障碍相关脂肪性肝炎(MASH)的特点是脂肪变性、肝细胞气球样变、炎症和纤维化。值得注意的是,MASH是治疗变得必不可少的阶段,但有效的干预措施仍然有限。从单纯脂肪变性向MASH转变的一个驱动因素是脂毒性,这会导致细胞应激、肝损伤、炎症和纤维化。然而,脂毒性物质及其如何引发下游事件在很大程度上是未知的。
鞘脂在膜结构和细胞过程中发挥不同的作用。肝脏是鞘脂合成的主要场所,特别容易受到脂毒性鞘脂的影响。神经鞘脂代谢失调与MASLD发展有关,神经酰胺是脂毒性的主要贡献者。神经酰胺是神经鞘脂代谢的核心,主要通过两种途径产生:从头合成和鞘磷脂水解。涉及SPTLCs、CERSs和DEGSs等酶的从头合成已在肥胖症、糖尿病和MASLD中得到充分研究。一旦形成,神经酰胺进一步转化为鞘磷脂,预计在MASLD中会增加。有趣的是,MASLD患者的神经酰胺水平升高,而鞘磷脂的变化很小,表明鞘磷脂水解在MASLD进展中的作用显著但尚未得到充分研究。尽管对从头合成进行了广泛的研究,但在MASLD/MASH中对鞘磷脂水解途径的探索仍然较少。
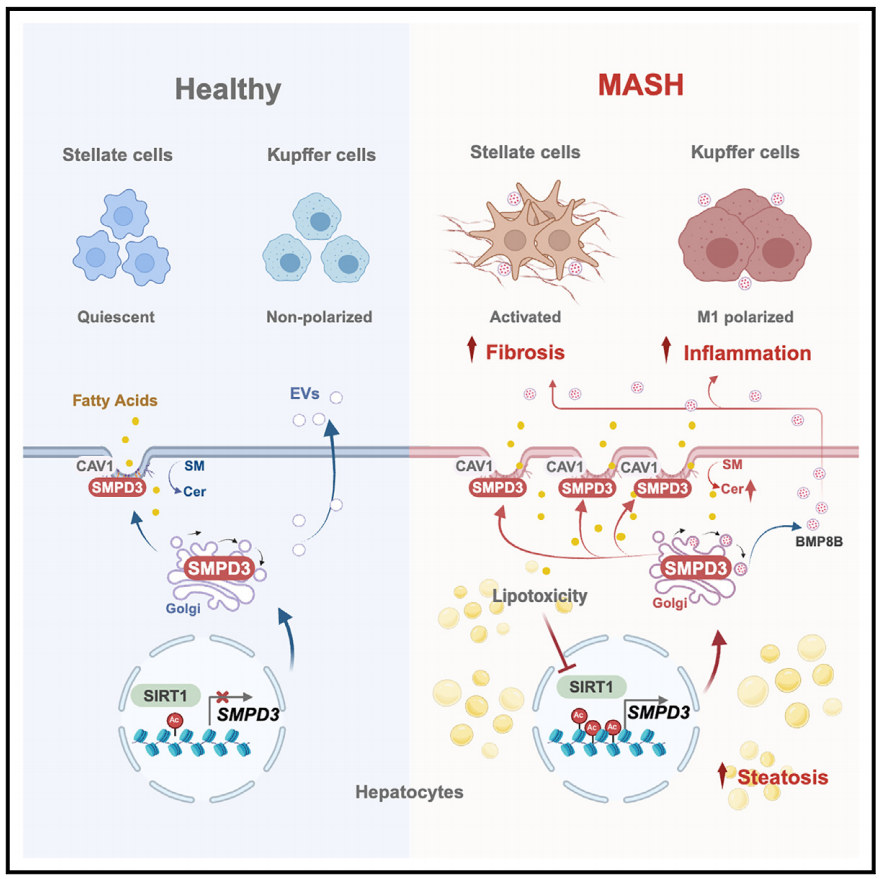
机理模式图(图源自Cell Metabolism)
鞘磷脂磷酸二酯酶(SMPD)通过在各种刺激下从膜结合的鞘磷脂中裂解磷酸胆碱基团来快速生成神经酰胺。根据最佳pH值和在不同细胞器、细胞和组织中的分布,SMPD被分为酸性、中性和碱性家族。对MASLD数据集的分析显示,SMPD3(也称为中性鞘磷脂酶2 [nSMase2])在MASLD肝脏中显著升高。SMPD3定位于质膜(PM)和高尔基体的内小叶,并调节几种细胞过程,如凋亡、应激反应、炎症信号和细胞外泡(EV)介导的通讯。
在这项研究中,研究人员发现MASH患者血清神经酰胺水平升高主要源于SMPD3介导的鞘磷脂水解,而不是从头合成。虽然SMPD3在健康人肝脏中表达很低,但脂肪变性向MASH转变过程中的脂毒性触发了sirtuin 1 (SIRT1)依赖性SMPD3上调,特别是在PM。这因此增强了促炎性和促纤维化EVs的小窝依赖性脂质摄取和分泌。Smpd3基因的肝脏破坏或SMPD3抑制显著改善了MASH。此外,还发现了DC17,一种激活SIRT1并抑制SMPD3的双功能药物,对MASH具有显著的治疗潜力。该研究揭示了PM的鞘磷脂-神经酰胺失衡是MASH的一个独特代谢特征,并将SMPD3定位为一个有希望的治疗靶点。
参考消息:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00016-6


